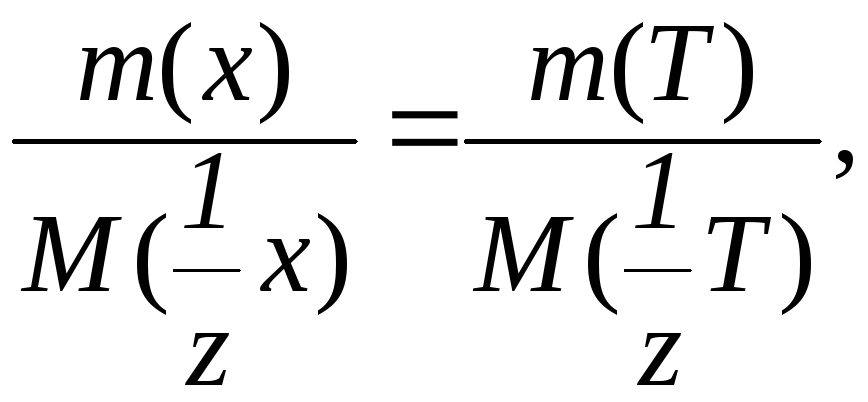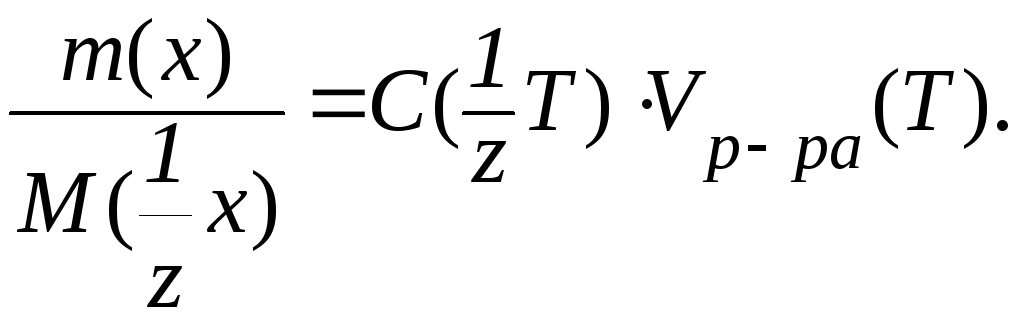- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
Элементы количественного анализа
В настоящее время методы количественного анализа находят широкое применение в медицине и смежных с ней областях, а именно:
при клиническом исследовании биологических жидкостей (крови, мочи, слюны, спинномозговой жидкости, желчи), проводимом в целях постановки диагноза и назначения курса лечения;
при разработке, производстве и тестировании всех без исключения лекарственных средств;
при оценке экологической обстановки: санитарно-гигиенического обследования загрязненности воздуха, состояния водоемов, присутствия химических веществ в почве и продуктах питания и т. д.
Количественный анализ представляет собой совокупность химических, физических, физико-химических методов анализа, позволяющих с требуемой точностью определять содержание отдельных составных частей в образце анализируемого вещества или их концентрации в растворе.
Количественный анализ включает в себя весовой и объемный методы.
Объемный (титриметрический) метод анализа
Основу данного метода составляет измерение объема титранта (раствора с точно известной концентрацией), затраченного на реакцию с заранее известным точным объемом раствора анализи-руемого вещества (или его навески) до момента окончания реакции между ними (до наступления точки эквивалентности).
Процесс постепенного добавления титранта к анализируемой пробе называется титрованием, а момент завершения реакции точкой эквивалентности.
В зависимости от типа реакции, лежащей в основе объемного определения, а также применяемых титрантов, различают несколько методов объемного анализа:
1) нейтрализации (кислотно-основного титрования);
2) осаждения;
3) оксидиметрии (перманганатометрии и иодометрии);
4) комплексонометрии.
Реакции, используемые в объемном анализе, должны отвечать следующим требованиям:
1. Вещества должны реагировать в строго определенных количественных соотношениях.
2. Реакции должны протекать быстро и практически до конца.
3. Точка эквивалентности должна фиксироваться быстро и точно.
4. Титрование не должно сопровождаться побочными реакциями, искажающими результаты анализа.
Расчеты в объемных методах анализа Закон эквивалентов
Основой расчетов в любом методе является закон эквивалентов:
Количество вещества эквивалента реагирующих между собой веществ одинаково.
Условимся в дальнейшем любое анализируемое вещество обозначать х, а любой титрант Т. Тогда закон эквивалентов запишется:
|
|
(1) |
Равенство количества вещества эквивалента можно также представить в виде:
|
|
(2) |
|
|
(3) |
Очевидно, что выражения (2) и (3) вытекают из уравнения (1). Поэтому в некоторых случаях в расчетах удобно применять комбинированные формы уравнений. Например:
|
|
(4) |
Основными способами выражения концентраций растворов в объемном анализе являются молярная концентрация эквивалента вещества и титр раствора. Они связаны между собой следующими соотношениями:


Кислотно-основное титрование
(метод нейтрализации)
Основу метода составляет реакция нейтрализации:
H+ + OH = H2O.
Данный метод используется:
– для анализа желудочного сока (определение общей и свободной НСl), буферной емкости крови, спинно-мозговой жидкости;
– при анализе лекарственных препаратов, относящихся к классам органических кислот (ацетилсалициловая, бензойная, никотиновая и др.) или оснований (водный раствор аммиака);
– в санитарно-гигиенической оценке воды, определении содер-жания аммиака в питьевой и сточной воде и т. д.