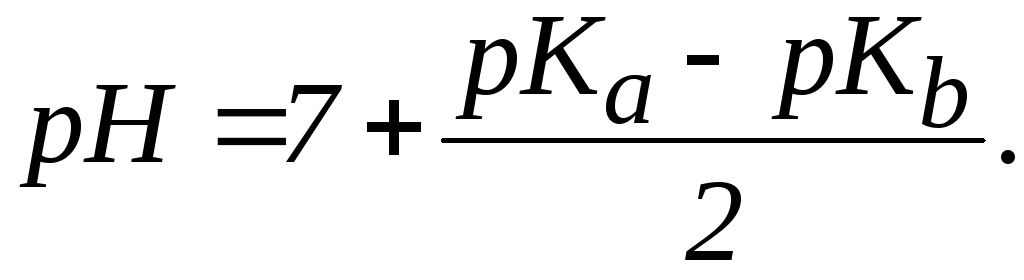- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
Значения рН растворов гидролизующихся солей
Растворы гидролизующихся солей находят применение в медицинской практике. Так, при попадании на кожу растворов кислот пораженные участки обрабатывают сначала водой, а затем раствором карбоната натрия Na2CO3. Такой способ позволяет нейтрализовать остатки кислоты, так как водный раствор Na2CO3 имеет щелочную реакцию. Однако растворы Na2CO3 вряд ли следует применять для снижения повышенной кислотности желудочного сока ввиду достаточно высокой щелочности. Для этих целей применяют растворы гидрокарбоната натрия NaHCO3, которые характеризуются более низким значением pH. В этой связи, для точного использования препарата, действие которого основано на гидролизе, врачу необходимо уметь оценивать величины pH растворов гидролизующихся солей.
1. В растворах солей типа NH4Cl:
|
|
(8) |
или
|
|
(8´) |
где
![]() ,
pC,
,
pC,
![]() отрицательные
десятичные логарифмы соответствующих
величин.
отрицательные
десятичные логарифмы соответствующих
величин.
Так
как при t0
= 20-250C
![]() = 14, то
= 14, то
![]() ,
следовательно:
,
следовательно:
|
|
(8´´) |
2. В растворах солей типа CH3COONa:
|
|
(9) |
или
|
|
(9´) |
3. В растворах солей типа NH4CN:
|
|
(10) |
или
|
|
(10´) |
В
случае равенства
![]() =
= ![]() дробная часть формулы обратится в ноль
и рН 7.
дробная часть формулы обратится в ноль
и рН 7.
Если соль гидролизуется в несколько ступеней, то можно считать, что значение рН раствора этой соли будет определяться только первой ступенью гидролиза.
Эталоны решения задач
1. Вычислить
константу и степень гидролиза соли
NH4Cl
в растворе с С(NH4Cl)
= 0,1 моль/л,
если
![]() (NH3Н2О)
1,8105.
(NH3Н2О)
1,8105.
Решение.
N
сильная кислота
слабое основание
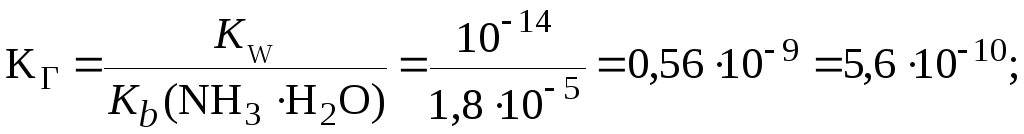

2. Вычислить
константу и степень гидролиза Na2CO3
по первой ступени в растворе с С(Na2CO3)
0,01 моль/л,
если для H2CO3
![]() 4107;
4107;
![]() 51011.
51011.
Решение.
Гидролиз Na2CO3 протекает ступенчато:
Na2CO3 HOH ⇄ NaHCO3 NaОН (1 ступень)
В сокращенном виде уравнение выглядит так:
C
слабая кислота
сильное основание
NaHCO3 HOH ⇄ H2CO3 NaОН (2 ступень)
H
слабая кислота
сильное основание
Гидролиз Na2CO3 по первой ступени приводит к образованию гидрокарбонат-иона HCO3, который является слабым электролитом:
HCO3 ⇄ H+ СО32
Данное уравнение
соответствует диссоциации H2CO3
по второй ступени и характеризуется
константой
![]() (H2CO3) 51011.
(H2CO3) 51011.
Поэтому:
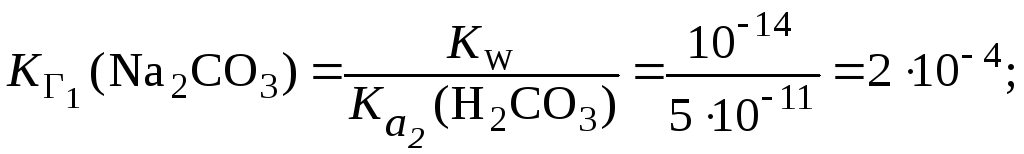
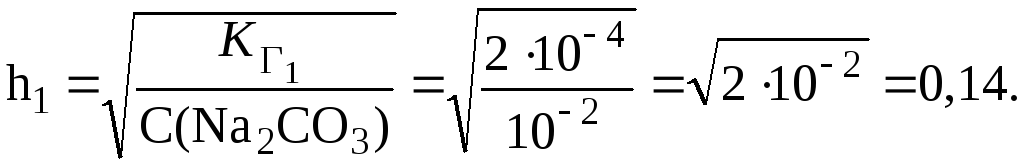
3. Сравнить
степень гидролиза NaNO2
в растворах соли с концентрациями 0,1 и
0,001 моль/л, если
![]() (HNO2) = 4104.
(HNO2) = 4104.
Решение.
Введем обозначения: С1 = 0,1 моль/л; С2 = 0,001 моль/л.
Тогда:
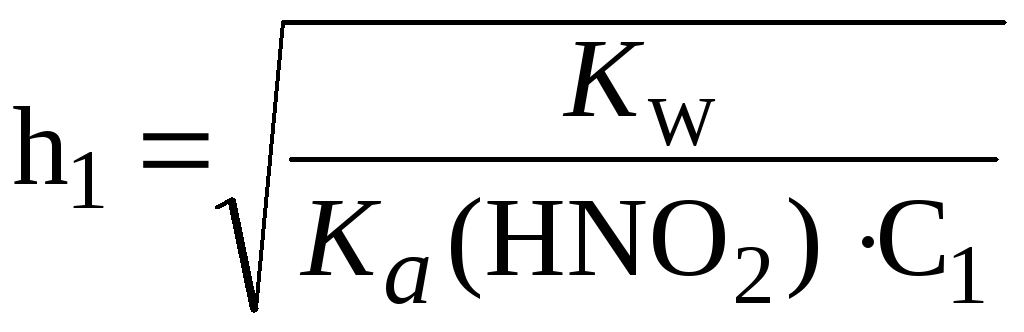 ;
; .
.
Разделим одно выражение на другое и получим:

4. Рассчитать
рН раствора соли NaCN
с C(NaCN)
= 0,01 моль/л, если
![]() (HCN) = 810–10.
Указать характер среды.
(HCN) = 810–10.
Указать характер среды.
Решение.
N
слабая кислота
сильное основание
1 способ:
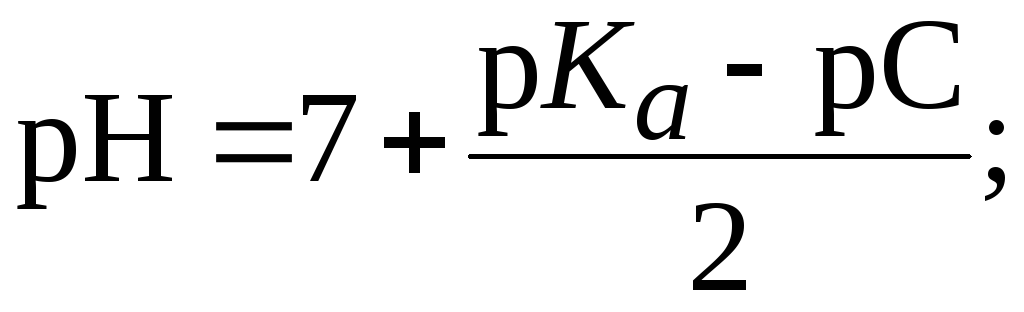
![]()
![]()
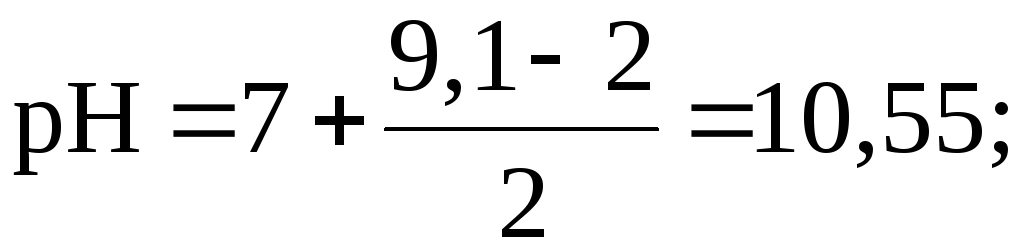
pH
> 7
![]() среда щелочная.
среда щелочная.
2 способ:
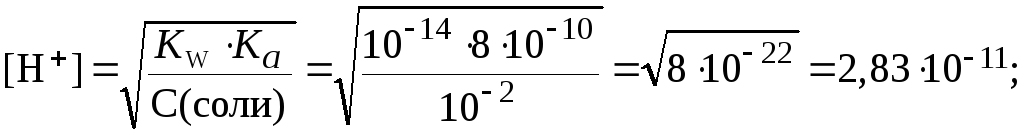
![]()
5. Рассчитать
рН раствора соли NH4CN
с молярной концентрацией 0,002 моль/л,
если
![]() (HCN)
= 810–10,
(HCN)
= 810–10,
![]() (NH3Н2О)
1,810–5.
Указать характер среды.
(NH3Н2О)
1,810–5.
Указать характер среды.
Решение.
N
слабая кислота
слабое основание
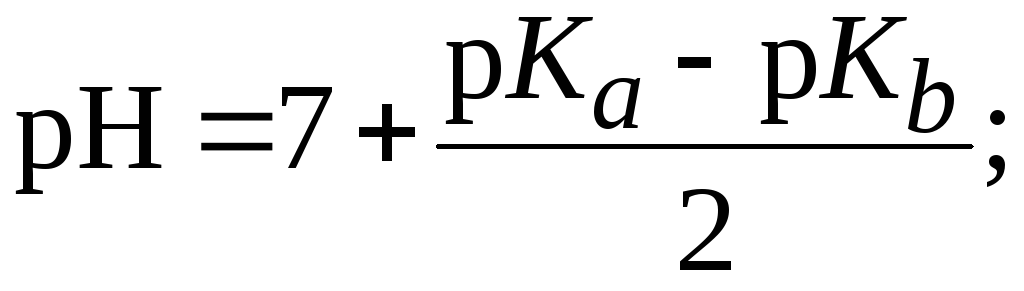
![]()
![]()

pH
> 7
![]() среда слабощелочная.
среда слабощелочная.
6. Найти
разность значений рН растворов Na2S
и NaHS
с одинако-выми концентрациями солей,
если
![]() (Н2S) 7,
(Н2S) 7,
![]() (Н2S) 13.
(Н2S) 13.
Решение.


Вычтем из первого уравнения второе и получим:
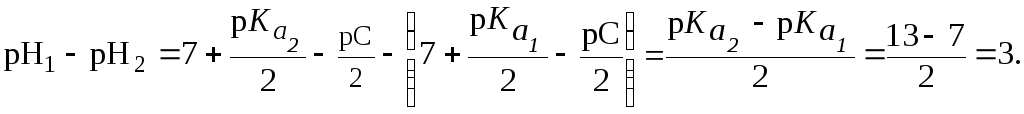

 ,
,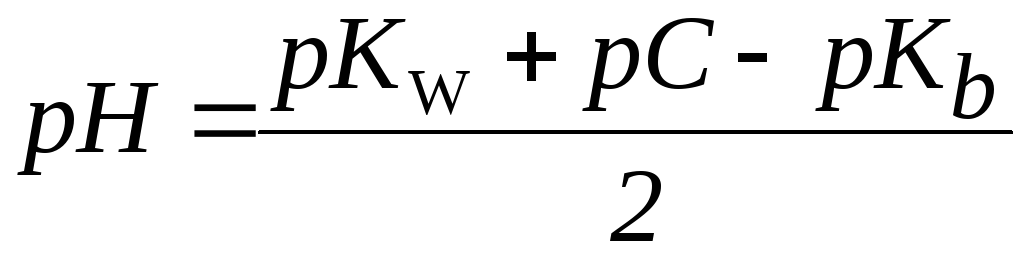 .
.