
- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
1. Титрование сильной кислоты сильным основанием.
Общий вид кривой титрования представлен на рис. 1*. Видно, что точке эквивалентности соответствует значение рН 7, а скачок рН находится в интервале от 4 до 10, т.е. включает в себя кислую, нейтральную и щелочную области.
* Для всех случаев приведены приближенные интервалы скачков рН, имеющих место при концентрациях кислот и щелочей, равных 0,1 моль/л.
Таким
образом, для фиксирования точки
эквивалентности могут быть использованы
индикаторы, интервал перехода окраски
которых находится в области значений
рН от 4 до 10. Этому
критерию отвечают, например, метиловый
оранжевый (![]()
4, интервал перехода окраски при рН
от 3,1 до 4,4)
и фенолфталеин (
4, интервал перехода окраски при рН
от 3,1 до 4,4)
и фенолфталеин (![]()
9, интервал от
8 до 10).
Использование ин-дикатора с
9, интервал от
8 до 10).
Использование ин-дикатора с
![]()
4 приведет к заниженным результатам
титрования, а применение индикатора с
4 приведет к заниженным результатам
титрования, а применение индикатора с
![]() > 10
к завышенным.
> 10
к завышенным.
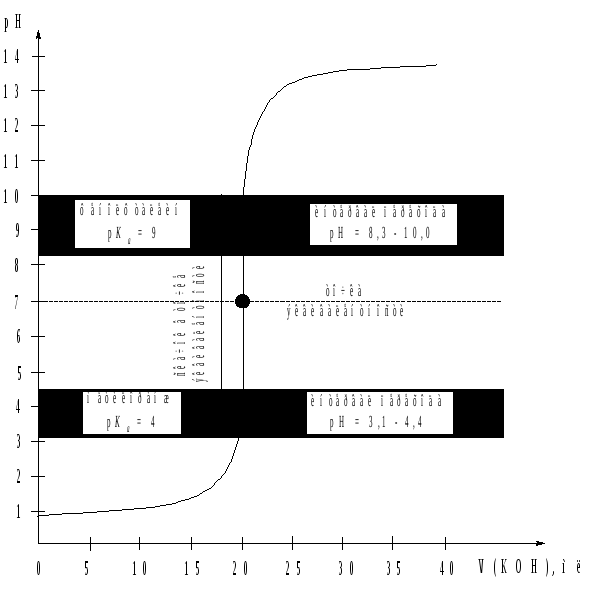
Рис. 1. Кривая
титрования сильной кислоты (НС1) сильным
основанием (KOH).
С(![]() НС1)
= 0,1 моль/л, С(
НС1)
= 0,1 моль/л, С(![]() KOH) =
0,1 моль/л.
KOH) =
0,1 моль/л.
2. Титрование слабой кислоты сильным основанием.
Рассмотрим в качестве примера кривую титрования уксусной кислоты раствором KOH (рис. 2). Видно, что точке эквивалентности соответствует значение рН 9, а скачок рН находится в интервале от 8 до 10, т.е. в щелочной среде. Это объясняется тем, что в результате реакции образуется ацетат калия, раствор которого вследствие гидролиза имеет щелочную реакцию среды:
CH3COOH + KOH ⇄ CH3COOK + H2O
Таким
образом, для фиксирования точки
эквивалентности могут быть использованы
индикаторы, интервалы перехода окраски
которых совпадают с областью скачка
значений рН. Такому условию отвечают,
например, фенолфталеин (![]()
9, интервал от
8 до 10) или
тимолфталеин (
9, интервал от
8 до 10) или
тимолфталеин (![]()
10, интервал от
9,3 до 10,5).
Использование индикатора метилоранж
(
10, интервал от
9,3 до 10,5).
Использование индикатора метилоранж
(![]()
4, интервал от
3,1 до 4,4)
приведет
к заниженным результатам титрования,
а применение индикатора индигокармин
(
4, интервал от
3,1 до 4,4)
приведет
к заниженным результатам титрования,
а применение индикатора индигокармин
(![]()
13, интервал от 12 до 14)
к завышенным.
13, интервал от 12 до 14)
к завышенным.
Аналогичный вид имеют и кривые титрования растворов солей, имеющих кислую реакцию среды (например, NH4Cl) сильными основаниями.
3. Титрование слабого основания сильной кислотой.
При титровании водного раствора аммиака раствором HCl точке эквивалентности соответствует значение рН 5, а скачок рН находится в интервале от 4 до 6, т.е. в кислой среде (рис. 3). Это объясняется тем, что в результате реакции образуется хлорид аммония, раствор которого вследствие гидролиза имеет кислую реакцию среды:
NH3H2O + HCl ⇄ NH4Cl + H2O
Здесь
для фиксирования точки эквивалентности
пригодны индикаторы, меняющие окраску
в области значений рН от 4 до 6. В частности,
может быть использован метилоранж
(![]()
4, интер-вал от
3,1 до 4,4).
Применение индикатора фенолфталеин (
4, интер-вал от
3,1 до 4,4).
Применение индикатора фенолфталеин (![]()
9, интервал от
8 до 10)
приведет к заниженным результатам
титрования, а индикатора тимоловый
синий (
9, интервал от
8 до 10)
приведет к заниженным результатам
титрования, а индикатора тимоловый
синий (![]()
1,7, интервал от
1,2 до 2,8)
к завышенным.
1,7, интервал от
1,2 до 2,8)
к завышенным.
Аналогичный вид имеют и кривые титрования растворов солей, имеющих щелочную реакцию среды (например, Na2CO3) сильными кислотами.
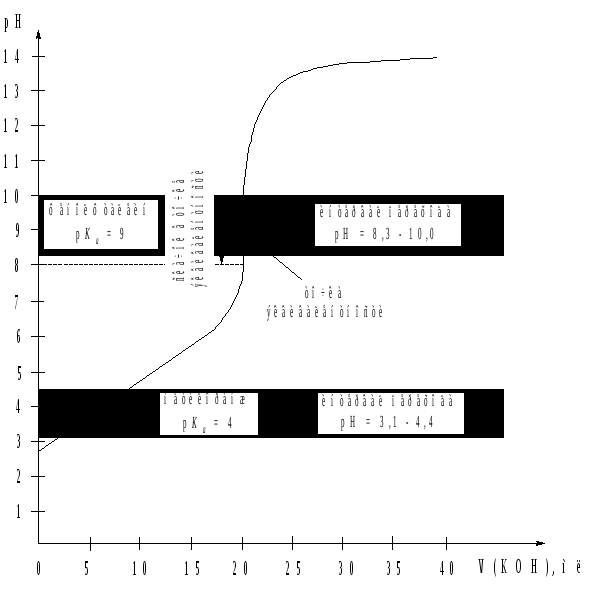
Рис. 2. Кривая
титрования слабой кислоты (CН3COOH)
сильным основанием (KOH).
С(![]() CН3COOH)
= 0,1 моль/л, С(
CН3COOH)
= 0,1 моль/л, С(![]() KOH)
= 0,1 моль/л.
KOH)
= 0,1 моль/л.

Рис. 3. Кривая
титрования слабого основания (NH3H2O)
сильной кислотой (HCl).
С(![]() NH3H2O)
= 0,1 моль/л, С(
NH3H2O)
= 0,1 моль/л, С(![]() HCl)
= 0,1 моль/л.
HCl)
= 0,1 моль/л.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ОКСИДИМЕТРИЯ
