
- •Теория Электролитической диссоциации
- •Сильные и слабые электролиты
- •1. Теория растворов слабых электролитов.
- •2. Теория растворов сильных электролитов.
- •Кислоты и основания
- •1. Теория Аррениуса.
- •2. Теория Бренстеда и Лоури.
- •3. Теория Льюиса.
- •Эталоны решения задач
- •В зависимости от условий ион hco3– может как отдавать протоны:
- •Таким образом, в первом случае ион hco3 является кислотой, во втором основанием, т. Е. Является амфолитом.
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Шкала значений pH
- •Расчет значений рН и рОн в разбавленных растворах сильных и слабых кислот и оснований
- •Кислотно-основное равновесие биологических жидкостей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения
- •Гидролиз солей
- •Количественные характеристики гидролиза
- •Усиление и подавление гидролиза
- •Значения рН растворов гидролизующихся солей
- •Эталоны решения задач
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
- •Элементы количественного анализа
- •Объемный (титриметрический) метод анализа
- •Расчеты в объемных методах анализа Закон эквивалентов
- •Методы кислотно-основного титрования
- •Титранты и их стандартизация
- •Фиксирование точки эквивалентности
- •Механизм действия индикаторов
- •Точка перехода и интервал перехода окраски индикатора
- •Правила выбора индикатора
- •1. Титрование сильной кислоты сильным основанием.
- •3. Титрование слабого основания сильной кислотой.
- •Степень окисления. Окисление и восстановление
- •Окислители и восстановители
- •Последовательность подбора коэффициентов в уравнениях окислительно-восстановительных реакций (метод электронно-ионного баланса)
- •Оксидиметрия
- •Перманганатометрия
- •Иодометрия
- •Расчет эквивалентов окислителей и восстановителей
- •Эталоны решения задач
- •Метод нейтрализации
- •Метод оксидиметрии
- •Вопросы для самоконтроля
- •Варианты задач для самостоятельного решения Вариант №1
- •Вариант №2
- •Вариант №3
- •Вариант №4
- •Вариант №5
- •Вариант №6
- •Вариант №7
- •Вариант №8
- •Вариант №9
- •Вариант №10
- •Вариант №11
- •Вариант №12
- •Вариант №13
- •Вариант №14
- •Вариант №15
- •Вариант №16
- •Вариант №17
- •Вариант №18
- •Вариант №19
- •Вариант №20
Метод нейтрализации
7. На
титрование 20 мл раствора HCl
с C(![]() HCl)
0,1 моль/л затрачено 10 мл
раствора NaOH.
Вычислить C(
HCl)
0,1 моль/л затрачено 10 мл
раствора NaOH.
Вычислить C(![]() NaOH)
в растворе.
NaOH)
в растворе.
|
Дано: V(HCl) 20 мл
C(
|
Решение. Согласно закону эквивалентов (формула 3):
следовательно:
|
|
C( |
8. На
титрование раствора CH3COOH
израсходовано 15,2 мл раствора NaOH
c
C(![]() NaOH)
0,05 моль/л. Вычислить массу CH3COOH
в растворе.
NaOH)
0,05 моль/л. Вычислить массу CH3COOH
в растворе.
Д ано:
ано:
![]() (NaOH)
= 15,2 мл
= 0,0152 л
(NaOH)
= 15,2 мл
= 0,0152 л
C(![]() NaOH)
= 0,05 моль/л
NaOH)
= 0,05 моль/л
m (CH3COOH)
?
(CH3COOH)
?
Решение.
Согласно закону эквивалентов (4):

следовательно:

9. Рассчитать, какой объем раствора H2SO4 c молярной концентрацией эквивалента 0,2 моль/л потребуется для нейт-рализации раствора, содержащего 0,4 г NaOH.
|
Дано: m(NaOH) = 0,4 г
C( |
Решение.
|
|
|

10. Имеется
раствор Na2CO3
объемом 200 мл. На титрование 10 мл этого
раствора было израсходовано 15,3 мл
раствора HCl
с C(![]() HCl)
0,1 моль/л. Найти массу соды в исходном
растворе.
HCl)
0,1 моль/л. Найти массу соды в исходном
растворе.
|
Дано: V0(Na2CO3) 200 мл Vпробы(Na2CO3) 10 мл
C( |
|
|
m(Na2CO3) ? |
Решение.
По результатам
титрования найдем C(![]() Na2CO3):
Na2CO3):
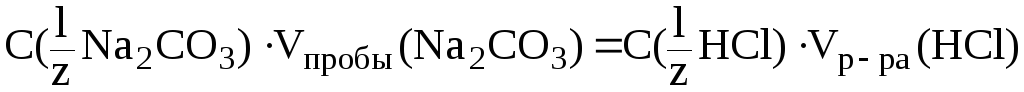 ,
,

Рассчитаем Т(Na2CO3):
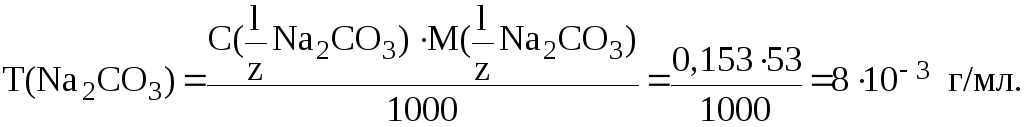
Найдем m(Na2CO3) во всем объеме раствора:
![]()
11. Вычислить
массовую долю (Na2CO3)
в техническом образце, если на титрование
навески технической соды массой 0,212 г
было израсходовано 20 мл раствора HCl
с C(![]() HCl)
0,1 моль/л.
HCl)
0,1 моль/л.
|
Дано: mобр. 0,212 г
C( |
Решение. Найдем массу чистого Na2CO3:
|
|
(Na2CO3) ? |
![]()
Рассчитаем (Na2CO3):
![]()
12. Из
0,126 г технической щавелевой кислоты
(Н2С2О42Н2О)
приготовили 200 мл раствора.
На
титрование 10 мл полученного
раст-вора израсходовали
8 мл
раствора NaOH
с
C(![]() NaOH)
0,01 моль/л. Найти массовую долю
(Н2С2О42Н2О)
в техническом образце.
NaOH)
0,01 моль/л. Найти массовую долю
(Н2С2О42Н2О)
в техническом образце.
|
Дано: mобр. 0,126 г V0(Н2С2О4) 200 мл Vпробы(Н2С2О4) 10 мл
C(
|
Решение.
По результатам
титрования найдем С(
|
|
(Н2С2О42Н2О) ? |

Рассчитаем Т(Н2С2О4):

Вычислим массу чистого Н2С2О42Н2О в образце:
![]()
Рассчитаем (Н2С2О42Н2О) в техническом образце:
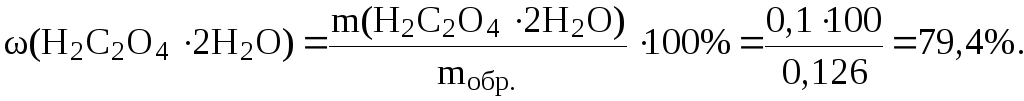
13. Рассчитать, какой объем раствора H2SO4 с молярной концентрацией эквивалента 0,01 моль/л необходимо затратить, чтобы оттитровать 20 мл раствора NaOH с T(NaOH) = 0,0004 г/мл.
|
Дано:
С(
T(NaOH) = 4104 г/мл |
Решение.
Рассчитаем
С(
|
|
|
Найдем V(H2SO4):

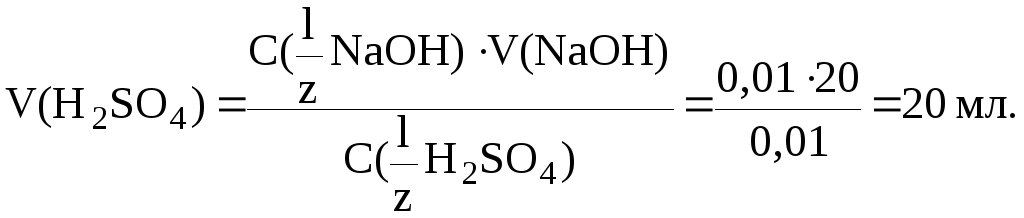
Метод оксидиметрии
14. Рассчитать молярную концентрацию эквивалента и титр раствора перманганата калия для использования его в качестве титранта в кислой среде, если 0,79 г соли растворено в мерной колбе на 200 мл.
|
Дано: m(KMnO4) 0,79 г Vр-ра(KMnO4) 200 мл |
Решение. Для вычислений используются формулы:
где
M( |
|
С( Т(KMnO4) ? |
2) 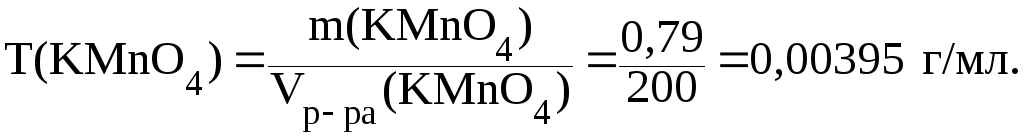
15. На титрование раствора соли Мора было израсходовано 10 мл раствора KMnO4 с молярной концентрацией эквивалента 0,05 моль/л. Определить массу ионов Fe2+ в растворе.
|
Дано:
С( V(KMnO4) 10 мл |
Решение. Соль Мора представляет собой кристаллогидрат двойной соли: (NH4)2SO4FeSO46Н2О. Несложно видеть, что объектом перманганатометрического титрования в соли Мора является ион Fe2+, который в процессе титрования окисляется до иона Fe3+: Fe2+
ē
|
|
m(Fe2+) ? |
Из уравнения полуреакции видно, z(Fe2+) 1.
Запишем выражение закона эквивалентов (формула 4):
 .
.
Получим:
![]()
16. Образец загрязненного примесями оксалата натрия массой 0,5 г растворили в колбе на 500 мл. Пробу раствора объемом 10 мл оттитровали в кислой среде 12 мл раствора KMnO4 с молярной концентрацией эквивалента 0,01 моль/мл. Определить содержание чистого оксалата натрия в образце.
|
Дано: mобр. 0,5 г V0(Na2С2О4) 500 мл Vпробы(Na2С2О4) 10 мл
С( V(KMnO4) 12 мл |
Решение. В процессе титрования оксалат-ион окисляется до CO2:
C2O42
2ē
Отсюда видно, что z(C2O42) 2 и:
|
|
(Na2С2О4) ‑ ? |
Найдем массу чистого Na2C2O4 в титруемой пробе:
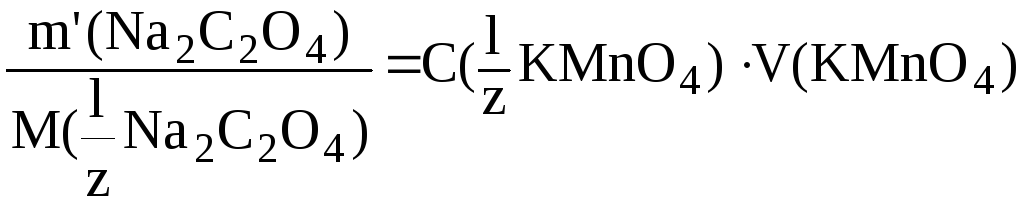
Отсюда:
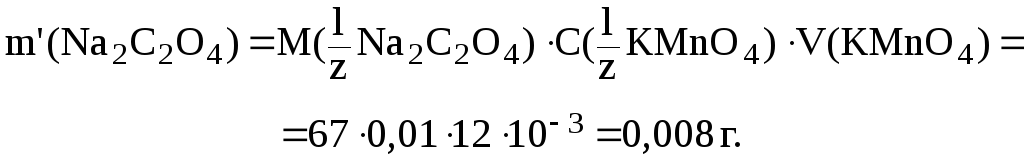
В 500 мл раствора Na2C2O4 содержится:
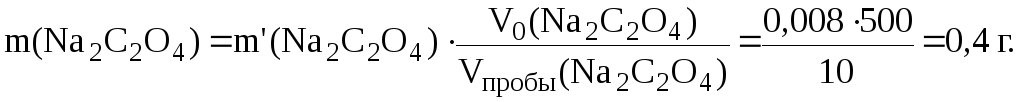
Таким образом:

17. К 0,15 г технического образца, содержащего дихромат калия, добавлены избыток раствора иодида калия и серная кислота. На титрование выделившегося иода потребовалось 22,85 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,1 моль/л. Определить массовую долю дихромата калия в техническом образце.
|
Дано: mобр. 0,15 г
С( |
Решение. Согласно закону эквивалентов (1):
n( На основании формулы (4) можно записать: |
|
(K2Cr2О7) ? |
 .
.
В реакции восстановления дихромат-иона участвует шесть электронов:
Сr2О![]() + 14Н
+ 14Н![]() + 6ē
+ 6ē
![]() 2Cr
2Cr![]() + 7H2O,
+ 7H2O,
поэтому:
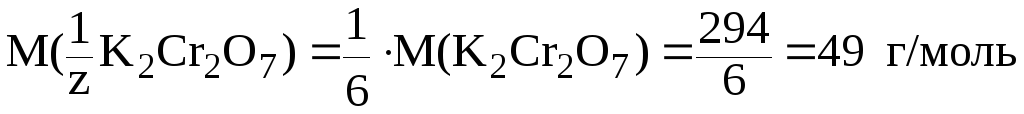 .
.
Таким образом:

Отсюда:
![]()
18. Вычислить массу пероксида водорода в 400 мл раствора, если на титрование 5 мл этого раствора в кислой среде было затрачено 11 мл раствора перманганата калия, титр которого равен 0,00158 г/мл.
|
Дано: V0(H2O2) 400 мл Vпробы(H2O2) 5 мл
T(KMnO4) 0,00158 г/мл |
Решение.
Найдем
|
|
m0(H2O2) ? |
В соответствии с законом эквивалентов (3):
 .
.
В реакции окисления H2O2 участвуют 2 электрона:
H2O2
– 2ē
![]() O2
2H+,
O2
2H+,
поэтому:
 .
.
Найдем массу H2O2 в титруемой пробе:
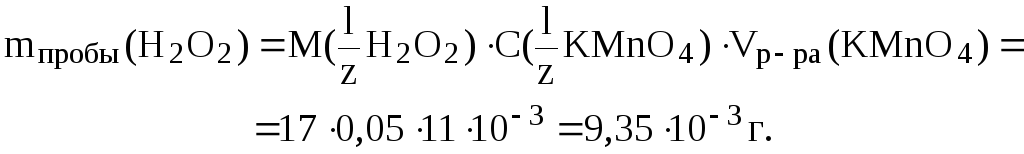
Полученная масса H2O2 содержится в 5 мл раствора, а в 400 мл содержится:
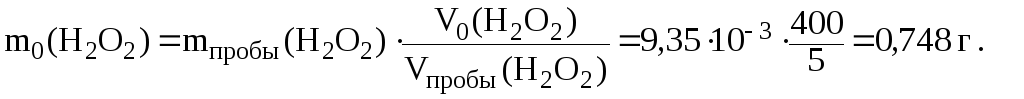

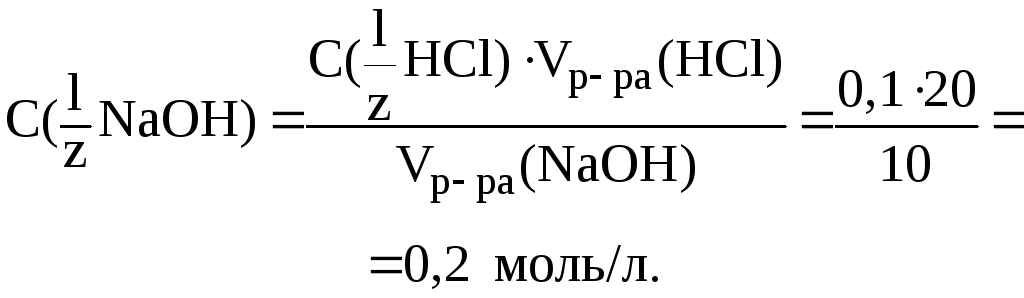

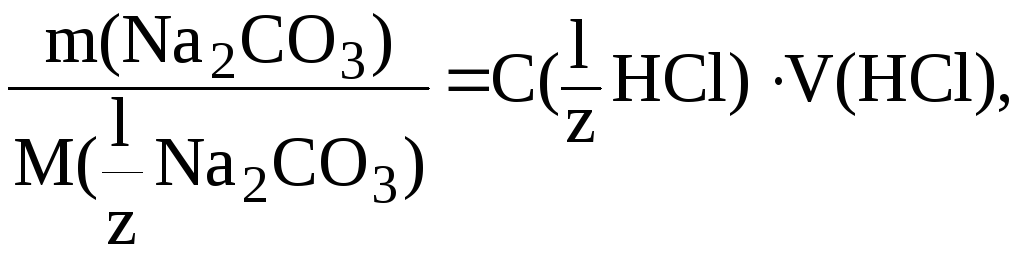

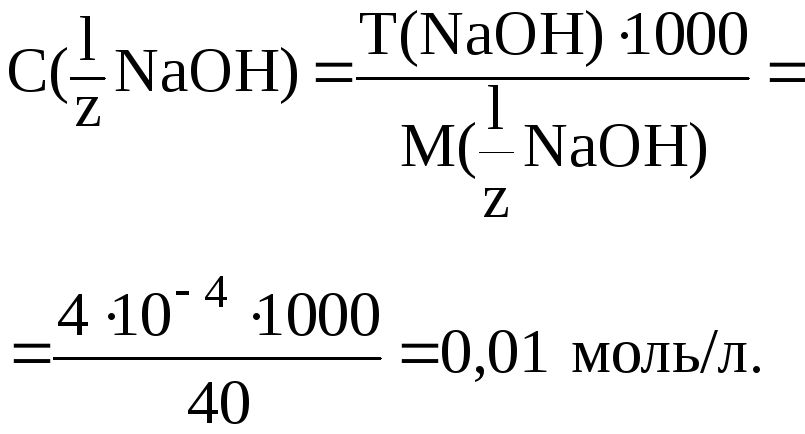


 :
: