
- •Министерство образования и науки Российской Федерации
- •Введение
- •Общие методические указания
- •1. Основные понятия и законы химии
- •Задачи к главе 1
- •2. Состав и строение атома. Химическая связь.
- •2.1 Состав атома
- •2.2. Строение электронных оболочек
- •Пример 3.Какие значения квантовых чисел n, l, ml, ms имеют валентные электроны атома ? Напишите электронную формулу элемента.
- •2.3. Геометрические и энергетические характеристики атомов
- •2.4. Химическая связь.
- •Задачи к главе 2
- •3. Химическая термодинамика
- •3.1. Термохимия
- •3.2. Химическое сродство
- •Задачи к главе 3
- •4. Химическая кинетика и равновесие
- •4.1. Химическая кинетика
- •4.2. Химическое равновесие
- •Задачи к главе 4
- •5. Растворы. Способы выражения состава
- •Задачи к главе 5
- •6. Свойства растворов неэлектролитов
- •Задачи к главе 6
- •7. Свойства растворов электролитов
- •7.1. Электролитическая диссоциация
- •7.2. Произведение растворимости
- •Задачи к главе 7
- •8. Ионное произведение воды. Водородный показатель.
- •Задачи к главе 8
- •9. Ионообменные реакции. Гидролиз солей
- •Задачи к главе 9
- •10. Комплексные соединения
- •Задачи к главе 10
- •11. Окислительно-восстановительные реакции
- •Задачи к главе 11
- •12. Электрохимические явления
- •12.1. Гальванический элемент
- •12.2. Электролиз
- •Задачи к главе 12
- •2 Уровень
- •Приложения
- •Относительная электроотрицательность элементов
- •Термодинамические свойства простых веществ и соединений
- •Произведения растворимости труднорастворимых веществ
- •Термодинамические свойства ионов в водных растворах
- •Стандартные электродные потенциалы в водных растворах
- •Названия некоторых кислот и их кислотных остатков
4.2. Химическое равновесие
При некоторой температуре энтальпийный и энтропийный факторы уравниваются, две противоположные тенденции уравновешивают друг друга, т.е. ΔΗ = ΤΔS. В этом случае соблюдается условие Gх.р=0, которое является термодинамическим условием химического равновесия.
Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В условиях химического равновесия концентрации (или парциальные давления в случае газов) исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями (или парциальными давлениями) веществ. В дальнейшем, равновесные концентрации обозначены символом вещества в квадратных скобках, например, [А]¸ [В], моль/дм3. Равновесное парциальное давление обозначено индексом р, например, ррА.
Для реакции, протекающей по уравнению:
аА(г)+ bВ(г)↔ cC(г)+ dD(г)
математическое выражение закона действующих масс может быть представлено в двух вариантах:
![]() –
аналитическая константа равновесия;
–
аналитическая константа равновесия;
или
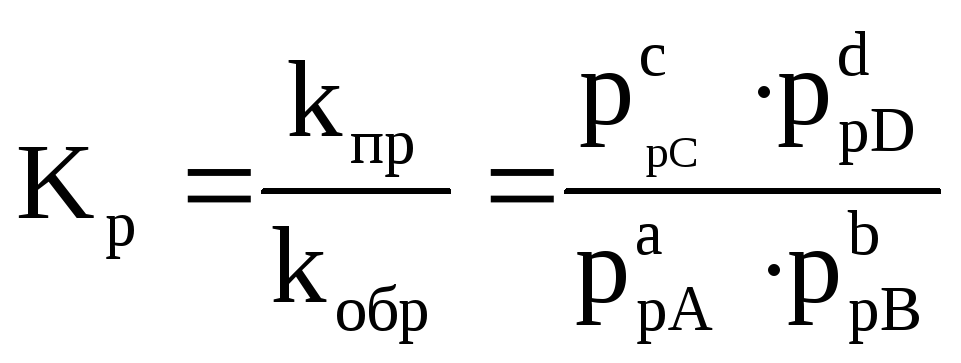 – термодинамическая константа равновесия.
– термодинамическая константа равновесия.
Если все реагенты газообразны и их поведение подчиняется законам идеальных газов, то связь между Кри Ксможно выразить уравнением
Кр= КС(RT)Δν,
где Δν – изменение числа молей газов в результате реакции
Δν = (с+d) – (а+b).
Термодинамическая константа может быть рассчитана, если известно стандартное значение энергии Гиббса:
lgКр = -G0 /(2,303RT).
Как следует из вышесказанного, константа равновесия зависит от температуры. С учетом сущности понятия G0уравнение принимает вид
![]() .
.
Если нет фазовых превращений компонентов
реакции, то при увеличении температуры
слагаемое
![]() ≈const,
тогда при возрастании температуры для
экзотермической реакции (Н<0)
константа равновесия уменьшается, а
для эндотермической реакции (Н>0)
– увеличивается.
≈const,
тогда при возрастании температуры для
экзотермической реакции (Н<0)
константа равновесия уменьшается, а
для эндотермической реакции (Н>0)
– увеличивается.
Каждое химическое равновесие устанавливается при определенном значении трех параметров, которые его характеризуют: 1) концентрация реагирующих веществ и продуктов реакции; 2) температура; 3) давление (для газов). При изменении любого из этих параметров равновесие может смещаться. Смещение равновесия определяется принципом Ле-Шателье: при всяком внешнем воздействии на систему, находящуюся в состоянии химического равновесия, в ней протекают процессы, приводящие к уменьшению оказанного воздействия.
Принцип Ле-Шателье следует из закона действующих масс. Если система находится при постоянной температуре, то константа равновесия при внешних воздействиях остается постоянной. Поэтому любое изменение равновесных концентраций одного или нескольких веществ должно приводить к такому изменению равновесных концентраций других веществ, чтобы соблюдалось постоянство константы равновесия.
Пример 3. Рассмотреть принцип Ле-Шателье на примере реакции получения водорода конверсией метана:
СН4 + 2Н2О(г) = СО2 + 4Н2 ΔΗ>0
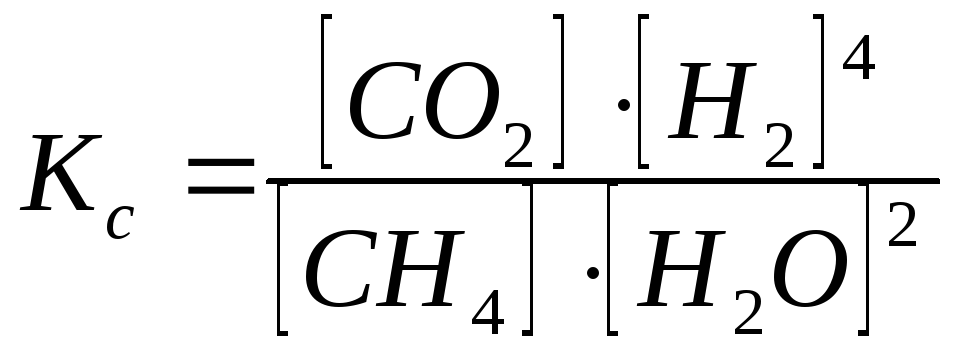 .
.
Решение.
Влияние концентраций (парциальных давлений) компонентов системы. Если, например, в систему добавить метан, т.е. увеличить его концентрацию, то равновесие системы нарушится. При этом ускорится прямая реакция, что приведет к увеличению концентрации продуктов реакцииСО2 и Н2 и уменьшению концентрации водяного пара, т.е. равновесие смещается вправо. Процесс будет протекать до тех пор, пока не установится новое равновесие, характеризующееся тем же значением Кс. Если в систему ввести дополнительное количество СО2 или Н2, то в соответствии с принципом Ле-Шателье равновесие сместится влево.
Влияние общего давления в системе. Если в результате реакции изменяется число молей газообразных веществ, то изменение общего давления в системе вызывает смещение равновесия. В соответствии с принципом Ле-Шателье увеличение общего давления в системе вызывает смещение равновесия в сторону уменьшения числа молей газообразных веществ, т.е. в сторону уменьшения давления. Для рассматриваемой реакции увеличение давления должно смещать равновесие влево (слева Σνi = 3, справа Σνi = 5).
Влияние температуры.С увеличением температуры равновесие смещается в сторону эндотермических реакций, т.е. реакций, протекающих с поглощением теплоты. Как указывалось ранее, повышение температуры вызывает увеличение константы равновесия эндотермической реакции, а соответственно возрастают отношения концентраций продуктов реакции к концентрациям исходных веществ, т.е. равновесие смещается в сторону эндотермических реакций. Например, увеличение температуры вызывает смещение равновесия рассматриваемой реакции получения водорода (ΔΗ>0) в правую сторону, а для экзотермической реакции
2Н2 + О2 = 2Н2О (ΔΗ<0)
– в левую сторону.
Пример 4. Равновесие в гомогенной газовой системе 2А+3В3С+Dустановилось в момент, когда прореагировало 50% вещества А. Вычислить константу равновесия, если концентрации исходных веществ С0А=0,6 моль/л и С0В= 1,0 моль/л. В какую сторону сместится равновесие при повышении давления?
Решение. Для расчета константы равновесия необходимо найти равновесные концентрации исходных веществ и продуктов реакции.
Введем обозначения: [А], [В], [С], [D] – равновесные концентрации веществ, моль/л; [В]прореаг.– количество прореагировавшего вещества В, моль/л.к моменту равновесия прореагировало 50% вещества А, [А]=С0А0,5=0,60,5=0,3.
Согласно уравнению реакции 2А+3В3С+Dвещество В прореагировало в
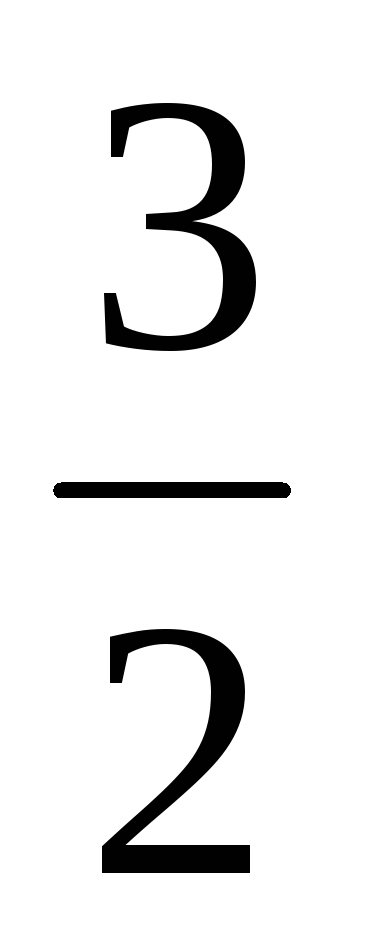 раза больше, чем А, т.е. [В]прореаг.=
0,31,5=0,45 моль/л,
[В]=С0В-[В]прореаг.=1,0 –
0,45=0,55 моль/л.
раза больше, чем А, т.е. [В]прореаг.=
0,31,5=0,45 моль/л,
[В]=С0В-[В]прореаг.=1,0 –
0,45=0,55 моль/л.Исходя из сравнения коэффициентов, можно сделать вывод, что [С]=[В]прореаг.=0,45 моль/л, [D]=
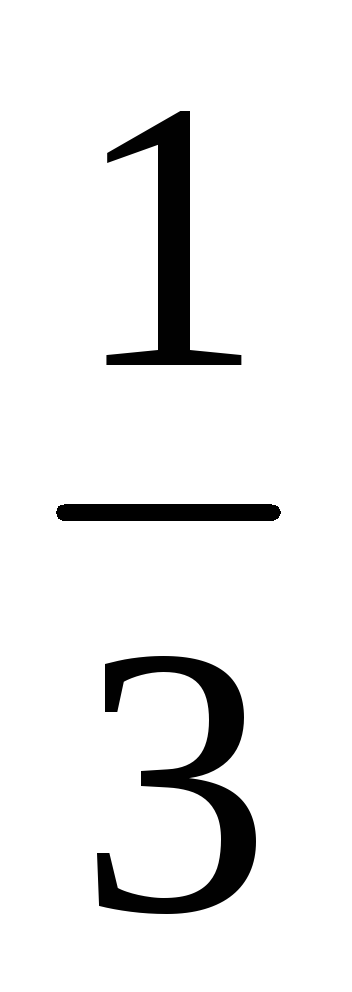 [С]=0,15
моль/л.
[С]=0,15
моль/л.Составим выражение для константы равновесия системы
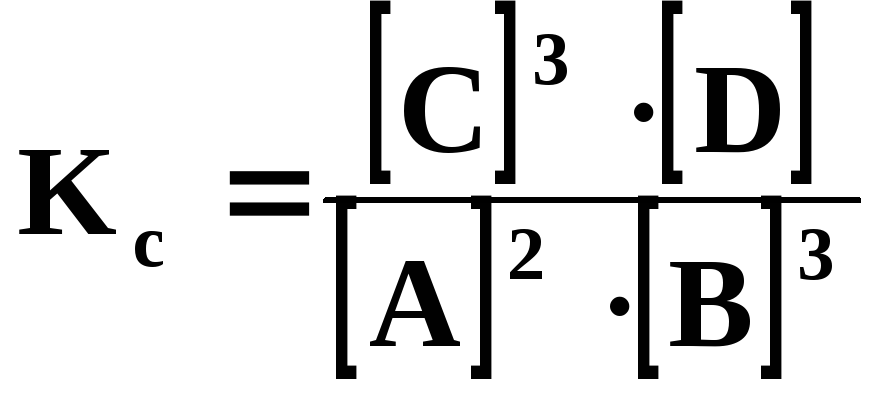 ,
после подстановки найденных численных
значений получим
,
после подстановки найденных численных
значений получим
![]() 0,912.
0,912.
Уравнение реакции 2А+3В3С+Dпоказывает, что прямая реакция
протекает с образованием меньшего числа молей газа, т.е. с уменьшением давления. Обратная реакция протекает с образованием большего числа молей, т.е. с увеличением давления. При увеличении давления, согласно принципу Ле-Шателье, равновесие смещается в сторону образования меньшего числа молей газообразных веществ, т.е. в направлении прямой реакции.
