
8bb268da_lektsii__po_onkologiii
.pdfN – регионарные лимфатические узлы
Nх – недостаточно данных для оценки регионарных лимфатических узлов
N0 – нет признаков метастатического поражения регионарных лимфатических узлов
N1 – имеется поражение перибронхиальных и/или лимфатических узлов корня легкого на стороне поражения, включая непосредственное распространение опухоли на лимфатические узлы
N2 – имеется поражение лимфатических узлов средостения на стороне поражения или бифуркационных
N3 – имеется поражение лимфатических узлов средостения или корня легкого на противоположной стороне; прескаленных или надключичных узлов на стороне поражения или на противоположной стороне.
М – отдаленные метастазы Мх – недостаточно данных для определения отдаленных метастазов
М0 – нет признаков отдаленных метастазов М1 – имеются признаки отдаленных метастазов, включая отдельные опухолевые узлы в другой доле
|
|
|
Таблица 1 |
|
Группировка по стадиям |
|
|
Стадия 0 |
Тis |
N0 |
М0 |
Стадия IА |
Т1 |
N0 |
М0 |
Стадия IВ |
Т2 |
N0 |
М0 |
Стадия IIА |
Т1 |
N1 |
М0 |
Стадия IIВ |
Т2 |
N1 |
М0 |
|
Т3 |
N0 |
М0 |
|
Т1 |
N2 |
М0 |
Стадия IIIA |
Т2 |
N2 |
М0 |
|
Т3 |
N1, N2 |
М0 |
IIIB |
Т4 |
N любая |
М0 |
|
Т любая |
N3 |
М0 |
IV |
Т любая |
N любая |
М1 |
Клиника
При центральном раке легкого выделяют первичные симптомы, обусловленные появлением в просвете бронха опухолевого узла – кашель, одышка и кровохарканье. Как правило, они появляются на ранних стадиях.
Вторичные симптомы развиваются либо как следствие осложнений воспалительной природы, либо обусловлены метастазированием или вовлечением в патологический процесс соседних органов и тканей. Кашель наблюдается у большинства больных. Он носит постоянный характер. Как правило, вначале сухой, надсадный, со временем начинает сопровождаться отделением мокроты. Кровохарканье наблюдается примерно у половины больных и проявляется появлением прожилок алой крови в мокроте. Одышка имеет место у половины больных. Её выраженность напрямую зависит от диаметра пораженного опухолью бронха. При длительной обтурации бронха развивается ателектаз фрагмента легкого дистальней обтурации с появлением симптомов интоксикации и болей в грудной клетке на стороне поражения.
Периферический рак легкого длительное время протекает бессимптомно и начинает проявляться только тогда, когда прорастает или сдавливает соседние органы и ткани, либо уже при появлении метастазов. При прорастании грудной стенки чаще всего появляются локальные боли, не связанные с дыханием. Особой формой периферического рака является рак верхушки легкого, описанный Pancoast в 1924г. Для него характерно прорастание через купол плевры с поражением плечевого сплетения, сдавлением сосудистого пучка и симпатического ствола. Внешне он проявляется болью в плечевом суставе и плече, атрофией
81
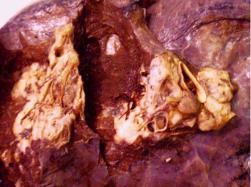
мышц предплечья и синдромом Горнера. При распространении опухоли на крупный бронх, появляются симптомы, сходные с таковыми при центральном раке. Часто периферические опухоли распадаются, что проявляется кашлем со зловонной мокротой, кровохарканьем, интоксикацией.
Рис.1.Макропрепарат
Диагностика
Для постановки диагноза и оценки распространенности опухоли применяются следующие методы: рентгенологический, эндоскопический, ультразвуковой, компьютерная томография.
При этом необходимо выполнять забор материала для морфологического исследования путем пункции или биопсии. В ряде случаев для забора материала выполняются торакоскопии, медиастиноскопии или медиастинотомии. Для оценки состояния брюшной полости выполняется УЗИ. Состояние головного мозга проверяют компьютерной томографией. При подозрении на поражение костной системы применяется остеогаммасцинтиграфия.
.
Лечение (табл.2)
Выбор метода лечения зависит от распространенностиопухолевого процесса, соматического состояния пациента и морфологического варианта опухоли. Основными операциями являются пневмонэктомия и лобэктомия, а также их варианты (расширенные и комбинированные операции, лобэктомия с резекцией бронхов и др.).
Рак легкого не является чисто хирургической проблемой. Больным на любой стадии заболевания требуется мультидисциплинарный подход – рациональное сочетание оперативного лечения,
радиотерапии и системного воздействия. Стандартная современная операция при раке легкого, независимо от локализации опухоли в органе, должна сопровождаться широким вскрытием средостения (медиастинальной плевры) и полным удалением клетчатки с лимфатическими узлами независимо от визуальной их оценки как интактных. Актуальным является изучение возможностей билатеральной медиастинальной и шейно-надключичной лимфодиссекции.
Центральный рак легкого
Табл. 2
Лечебная тактика при не мелкоклеточном раке легкого
82
Стадия |
Хирургия |
Лучевая терапия |
Химиотерапия |
|
|
|
|
|
|
I |
Да |
В случае неоперабельности |
нет |
|
|
|
|
|
|
II |
Да |
В случае неоперабельности |
Неоадьювантная |
|
При Т3 или N1 |
||||
|
|
|
||
|
|
|
|
|
III |
Да |
В случае неоперабельности и |
Неоадъювантная, |
|
предоперационная |
адьювантная |
|||
|
|
|||
|
|
|
|
|
IV |
Нет или |
паллиативная |
|
|
симптоматическая |
паллиативная |
|||
|
|
|||
|
|
|
|
При мелкоклеточном раке легкого применение только хирургического метода является крайне неоправданным. Для него характерны быстрое развитие, раннее лимфогенное и гематогенное метастазирование, плохой прогноз, высокая чувствительность к химиотерапии и лучевой терапии.
При I и II стадиях обязательным является назначение 4-6 курсов химиотерапии, затем выполняется операция, после которой производится 2-4 курса полихимиотерапии в зависимости от чувствительности опухоли и радиотерапия на средостение и шейнонадключичную область. Включение в программу лечения операции при III и IV стадиях достоверно не приводит к улучшению выживаемости, поэтому в большинстве случаев рекомендовано химиолучевое лечение.
Отдаленные результаты
Хирургическое лечение дает до 30% 5-летнего выживания. При этом при I стадии 5- летняя выживаемость составляет до 80%, при II стадии – до 45%, при III стадии – до 20%. Только лучевое или лекарственное лечение дает до 10% 5-летнего выживания. Комбинированное лечение увеличивает 5-летнюю выживаемость до 40%. Прогноз ухудшается при выявлении метастазов в региональные лимфатические узлы.
Лекция 8
РАК ПИЩЕВОДА А.А. Менг
Рак пищевода является одной из пяти наиболее частых причин смерти среди онкологических больных и у 900 тыс. умерших в мире он является основной причиной. В Западной Европе и США отмечается ежегодный 5% прирост заболеваемости.
Рак пищевода в структуре всех злокачественных заболеваний составляет 3% и занимает 6-е место, среди опухолей желудочно-кишечного тракта – 3-е место (после рака желудка и прямой кишки). Мужчины болеют чаще женщин в соотношении 5–10:1. Лица старше 70 лет составляют около 40%. Пик заболеваемости приходится на возраст 50–60 лет. Ни для одной опухоли не характерна такая географическая зависимость, как для рака пищевода. Между отдельными странами различия в заболеваемости достигают 15– 20_кратных размеров. Самые высокие показатели до 100 на 100 тыс. населения зарегистрированы в Китае, Иране, государствах Центральной и Средней Азии. В регионах с высоким уровнем заболеваемости удельный вес плоскоклеточного рака составляет 90%. Ежегодно в США диагностируется до 13 тыс. новых случаев, что составляет 5 на 100 тыс. населения, при этом большинство опухолей представлено аденокарциномой. Среднее положение занимает заболеваемость раком пищевода в России, составляя 5,2 на 100 тыс. В 2004 году выявлено 6829 новых случаев по стране, а в Иркутской области 137. В России, как и во всем мире, имеются значительные региональные различия в заболеваемости раком пищевода. Самые высокие показатели отмечены в Якутии, Туве, самые низкие – на
83
Северном Кавказе. Показатели смертности практически не отличаются от показателей заболеваемости, что является индикатором неблагоприятного прогноза течения заболевания (при заболеваемости 5,2 смертность составляет 5,1 на 100 тыс. населения).
Факторы риска
Среди факторов, способствующих развитию рака пищевода, особое значение имеют особенности питания: употребление чрезмерно горячей или холодной пищи, употребление сырой рыбы, крепких алкогольных напитков и курение. Серьезными факторами риска в Европе и Северной Америке являются курение и чрезмерное употребление алкоголя.
Существует ряд заболеваний, являющихся предопухолевыми. К ним относятся: синдром Пламмера–Винсона, ожоговые стриктуры пищевода, ахалазия пищевода, пищевод Барретта, дивертикулы пищевода, осложнения гастроэзофагеального рефлюкса, папилломавирусная инфекция, тилоз или кератодермия. Синдром Пламмера–Винсона характеризуется хроническим эзофагитом на фоне недостаточности железа, фиброзом стенки пищевода, дисфагией. Примерно у 10% этих больных развивается рак. При ожоговых стриктурах риск малигнизации возрастает в несколько раз через 20–30 лет и связан с хронической травмой слизистой оболочки в области стриктуры. Тилоз, или локальная пальмарно-плантарная кератодермия – редкое наследственное заболевание, передающееся из поколения в поколение аутосомно-доминантным путем. У этих больных отмечается аномальный плоский эпителий слизистой оболочки пищевода. Риск развития рака на фоне эзофагита у этих больных в 5–10 раз выше, чем в обычной популяции. По мнению ряда исследователей, основной причиной развития рака пищевода в странах Азии и Южной Африки является папилломавирусная инфекция. В настоящее время особое значение приобретает гастроэзофагеальная рефлюксная болезнь и, как ее следствие, пищевод Барретта.
Эпидемиологические исследования показали, что, кроме курения и потребления алкоголя, ожирение является независимым фактором риска развития карциномы пищевода. Курение играет роль почти в 40% случаев, ожирение – в 33% случаев. Патогенез развития рака у больных с избыточной массой тела заключается в том, что повышенная масса тела и малоподвижный образ жизни ведут к увеличению внутрибрюшного давления, что, соответственно, на фоне переедания вызывает рефлюксную болезнь, являющуюся непосредственной причиной развития пищевода Барретта и последующей малигнизации. Появление в результате метаплазии интестинального цилиндрического эпителия повышает риск развития рака в 30–125 раз.
Классификация
Для правильной оценки распространенности процесса , выбора метода лечения используется классификация рака пищевода по стадиям.
I стадия – небольшая опухоль, поражающая слизистую оболочку и подслизистую основу стенки пищевода, без прорастания его мышечной оболочки. Сужения просвета пищевода нет. Метастазов нет.
II стадия – опухоль поражает и мышечную оболочку пищевода, но не выходит за пределы стенки органа. Имеется сужение просвета пищевода. Обнаруживаются единичные метастазы в региональных лимфатических узлах.
III стадия – опухоль прорастает все слои стенки пищевода, переходит на околопищеводную клетчатку или серозную оболочку. Прорастания в соседние органы нет. Сужение пищевода. Множественные метастазы в региональных лимфатических узлах.
IV стадия – опухоль прорастает все слои стенки пищевода, околопищеводную клетчатку, распространяется на прилежащие органы. Может иметься пищеводно-трахеальный или пищеводно-бронхиальный свищ. Множественные метастазы в регионарные и отдаленные лимфатические узлы
Международная классификация по системе ТNM (1997)(табл.1)
Т- первичная опухоль Тх – недостаточно данных для оценки первичной опухоли
Т0 – первичная опухоль не определяется Тis – преинвазивная карцинома
84
Т1 – опухоль инфильтрирует стенку пищевода до подслизистого слоя. |
|
||||||
|
|
Т2 – опухоль инфильтрирует стенку пищевода до |
|||||
|
|
мышечного слоя. |
|
|
|
||
|
|
Т3 – опухоль инфильтрирует стенку пищевода до |
|||||
|
|
адвентиции. |
|
|
|
|
|
|
|
Т4 – опухоль распространяется на соседние структуры. |
|||||
|
|
N – регионарные лимфатические узлы |
|
||||
|
|
Nх – недостаточно данных для оценки регионарных |
|||||
|
|
лимфатических узлов |
|
|
|
||
|
|
N0 – |
нет |
признаков |
метастатического поражения |
||
|
|
регионарных лимфатических узлов |
|
||||
|
|
N1 |
– |
имеется |
поражение |
региональных |
|
|
|
лимфатических узлов метастазами |
|
||||
М – отдаленные метастазы |
|
|
|
|
|
|
|
Мх – недостаточно данных для определения отдаленных метастазов |
|
||||||
М0 – нет признаков отдаленных метастазов |
|
|
|
|
|
||
М1 – имеются отдаленные метастазы |
|
|
|
|
|
||
|
|
|
|
|
|
|
Таблица 1 |
|
|
Группировка по стадиям |
|
|
|
||
|
|
|
|
|
|
|
|
Стадия 0 |
|
Тis |
|
N0 |
|
|
М0 |
Стадия I |
|
Т1 |
|
N0 |
|
|
М0 |
Стадия IIА |
|
Т2 |
|
N0 |
|
|
М0 |
|
|
Т3 |
|
N0 |
|
|
N0 |
Стадия IIВ |
|
Т1 |
|
N1 |
|
|
М0 |
|
|
Т2 |
|
N1 |
|
|
М0 |
Стадия III |
|
Т3 |
|
N1 |
|
|
М0 |
|
|
Т4 |
|
любая |
|
|
М0 |
Стадия IV |
|
Т любая |
|
N любая |
|
|
М1 |
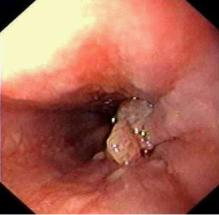
Рис.1 Эндоскопическая картина рака пищевода
Клиника
85
Проявления рака пищевода достаточно стабильны и однообразны. В.Г. Лалетиным в 1987 году предложена классификация клинических форм рака пищевода, согласно которой выделяют следующие формы:
1.Дисфагическая – встречается у 75% больных и проявляется нарушениями прохождения пищи по пищеводу.
2.Болевая (шейная, загрудинная, брюшная и позвоночная) – встречается у 15% больных и характеризуется возникновением боли, которая в половине случаев связана с приемом пищи.
3.Диспептическая – отмечается у 5% пациентов. Для нее характерны тошнота, отрыжка, рвота. Эта форма встречается преимущественно у больных, имеющих опухоль нижнегрудного или абдоминального отделов пищевода, часто распространяющихся на кардиальный отдел желудка.
4.Гортано-трахеально-бронхиальная – имеет место у 5% пациентов. Ведущими
симптомами являются осиплость голоса, затрудненное дыхание, приступы кашля при проглатывании
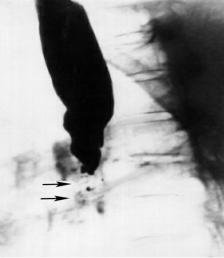
Рис.2 Эзофагография
слюны и пищи.
Морфологические варианты злокачественных новообразований пищевода разнообразны, но чаще всего(95%) в России встречается плоскоклеточный рак. Железистый рак встречается в 3-5%. В Северной Америке соотношение несколько иное. Там частота
встречаемости железистого рака составляет до 30-35%.
Диагностика
Состоит из 2 этапов: первичной диагностики, т.е. выявлении опухоли, и уточняющей диагностики – установлении характера и распространенности опухолевого процесса. Поэтому все исследования проводятся в определенной последовательности. При первичной диагностике изучают анамнез заболевания, проводят рентгенологическое и эндоскопическое исследования с гистологическим исследованием биоптата. Наиболее эффективным методом первичной диагностики является эзофагоскопия с биопсией. Уточняющая диагностика опухолевого процесса основана на комплексном использовании инвазивных и неинвазивных диагностических методов. К последним относятся
компьютерная томография (КТ), ультразвуковое исследование (УЗИ), позитронная эмиссионная томография (ПЭТ). К инвазивным методам относится лапароскопия, целью которой является морфологическое подтверждение наличия метастазов в лимфатические узлы брюшной полости и выявление канцероматоза брюшины. Все большее значение для уточняющей диагностики приобретает метод эндоскопической ультрасонографии, дающий возможность оценить глубину прорастания опухоли, состояние окружающих пищевод органов и лимфатических узлов.
Лечение
На настоящем этапе развития онкологии рассчитывать на достижение высоких результатов возможно лишь с применением комбинированного лечения с неоадъювантной либо адъювантной химиолучевой терапией. Для этого каждое составляющее противоопухолевого лечения необходимо использовать в полном объеме, постоянно развивать и совершенствовать. Не является исключением и хирургический метод – основной в лечении больных раком грудного отдела пищевода, возможности которого еще далеко не исчерпаны. При локализованных формах заболевания и отсутствии поражения лимфатических коллекторов, доказанного гистологически, операция является единственным методом лечения. 5-ти летняя выживаемость у этой группы пациентов составляет 55-60%.
86
При имеющейся тяжелой сопутствующей патологии, отказе пациентов от операции или при развитии кахексии, радикальное оперативное лечение не возможно. Основным методом у этой категории больных является лучевая терапия по радикальной программе. Для обеспечения энтерального питания предварительно накладывается гастростома или выполняется эндоскопическая лазерная или электрохирургическая реканализация пищевода.
При планировании лечебной тактики у пациентов с распространенными опухолевыми поражениями, необходимо включать в программу химиолучевой компонент как дополнение к радикальной операции. Такой подход позволяет добиваться 20-25% 5-ти летней выживаемости, против 3-5% выживаемости при только хирургическом методе.
Оперативное лечение при злокачественных опухолях пищевода состоит из двух этапов – резекционного и пластического. В качестве трансплантатов возможно использовать тонкую, толстую кишку или желудок. На современном этапе основная операция при раке пищевода - расширенная субтотальная резекция с одномоментной пластикой пищевода широким желудочным стеблем комбинированным лапаротомным и правосторонним торакотомным доступом (операция типа Льюиса). При невозможности использования желудка (резекции в анамнезе, опухолевая инфильтрация), в качестве трансплантата используется толстая кишка(операция Добромыслова-Торека). Такой метод пластики выполняется многоэтапно – вначале выполняется экстирпация пищевода с эзофагостомией и гастростомией, а затем через 3-6 месяцев восстанавливается непрерывность пищеварительного тракта за счет толстой кишки. Важной составляющей операции является моноблочная расширенная лимфодиссекция по принципиальным соображениям, с учетом путей регионарного лимфогенного метастазирования. При поражении верхнегрудного или шейного отделов для экстирпации пищевода выполняются трехдоступные вмешательства, при которых кроме абдоминального и торакального этапов, выполняется шейный с последующим анастомозом между желудком и глоткой.В нерезектабельных случаях для восстановления проходимости может быть применена электрохирургическая либо лазерная реканализация пищевода.
Отдаленные результаты
При хирургическом лечении, среди перенесших радикальные операции, 5-летний срок выживания зависит от многих обстоятельств. Основным является распространенность опухолевого процесса. При размерах опухоли Т1 5 - летняя выживаемость составляет 46,9%, при Т2 – 42,9%, при Т3 – 33,7%, при Т4 – 25%. Наличие метастазов в лимфатические узлы является неблагоприятным фактором и значительно уменьшается срок 5-летней выживаемости. При 3 стадии процесса комбинированное лечение (предоперационная лучевая терапия и операция) позволяет увеличить сроки 5-летней выживаемости с 10,5 до
25,4%.
Лекция 9
РАК ЖЕЛУДКА В.Г.Лалетин, А.В.Белоногов
Длительный исторический период рак желудка (РЖ) в нашей стране занимал первое место среди всех злокачественных новообразований и только с 1985 года на первом месте находится рак легкого. В России, в том числе в Иркутской области, в 2005 году в структуре онкологической заболеваемости РЖ находится на четвертом месте. В РФ ежегодно регистрируется более 45000 заболевших. Около 5% случаев РЖ являются генетически детерминированными. Молодой возраст больного, перстневидно – клеточный рак, два случая РЖ и более у близких родственников – наиболее простые критерии, которые позволяют заподозрить генетическую предрасположенность. Исследования с применением молекулярно - генетических технологий выявили герминальные наследуемые мутации в гене Е –
87
кадгерин/СДН1 в семьях с несколькими случаями РЖ диффузного типа, диагностированного в молодом возрасте. Есть примеры успешного проведения активной хирургической тактики у молодых носителей герминогенной мутации СДН 1 из отягощенных семей. Основная же доля РЖ носит спорадический характер и связана с факторами риска.
К предраковым состояниям относятся:
Хронический гастрит различной этиологии, в том числе аутоиммунный типа А, сопровождающийся пернициозной анемией; Аденоматозные полипы желудка; Хронические язвы желудка; Оперированный желудок; Болезнь Менетрие.
Кпредраковым изменениям относят дисплазию (облигатный предрак).
Вгруппу риска развития РЖ следует отнести пациентов, страдающих хеликобактериозом. Лица с высокой степенью риска подлежат лечению и динамическому наблюдению с обязательным проведением гастроскопии не менее чем два раза в год.
Патоморфология
Излюбленной локализацией РЖ является антральный отдел (45% всех наблюдений), кардиальный отдел поражается в 15%.
Макроскопическая классификация по Боррману.
1 тип – грибовидный или полиповидный,
2 тип – язвенный с четко очерченными краями,
3 тип – язвенно-инфильтративный,
4 тип диффузно-инфильтративный (linitis plastica),
5 тип неклассифицируемые опухоли.
Грибовидный и полиповидный рак характеризуется экзофитным отграниченным ростом (Рис.1). Язвенный с четко очерченными краями рассматривается как деструктивная форма полиповидного рака.
Язвенно-инфильтративный рак не имеет четких границ и встречается наиболее часто (60%). Рентгенологически и эндоскопически может походить на обычную хроническую язву.
Диффузный рак характеризуется утолщением всех стенок желудка. Для двух последних форм характерно более злокачественное течение, они чаще дают метастазы и менее благоприятны в прогностическом отношении.
.
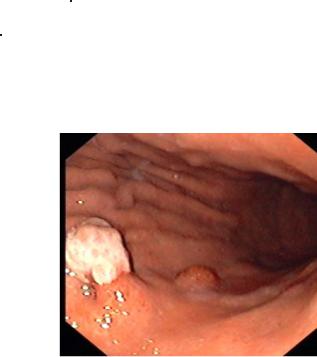
Рис.1 Эндоскопическая и эндосонографическая картина экзофитного рака желудка.
88

Рис.2. Язвенно-инфильтративный и диффузный рак желудка
Ранним раком считают первичную опухоль категории T1 (инвазия в пределах слизистой и подслизистого слоя), при поражения регионарных л\узлов (рис.3).
Тип 1 – выбухающий, или приподнятый (protruded); соответствует грибовидному или полиповидному раку, выступает над уровнем слизистой оболочки более чем на 0,5 мм, составляет около 13%.
Тип 2 – поверхностный рак (superficial); его, в свою очередь, подразделяют на три подтипа: Подтип А – слегка выбухающий, бляшковидный (elevated), возвышающийся над слизистой оболочкой менее чем на 0,5 мм, составляет около 16%;
Подтип В – плоский (flat), составляет около 2%;
Подтип С – слегка западающий, эрозивный рак (depressed); характеризуется поверхностными изъязвлениями слизистой оболочки желудка, углубленный не более чем на 0,5 мм ниже уровня слизистой оболочки, составляет около 59%.
Рис 3. Типы рака желудка
Тип 3 – подрытый, язвенный (excavated), с деструкцией стенки глубиной более 0,5 мм, встречается примерно в 10% случаев.
По гистологическому строению РЖ отличается большим разнообразием. Это аденокарциномы различной степени злокачественности, недифференцированный рак, плоскоклеточный и неклассифицируемые раки.
Метастазирование и стадии
Японским обществом по изучению рака желудка в 1981 году была разработана классификация регионарных лимфоузлов, поэтапно поражающихся от N1 до N3.
N1 – лимфатические узлы первого порядка
правые паракардиальные, левые паракардиальные, лимфатические узлы малой кривизны,
лимфатические узлы большой кривизны, надпривратниковые, подпривратниковые (1-6).
89
N2 – лимфатические узлы второго порядка
вдоль левой желудочной артерии (7), вдоль общей печеночной артерии (8), вокруг чревного ствола (9), ворот селезенки (10), вдоль селезеночной артерии (11).
N3 – лимфатические узлы третьего порядка
в печеночно-двенадцатиперстной связке (12), ретропанкреатические (13), в корне брыжейки ободочной кишки (14),
N4 – лимфатические узлы четвертого порядка
по ходу верхней брыжеечной артерии (15) и парааортальные (16).
Гематогенные метастазы могут поражать печень, реже – легкие, надпочечники, кости, подкожную клетчатку. Имплантационные метастазы реализуются после прорастания серозной оболочки желудка в виде карциноматоза брюшины, сопровождающегося асцитом. По току лимфы через грудной лимфатический проток могут поражаться лимфоузлы в левой надключичной области (метастаз Вирхова), он легко доступен пальпации, также как и метастаз в пупок – метастаз сестры Жозеф. У женщин в запущенных случаях могут определяться метастазы рака в яичники – опухоль Крукенберга. Вот почему при выявлении опухолей яичника во всех случаях рекомендуется рентгенологическое и эндоскопическое обследование желудка. В далеко зашедших стадиях могут быть выявлены метастазы РЖ в параректальную клетчатку дна таза – метастаз Шницлера. Иногда они могут вызывать кишечную непроходимость, и тогда потребуется наложение противоестественного заднего прохода. Метастаз Шницлера может быть выявлен при пальцевом исследовании прямой кишки.
Группировка по стадиям в системе TNM (табл.1)
Т – первичная опухоль Тis – carcinoma in situ
Т1 – опухоль, ограниченная слизистой оболочкой желудка и подслизистым слоем. Т2 – опухоль инфильтрирует стенку желудка до субсерозной оболочки.
Т3 – опухоль прорастает серозную оболочку без инвазии в соседние органы. Т4 – Опухоль распространяется на соседние органы.
N – регионарные лимфатические узлы (ЛУ), отмечают после гистологического исследования. N0 – нет признаков метастатического поражения.
N1 – имеются метастазы в 1-6 регионарных ЛУ.
N2 – имеются метастазы в 7-15 регионарных ЛУ.
N1 – имеются метастазы более чем в 15 регионарных ЛУ. Nx – недостаточно данных для оценки ЛУ.
М – отдаленные метастазы.
М0 – нет признаков отдаленных метастазов.
М1 – имеются клинические, рентгенологические или операционные данные о наличии отдаленных метастазов, включая лимфоузлы, кроме регионарных
Группировка по стадиям
СТАДИЯ |
T |
N |
M |
Стадия 0 |
Т is |
N0 |
M0 |
Стадия 1А |
T1 |
N0 |
M0 |
Стадия 1В |
T1 T2 |
N1 N0 |
M0 |
Стадия 2 |
T1 T2 T3 |
N2 N1 N0 |
M0 |
Стадия 3А |
T2 T3 T4 |
N2 N1 N0 |
M0 |
Стадия 3В |
T3 |
N2 |
M0 |
Стадия 4 |
Любая Т |
Любая N |
M1 |
90
