
65bbb357_pedfak_kpf
.pdf• Сердечно-сосудистый синдром наблюдают при тяжёлой железодефицитной анемии. У детей развиваются повышенная утомляемость, низкое АД, тахикардия, снижение тонуса сердечной мышцы, приглушение тонов, функциональный, довольно грубый систолический шум, хорошо выслушиваемый на сосудах («шум волчка») и связанный с гидремией. Возможны головокружения.
Клинические формы преимущественно железодефицитных анемий
Ранняя анемия недоношенных
Ранняя анемия недоношенных развивается на 1-2-м месяце жизни более чем у половины недоношенных и изредка у доношенных детей («физиологическая» доброкачественная анемия), особенно при неблагоприятном преморбидном фоне. При объективном обследовании отмечают только бледность (при снижении концентрации Hb до 80 г/л). При исследовании периферической крови обнаруживают нормоили гиперхромную норморегенераторную анемию, часто достигающую тяжёлой степени.
Основными причинами развития ранней анемии считают усиленный «физиологический» гемолиз эритроцитов, содержащих HbF, недостаточную функциональную и морфологическую зрелость красного костного мозга, снижение продукции тканевых эритропоэтинов вследствие гипероксии, имевшей место при рождении ребёнка. Большое значение имеет также дефицит многих необходимых для кроветворения веществ, откладывающихся в депо только в последние 2 мес беременности (белок, витамины C, E, группы B, медь, кобальт) и обеспечивающих всасывание, транспорт, обмен и фиксацию железа в молекуле гема, а также стабильность оболочек и мембран эритроцитов. Присутствует и дефицит железа в депо, временно компенсированный текущим гемолизом, но чётко выявляемый путём обнаружения микроцитоза и гипохромии части эритроцитов, снижения концентрации сывороточного железа и количества сидероцитов в пунктате красного костного мозга. Как только неонатальные запасы железа истощаются, ранняя анемия переходит в позднюю анемию недоношенных.
Поздняя анемия недоношенных
Поздняя анемия недоношенных (конституциональная) развивается на 3-4-м месяце жизни в результате истощения неонатальных запасов железа в депо. Клинические проявления обычно незначительны, лабораторные данные свидетельствуют о преимущественном дефиците железа.
Хлороз
Хлороз — редкое заболевание девочек в период полового созревания. Развивается на фоне нарушения режима и эндокринной дисфункции. Проявляется слабостью, повышенной утомляемостью, анорексией, извращением вкуса, головокружениями, иногда обмороками, сердцебиением, болями в эпигастральной области, тошнотой, рвотой, запорами. Характерны «алебастровая», в некоторых случаях с зеленоватым оттенком, бледность кожи, нарушения менструального цикла (олигоили аменорея). Выздоровление обычно самопроизвольное,
71
возможны рецидивы. Лабораторные исследования указывают на преимущественный дефицит железа.
13.2. Патология белой крови
В 1 литре крови у новорожденного — 30 |
х109 /л лейкоцитов, в 1 месяц — 12,1 х109/л, в I год |
—10,5xl0 9/л, в 3—10 лет - 8—l0xl0 9/л, в 14—17 |
лет, как и у взрослых, - 4-9х109/л. Таким образом, |
имеет место постепенное снижение уровня лейкоцитов.
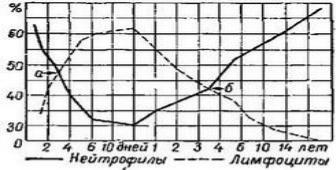
Лейкоцитарная формула у новорожденных такая же, как и у взрослых; на долю нейтрофилов приходится 68%, а на долю лимфоцитов — 25%; на 5-6-й день после рождения возникает, так называемый, «первый перекрест» — нейтрофилов становится меньше (до 45%), а лимфоцитов — больше (до 40%) (рис. 8). Такое соотношение сохраняется примерно до 5-б лет («второй перекрест»). Например, на 2—3 месяц доля нейтрофилов составляет 25—27%, а доля лимфоцитов — 60—63%. Это указывает на существенное повышение интенсивности специфического иммунитета у детей первых 5—6 лет. Малым содержанием нейтрофилов, а также недостаточной их зрелостью и фагоцитарной активностью отчасти объясняется большая восприимчивость детей младших возрастов к инфекционным заболеваниям. После 5—6 лет постепенно, к 15 годам, соотношение, характерное для взрослых, восстанавливается.
Рис. 8. Изменение содержания в крови ребенка нейтрофилов и лимфоцитов в зависимости от возроста
Лейкоцитозы
Удетей первых дней жизни имеется лейкоцитоз с нейтрофилией и сдвигом влево. У детей, родившихся на 7-м месяце беременности и раньше, лимфоциты превалируют над нейтрофилами.
Удетей, родившихся после 7,5 месяцев беременности, в первые дни жизни отмечается нейтрофилия с выраженным регенеративным сдвигом.
Удетей раннего возраста лейкоцитоз может развиваться под действием различных физиологических и патологических факторов (страх, боль, глубокое дыхание, кашель, физическое усилие).
При тяжелых инфекционных заболеваниях у детей раннего возраста реакция кроветворной системы имеет индивидуальный характер. В одних случаях развивается выраженный нейтрофильный лейкоцитоз с генеративным сдвигом, в других – лейкопения.
72
Лейкоцитоз новороженного. Сразу после появления на свет у ребенка содержание лейкоцитов составляет 12-15*109/л, при этом до 35% составляют лимфоциты. На вторые сутки поле рождения число лейкоцитов снижвется, но может сохраняться на протяжении недели. Лейкоцитоз новорожденного связан с перенесенным стрессом во время родового акта.
Лейкемоидные реакции Лейкемоидные реакции у детей наблюдаются чаще, чем у взрослых из-за незрелости
кроветворной ткани. Чаще наблюдаются лейкемоидные реакции лимфо-моцитарного типа, реже – миелоидного типа. Основной причиной являются острые инфекции: краснуха, коклюш, ветряная оспа, скарлатина, септическое состояние.
В крови лейкоцитоз (30-60)х109/л, лимфоцитоз 70-80%, иногда анемия и тромбоцитопения. Миелоидные лейкемоидные реакции у детей наблюдаются при тяжелом инфекционном
процессе, сепсисе, скарлатине, при длительном приеме глюкокортикоидов. В крови выявляется лейкоцитоз, нейтрофилия с ядерным сдвигом влево до миелобластов. При лечении основного заболевания, изменения в крови при лейкемоидной реакции исчезают через 3-5 недель, реже сохраняются до 3 месяцев.
Также имеет свои возрастные особенности лейкоцитарная формула. Напомним, что под этим понимается соотношение различных форм лейкоцитов в процентах.
13.3.Патология гемостаза
13.3.1.Особенности гемостаза у новорожденны детей
1.В первые минуты и часы жизни ребенка преобладают прокоагулянтные и проагрегантные влияния.
2.В раннем неонатальном периоде (и, прежде всего, в первый день жизни ребенка) новорожденные склонны как к тромботическим, так и к геморрагическим осложнениям.
3.Сосудисто-тромбоцитарное звено гемостаза у здоровых доношенных характеризуется повышенной проницаемостью и хрупкостью сосудистой стенки, нормальным количеством тромбоцитов и их активацией при рождении, с последующим (к концу первых суток жизни) снижением их количества и функциональной активности.
4.Коагуляционное звено гемостаза характеризуется тенденцией к гиперкоагуляции при наличии транзиторной (в пределах первого часа жизни) резко повышенной активности фибринолиза, существенными различиями между показателями пуповинной и венозной крови в первые сутки жизни, разнонаправленностью тромбоцитарного и плазменного компонентов гемостаза, сочетающихся с повышенной свертываемостью цельной крови.
5.Вариабельность большинства гемостатических параметров у одного и того же здорового доношенного новорожденного в раннем неонатальном периоде является физиологическим
73
явлением, обеспечивающим адаптацию всех систем к внеутробной жизни. Выход их за известные пределы колебаний, т. е. физиологические границы, повышает риск как тромботических, так и геморрагических осложнений, в связи с чем однократное определение любого из показателей гемостаза не является диагностически значимым, так как может отражать компенсаторный механизм, в связи с чем необходимо проводить комплексное, динамическое наблюдение с учетом периода адаптации.
6.Наибольшей напряженностью системы гемостаза с выраженной склонностью к гипокоагуляции (как плазменного, так и клеточного звена) характеризуются третьи сутки жизни ребенка, что является биологически целесообразным явлением, так как обеспечивает микроциркуляцию в условиях гемодинамической адаптации.
7.На состояние системы гемостаза у новорожденных влияют сроки перевязки пуповины и раннего прикладывания ребенка к груди. Поздняя (после перекачивания крови из плацентарных сосудов в кровоток ребенка) перевязка пуповины и раннее прикладывание к груди (в первые 2 часа после родов) уменьшают послеродовую депрессию компонентов ССК.
8.Недоношенные новорожденные склонны к кровоточивости как во внутриутробном, так
ив интранатальном периодах, причем эта тенденция продолжает нарастать сразу же после рождения ребенка и первые дни его жизни, с усугублением на фоне различных патологических состояний, развивающихся у этих новорожденных в результате действия перинатальной гипоксии. При этом у части таких детей из-за низкой активности фибринолиза и антикоагулянтов, а также развития декомпенсированного ДВС-синдрома возможно сочетание ковоточивости с тромбозами.
На основании сравнения гемокоагуляции у детей 3-5 дней жизни выделены 4 уровня коагуляционного статуса новорожденных:
1.физиологический, свойственный здоровым доношенным новорожденным, при нем суммарное содержание прокоагулянтов 30-50%.
2.пограничный — уровень тех же компонентов от 10 до 30%. Группа риска.
3.патологически низкий (уровень факторов менее 10%) — приводит к развитию геморрагической болезни новорожденных.
4.патологически высокий (более 60%) — увеличивает риск тромбоцитозов и ДВС.
13.3.2.Наиболее часто встречающиеся неонатальные расстройства гемостаза
Геморрагическая болезнь новорожденных
Геморрагическая болезнь новорожденных — К-витаминодефицитный геморрагический синдром, развивающийся у 0,25-0,5% детей. Умеренное уменьшение факторов II, VII, IX и X обычно характерно для большинства новорожденных в возрасте 48 — 72 ч. Постепенно эти факторы достигают исходных уровней к 7 — 10му дню жизни. Такой транзиторный дефицит К- витаминзависимых факторов можно объяснить отсутствием свободного витамина К у
74
беременной, незрелостью печени новорожденного и отсутствием бактериальной кишечной флоры, синтезирующей этот витамин.
Иногда у доношенных, а чаще у недоношенных, новорожденных уровень витамина К продолжает снижаться и усиливается его дефицит на 2 — 5- й день жизни, что приводит к спонтанным и длительным кровотечениям. Поскольку в грудном молоке содержится меньше, чем в коровьем, витамина К, то геморрагии чаще наблюдаются у детей, находящихся на грудном вскармливании.
Геморрагическая болезнь новорожденных вследствие острого транзиторного дефицита К- витаминзависимых факторов проявляется кровотечениями из желудочно-кишечного тракта, носа, а так же внутричерепными кровотечениями или начинающимися после обрезания. При этом протромбиновое время, время свертывания крови и рекальцификации плазмы удлинено, а уровни протромбина и факторов VII, IX и X значительно снижены.
Неонатальные тромбоцитопенические пурпуры
Тромбоцитопеническая пурпура (ТПП ) — заболевание, характеризующееся геморрагическими проявлениями в виде кровоизлияний под кожу и кровотечений, возникающих в результате снижения количества тромбоцитов.
Термин “ пурпура” ( от латинского — purpura — драгоценная античная краска темнобагрового цвета, которую добывали из пурпурной улитки и применяли для окраски тканей) означает появление кровоизлияний (геморрагий) на коже и слизистых оболочках. Кровоизлияния на коже могут быть мелкоточечными (петехии) и/или более крупными — пятнистыми (экхимозы). Пурпура появляется спонтанно лишь в том случае, когда количество тромбоцитов в крови снижается ниже 50 000/ мкл. То есть причиной геморрагического синдрома является тромбоцитопения.
Выделяют 2 варианта неонатальной ТПП: изоиммунную и трансиммунную неонатальные
ТПП.
а) изоиммунная (аллоиммунная) тромбоцитопеническая пурпура. Развитие данного заболевания схоже с гемолитической болезнью, однако иммунологический конфликт обусловлен несовместимостью плода и матери по тромбоцитарным антигенам (чаще всего по PLA1-антигену, который отсутствует у матери). В сенсибилизированном материнском организме появляются антитромбоцитарные антитела, которые, проникая через плаценту, вызывают разрушение тромбоцитов у плода. Изосенсибилизация может быть как при повторной, так и при первой беременности. Встречается с частотой 1 случай на 1000 новорожденных;
б) трансиммунная тромбоцитопеническая пурпура развивается у детей, родившихся от матерей, страдающих аутоиммунной тромбоцитопенией. Это бывает при идиопатической тромбоцитопенической пурпуре, системной красной волчанке, аутоиммунном тиреоидите, синдроме Эванса и др. Аутоантитела матери проникают через плаценту и вызывают разрушение
75
тромбоцитов у плода. Поскольку после рождения ребенка проникновение антител от матери к ребенку прекращается, то данная форма заболевания имеет благоприятный прогноз.
Гетероиммунные (острые) формы чаще всего встречаются у детей раннего возраста и реже — у новорожденных, аутоиммунные (хронические) формы — у детей старшего возраста и подростков.
Вторичные коагулопатии печеночного генеза.
Вторичные коагулопатии печеночного генеза, как правило, развиваются при течении внутриутробных инфекций с гепатитом и характеризуются, кроме геморрагического синдрома, увеличением печени, желтухой и иногда асцитом.
Возникает дефицит не только К-зависимых факторов, но и других, в том числе – фибриногена. Особенно тяжелый геморрагический синдром отмечается при поражении печени вирусами герпетической группы (ЦМВ). Уточнению правильного диагноза помогают установление повышенной активности трансаминаз, повышения уровня билирубина и его прямой фракции, низкого уровеня альбуминов и выявление этиологического фактора.
Наследственные коагулопатии
Наследственные коагулопатии у новорожденных диагностируют редко. Характер геморрагического синдрома, проявляющийся при гемофилии в периоде новорожденности, существенных отличий от других коагулопатий новорожденных не имеет.
Самые распространенные наследственные коагулопатии — гемофилии.
Гемофилия А (85% от всех форм гемофилий). Аномалия VIII фактора (антигемофильный глобулин А). Наследуется рецессивно, сцеплено с Х-хромосомой, болеют мужчины, а женщины являются носительницами патологического гена. При данной патологии формируется нарушение внутреннего механизма образования протромбиназы. Проявления: подкожные, внутримышечные и внутрисуставные кровоизлияния.
Гемофилия В (болезнь Кристмаса, 10% от всех форм гемофилий). Дефицит IX фактора. Наследуется рецессивно, сцеплено с Х-хромосомой. Также приводит к нарушению внуттреннего пути образования протромбиназы. Проявления те же, что и при гемофилии А.
ДВС-синдром у детей
Синдром диссеминированного внутрисосудистого свертывания крови (синдром ДВС) является частым и тяжелым осложнением разнообразных патологических процессов перинатального периода и периода новорожденности. Он наблюдается в 36-50% всех случаев перинатальной смерти.
Этиология
Удоношенных новорожденных его развитию могут способствовать следующие условия:
−недоразвитость РЭС — нет полного удаления промежуточных продуктов коагуляции;
76
−недостаточность микроциркуляторной васкуляризации;
−недостаточный синтез печеночных факторов свертывания, противосвертывания, фибринолиза (фибриногена, витамин-К-зависимых факторов, антитромбина III,
плазминогена) вследствие незрелости бслково-синтетической функции печени. Факторы риска ДВС-синдрома у новорожденных.
−заболевания матери (нефрит, диабет, пороки сердца)
−токсикоз беременных
−длительная асфиксия плода
−патология родов (отслойка плаценты, обвитие пуповины)
−недоношенность
−тяжелый резус-конфликт, сопровождающийся гемолизом
−инфекции, особенно вызванные грамм-отрнцатсльной микрофлорой
−синдром дыхательных расстройств (болезнь гиалиновых мембран – они
образованы сгустками фибрина, следовательно, развивается гипокоагуляция). Причины ДВС у новорожденных:
1. гемолитическая болезнь новорожденных (много тромбопластина выделяется эритроцитами);
2.ИДС (синдром Вискотта-Олдрича) — из-за тромбоцитопатии нарушается тромбоцитарно-сосудистый гемостаз;
3.инфекции.
Патогенез
У недоношенных детей, детей с задержкой внутриутробного развития плода, у детей, развивавшихся внутриутробно на фоне хронической гипоксии, при рождении выявляются еще более низкие величины активности как прокоагулянтов, так и антикоагулянтов, факторов контакта, но более активный фибринолиз при более низком уровне плазминогена, а также агрегационной активности тромбоцитов, большую проницаемость и хрупкость сосудистой стенки. Эти дети склонны как к повышенной кровоточивости, так и тромбозам из-за быстрого истощения фибринолиза и антикоагулянтов в первые же часы и дни жизни.
Гипоксия, которая обычно сопровождается ацидозом и снижением периферической перфузии, приводит к развитию синдрома ДВС путем высвобождения тканевого фактора из поврежденных лейкоцитов и клеток эндотелия. Этот механизм играет в данном случае более важную роль, чем тромбоцитарное звено гемостаза или внутренний путь активации свертывания, при гипоксии имеет значение также снижение синтеза факторов свертывания крови печенью изза ее гипоксического повреждения.
ДВС возникает на фоне гемолиза эритроцитов с освобождением тромбопластина, а также
77
под влиянием образования непрямого билирубина, способствующего нарушению обменных и окислительных процессов в тканях и нарушению сосудистой проницаемости. Некоторые авторы
всхему лечения ГБН предлагают включать поэтому антикоагулянтную терапию.
Уноворожденных от матерей с различными формами гестозов, родившихся в асфиксии, у новорожденных с полицитемическим синдромом обычно формируется гипервязкость крови, гиперкоагуляция, гиперагрегабельность тромбоцитов, которые предрасполагают к тромбозам.
Следовательно, особенности состояния системы гемостаза у новорожденных очень тесно зависят от течения перинатального периода, в том числе от фармакотерапии матери.
При ДВС-синдроме у новорожденных обнаружено наличие чисто фибриновых или эритроцитарных тромбов в системе микроциркуляции. Чаще поражаются легкие (у взрослых - почки). Возможен тромбоз крупных сосудов синусов твердой мозговой оболочки, артериального протока.
14.Патология сердечно-сосудистой сстемы
14.1.Особенности аритмии сердца у детей
Вструктуре сердечно-сосудистых заболеваний детского возраста аритмии составляют (по
обращаемости) от 2,3 до 27%, но их нередко выявляют и у здоровых детей. Нарушения сердечного ритма и проводимости обнаруживают у детей всех возрастов, включая новорождённых, их выявляют даже у плода. Частота увеличивается в пубертатном периоде.
Этиология и патогенез
Нарушения ритма могут быть врождёнными или приобретёнными и обусловлены кардиальными, экстракардиальными и сочетанными причинами. В детском возрасте аритмии чаще имеют экстракардиальное происхождение. При этом большую роль играет перинатальная патология (неблагоприятное течение беременности и родов, недоношенность, внутриутробная гипотрофия, инфицирование), приводящая к нарушению морфогенеза и функциональной незрелости проводящей системы сердца. Перинатальные повреждения ЦНС могут привести к нарушению нейровегетативной регуляции ритма с изменением взаимоотношений симпатического и парасимпатического отделов вегетативной нервной системы, вследствие чего возникают электрическая нестабильность миокарда и проводящей системы сердца, а также снижение функциональных резервов адаптации симпатоадреналового звена регуляции сердечного ритма.
Нарушения ритма у детей нередко протекают бессимптомно, что не позволяет точно установить время их появления. Приблизительно в 40% случаев аритмии выявляют случайно (на ЭКГ) либо их обнаруживают при обследовании в связи с перенесённой ОРВИ. Дети значительно реже взрослых жалуются на сердцебиение, ощущение перебоев в деятельности сердца, его замирание, даже при тяжёлых формах аритмии. Наряду с этим в препубертатном и пубертатном
78
возрасте нарушения ритма могут иметь яркую эмоциональную окраску, обусловленную психовегетативными расстройствами, и сопровождаются другими кардиальными и экстракардиальными жалобами: болями в области сердца, повышенной возбудимостью, нарушениями сна, метеочувствительностью. При аритмиях возможны слабость, головокружение и обмороки (при синусовой брадикардии, атриовентрикулярной блокаде, синдроме слабости синусового узла, пароксизмальных тахикардиях).
Синусовая аритмия, связанная с неравномерным генерированием импульсов в синусовом узле на фоне избыточных вагусных влияний, характерна для детей старше 5 лет. Наиболее часто она наблюдается в форме дыхательной аритмии. На высоте вдоха частота сердечных сокращений увеличивается, на выдохе — уменьшается.
Синусовая брадикардия (урежение сокращений сердца до 100 и менее в 1 мин у детей первых 2 лет жизни и до 80—60 в 1 мин у более старших) может быть проявлением гиперактивности вагуса, иногда генетически детерминированной, но чаще наблюдаемой у детей с признаками спортивного сердца, при гипотиреозе, черепно-мозговой травме. При резкой и стойкой брадикардии больные могут жаловаться на головокружение, слабость, утомляемость; возможны синкопе.
Синусовая тахикардия (частота сокращений выше 140—200 в 1 мин у детей раннего возраста и выше 100—110 в 1 мин у более старших) также может быть и функциональной, обусловленной вегетативной дисрегуляцией, и органической. Функциональный ее генез подтверждается положительной пробой с обзиданом (0,5—1 мг/кг): происходит урежение сокращений не менее чем на 10—12 в 1 мин.
Миграция водителя ритма у детей выявляется по ЭКГ так же, как у взрослых. Ее связь с ваготонией предполагают, если она исчезает в вертикальном положении, при физической нагрузке или пробе с атропином; стойкость нарушений характерна для слабости синусового узла.
Экстрасистолия у детей выявляется чаще других аритмий, причем преобладают суправентрикулярные экстрасистолы. Диагноз и лечение строятся на тех же принципах, что и у взрослых.
Пароксизмальная тахикардия у детей также чаще бывает суправентрикулярной и в большинстве случаев не связана с приобретенным органическим поражением сердца; нередко в основе ее возникновения лежит вегетативная дисфункция на фоне врожденных особенностей проводящей системы сердца. Желудочковая пароксизмальная тахикардия встречается у детей очень редко. Диагноз и лечение — как у взрослых.
Распознавание и лечение мерцания предсердий и желудочков, атриовентрикулярной блокады и других нарушений функций автоматизма и проводимости сердца у детей, в основном, такие же, как у взрослых.
79
14.2. Ювенильная артериальная гипертензия
Артериальная гипертензия - стойкое повышение АД выше 95-го центиля шкалы распределения значений АД для конкретного возраста, пола, массы и длины тела ребёнка. Нормальным АД принято считать значения систолического и диастолического АД, не выходящие за пределы 10 и 90 центилей. «Высоким нормальным давлением», или пограничной гипертензией, считают величину АД между 90 и 95 центилями.
Распространённость артериальной гипертензии у детей, по данным разных авторов, составляет от 1% до 14%, среди школьников - 12-18%.
У детей первого года жизни, а также раннего и преддошкольного возраста артериальная гипертензия развивается крайне редко и в большинстве случаев имеет вторичный симптоматический характер. Наиболее предрасположены к развитию артериальной гипертензии дети препубертатного и пубертатного возраста, что во многом определяется свойственными этим периодам детства вегетативными дисфункциями.
Классификация
Как и у взрослых, выделяют первичную (эссенциальную) артериальную гипертензию и вторичную (симптоматическую) артериальную гипертензию.
Этиология
Первичная артериальная гипертензия. Этиологию эссенциальной артериальной гипертензии связывают со многими факторами, прежде всего с наследственностью. К факторам риска развития артериальной гипертензии относят:
•постоянное психоэмоциональное напряжение, конфликтные ситуации в семье и школе;
•личностные особенности ребёнка (тревожность, мнительность, склонность к депрессиям, страхам и т.д.) и его реакции на стресс;
•избыточную массу тела;
•особенности обмена веществ (гиперурикемия, низкая толерантность к глюкозе, нарушение соотношения фракций холестерина);
•чрезмерное потребление поваренной соли.
К группам риска также относят детей с отягощённой по артериальной гипертензии наследственностью, подростков с «высоким нормальным артериальным давлением» (90-95-й центиль).
Вторичная артериальная гипертензия. В большинстве случаев стойкая артериальная гипертензия у детей бывает вторичной. Структура причин артериальной гипертензии имеет отчётливые возрастные особенности (табл. 1).
Таблица 1 Наиболее частые причины артериальной гипертензии у детей в зависимости от их возраста
80
