
get_2 физика
.pdf
2 |
pdV |
|
V2 nRdV |
|
V |
2 |
|
m |
|
V |
2 |
|
|||
DS = ò |
|
|
= ò |
|
|
=nR ln |
|
= |
|
R ln |
|
. |
|||
|
|
|
|
V1 |
|
|
|
||||||||
1 |
T |
|
|
V1 |
V |
|
|
M |
|
V1 |
|||||
Тогда для изменения энтропии нагревателя получим вы- |
|||||||||||||||
ражение: |
|
m |
|
V2 |
|
|
|
|
|
|
|
|
|
|
|
DSнагр |
= - |
R ln |
. |
|
|
|
|
|
|
|
|
|
|||
M |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|||
Аналогично для изменения энтропии холодильника находим:
DSхол = - m R ln V4 . M V3
Производя расчеты и учитывая (4), получаем:
DSнагр = DSхол = 4,04 ×103 Дж/К.
Коэффициент полезного действия тепловой машины:
h = |
Q1 - Q2 |
= 1- |
Q2 |
. |
Q |
|
|||
|
|
Q |
||
|
1 |
1 |
|
|
Для цикла Карно с учетом (2), (3), (4) находим значение КПД:
h = 1- T3 = 0,5 .
T1
Ответ: A =1,02 ×106 Дж, DSнагр = DSхол = 4043,6 Дж/К, η = 0,50 .
Пример 14. Горячая вода некоторой массы отдает теплоту холодной воде такой же массы, и температуры их становятся одинаковыми. Показать, что энтропия при этом увеличивается.
Решение. Пусть температура горячей воды T1 , холодной T2 , а
температура смеси Θ . Определим температуру смеси исходя из уравнения теплового баланса, которое представляет собой закон сохранения энергии: в замкнутой термодинамической системе сумма отданных (Q < 0) и полученных (Q > 0) телами системы
количеств теплоты равна нулю Q1 + Q2 + ... + Qn = 0 . Приравняем
количество полученной и отданной теплоты: mc(T1 - Q) = mc(Q - T2 ),
где c – удельная теплоемкость воды.
141

После преобразования выражение запишется в виде:
T1 - Q = Q - T2 , откуда Q = (T1 + T2 ) 2 . |
(1) |
Изменение энтропии, происходящее при охлаждении горячей воды, определяется выражением [15.4] с учетом [13.7]:
Θ cmdT |
|
Q |
|
||
DS1 = ò |
|
= cm ln |
|
, |
|
T |
T1 |
||||
T1 |
|
|
|||
при нагревании холодной воды:
Θ cmdT |
|
Q |
|
||
DS2 = ò |
|
= cm ln |
|
. |
|
T |
T2 |
||||
T2 |
|
|
|||
Изменение энтропии всей системы равно сумме изменений энтропии частей:
DS = DS1 + DS2 |
= cmln |
Q |
+ cm ln |
Q |
= cmln |
Q2 |
|||
T1 |
T2 |
T1T2 |
|||||||
|
|
|
|
|
|
||||
или с учетом соотношения (1) имеем: |
|
||||||||
|
(T + T )2 |
|
|
|
|
|
|||
DS = cm ln |
1 |
2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
4T T |
|
|
|
|
|
|||
|
1 |
2 |
|
|
|
|
|
|
|
Так как (T1 + T2 )2 ñ4T1T2 , то S > 0 . Таким образом, энтропия всей системы увеличивается.
Пример 15. Вычислить эффективный диаметр молекулы азота, если его критическая температура 126 К, критическое давление
3,4 МПа.
Дано:
Tкр =126 К,
pкр = 3,4 ×106 Па.
Найти: d .
Решение. Состояние азота, согласно условию задачи, может быть описано уравнением Ван-дер-Ваальса как для реального газа
[16.1]:
æ |
m2 |
|
a |
öæ |
m |
ö |
|
m |
|
||
ç p + |
|
|
|
|
|
֍V - |
|
b÷ |
= |
|
RT . |
|
2 |
|
|
2 |
|
|
|||||
ç |
M |
V |
÷ |
M |
ø |
|
M |
|
|||
è |
|
|
øè |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
142 |
|

Постоянную b в уравнении Ван-дер-Ваальса с достаточной степенью точности считают равной учетверенному собственному объему молекул одного моля газа. В одном моле газа находится
6,02×1023 молекул ( N A = 6,02 ×1023 моль-1), следовательно, объем одной молекулы равен:
V = |
|
1 |
|
pd 3 |
= |
|
b |
|
, |
|
||
6 |
|
|
||||||||||
|
|
|
|
|
|
4N A |
||||||
откуда: |
|
|
|
|
|
|
|
|||||
d = |
|
|
3 |
3b |
|
|
. |
|
|
|
||
|
2pN A |
|
|
|
||||||||
Постоянная |
b = |
Tкр R |
, тогда окончательно получим выраже- |
|||||||||
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
8 pкр |
||
ния для расчета искомого диаметра:
d = 3 |
|
3Tкр R |
|
= 3 |
3 ×126 ×8,31 |
|
= 3,1×10−10 м. |
|
16ppкр N A |
|
16 × 3,14 × 3,4 ×106 × 6,02 ×1023 |
|
|||||
Ответ: d = 3,1×10−10 м.
Пример 16. Некоторый газ количеством вещества 1,0 кмоль занимает объем 1,0 м3. При расширении газа до объема 1,5 м3 была совершена работа против сил межмолекулярного притяжения, равная 45,3 кДж. Определить поправку, входящую в уравнение Ван-дер-Ваальса.
Дано:
ν = 1,0 кмоль =1,0 ×103 моль,
V1 =1,0 м3,
V2 =1,5 м3,
A = 45,3кДж = 4,53 ×104 Дж.
Найти: a .
Решение. Работа, совершаемая против сил межмолекулярного притяжения, определяется выражением [13.5]:
143

|
|
|
V2 |
¢ |
|
|
A = ò p dV , |
||||
|
|
|
V1 |
|
|
где |
p |
¢ |
n2 a |
– внутреннее давление, обусловленное силами взаи- |
|
= V 2 |
|
||||
|
|
||||
модействия молекул. Таким образом:
|
2 |
V2 |
dV |
|
2 |
æ |
1 |
A = n |
|
a ò |
|
= n |
|
aç |
|
|
V 2 |
|
|
||||
|
|
V |
|
|
çV |
||
|
|
1 |
|
|
|
è |
1 |
- 1
V2
ö
÷ =
÷
ø
n2 a(V2 -V1 ) .
V1V2
Откуда окончательно получим значение поправки:
|
AV V |
2 |
|
45,3 ×10 |
3 ×1,0 ×1,5 |
4 |
2 |
|
1 |
|
|
|
|
||||
a = |
|
|
= |
|
= 0,14 Н×м /моль . |
|||
n2 (V2 |
-V1 ) |
(103 )2 (1,5 -1,0) |
||||||
Ответ: a = 0,14 Н×м4/моль2.
Пример 17. Капиллярная трубка с внутренним диаметром 0,40 мм наполнена водой. Часть воды нависла внизу в виде капельки, которую можно принять за часть сферы радиусом 2,0 мм. Определить высоту столбика воды в трубке.
Дано:
d = 0,40 мм = 4,0 ×10−4 м, r = 2,0 мм = 2,0 ×10−3 м, s = 7,2 ×10−2 Н/м,
r =1000 =1,000 ×103 кг/м3.
Найти: h .
Решение. Обозначим p1 и p2 давления, обусловленные кривизной верхнего и нижнего менисков (рис. 2.12). Оба давления направлены вверх. Их сумма p1 + p2 уравновешивается гидростатическим давлением столба воды высотой h , то есть:
p1 + p2 = rgh . |
(1) |
|
144 |
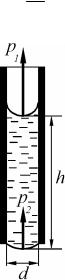
Давления p1 и p2 находим по формуле Лапласа [17.4]:
Dp = 2Rs .
В случае полного смачивания радиус верхнего мениска равен радиусу капилляра R = d 2 . Таким образом, дополнительное дав-
2 . Таким образом, дополнительное дав-
ление, обусловленное наличием верхнего мениска, равно:
|
|
|
|
p |
= |
|
2s |
|
|
= |
4s |
. |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
R |
|
|
d |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
Давление, обусловленное нижним мени- |
||||||||||||||||||||
|
|
|
ском при условии R = r : |
|
|
|||||||||||||||||||
|
|
|
|
p2 |
|
|
= |
|
2s |
. |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
||||
|
|
|
|
Тогда равенство (1) запишется в виде: |
||||||||||||||||||||
|
|
|
|
æ |
4 |
|
|
|
|
|
2 |
ö |
= rgh . |
|
|
|||||||||
|
|
|
|
sç |
|
|
|
|
|
+ |
|
|
|
|
÷ |
|
|
|||||||
|
|
|
|
|
|
|
|
|
r |
|
|
|||||||||||||
|
|
|
|
è d |
|
|
|
|
ø |
|
|
|
|
|
|
|
||||||||
|
|
|
|
Откуда окончательно получим выраже- |
||||||||||||||||||||
Рис. 2.12 |
ние для искомой величины: |
|
|
|||||||||||||||||||||
|
|
|
|
h = |
|
|
s |
æ |
|
4 |
+ |
2 |
ö |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
ç |
|
|
|
|
÷ . |
|
|
||||||
|
|
|
|
|
rg |
|
|
R |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
è d |
|
|
ø |
|
|
|||||||||||
Подставляя числовые значения, имеем: |
|
|
||||||||||||||||||||||
|
|
72 ×10−3 |
æ |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
ö |
−2 |
|
||
h = |
|
|
ç |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
÷ = 8,1×10 |
м. |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
1000 × 9,81 |
ç |
4,0 ×10−4 |
|
|
|
|
|
|
|
2,0 ×10−3 |
÷ |
|
|
||||||||||
|
è |
|
|
|
|
|
|
|
ø |
|
|
|||||||||||||
Ответ: h = 8,1×10−2 м = 8,1см.
145
ЗАДАЧИ ДЛЯ ИНДИВИДУАЛЬНЫХ ЗАДАНИЙ
9.СОСТОЯНИЕ ИДЕАЛЬНОГО ГАЗА
9.1.В баллоне емкостью 0,50 м3 находятся 4,0 кг водорода и 6,5 кг азота. Определить давление смеси, если температура окружающей среды 18 °С.
9.2.В баллоне емкостью 30 л находится сжатый воздух при 17 °C. После того как часть воздуха выпустили, давление понизилось на 2×105 Па. Определить массу выпущенного воздуха. Процесс считать изотермическим.
9.3.При какой температуре находился газ, если при нагревании его на 20 °С при постоянном давлении объем увеличился в два раза?
9.4.В баллоне под давлением 1,0 МПа находится газовая смесь кислорода и азота. Считая, что масса азота составляет 80 % от массы смеси, определить парциальные давления отдельных газов.
9.5.Определить молекулярную формулу аммиака, если при дав-
лении 103740 Па и температуре 20 °С его плотность равна 0,736 кг/м3. Учесть, что элементы, из которых образуется аммиак, – это азот и водород.
9.6.В пустой сосуд, объем которого 5,0 дм3, впустили 3,0 дм3 азота под давлением 250 кПа и 4,0 дм3 водорода под давлением 50 кПа. Каково давление образовавшейся смеси?
9.7.Какой объем при нормальных условиях занимает смесь 4,0 кг кислорода и 2,0 кг азота?
9.8.При температуре 27 °С и давлении 12×105 Па плотность смеси водорода и азота равна 10 г/дм3. Определить молярную массу смеси.
9.9.Цилиндрическая трубка, длина которой 30 см, погружается в ртуть на 1/3 своей длины. Затем трубку сверху закрывают пальцем и вынимают из ртути, при этом часть ртути вытекает. Какова длина столбика ртути, оставшейся в трубке, если атмосферное давление 1,05×105 Па?
146
9.10.Стеклянная, запаянная с одного конца трубка открытым концом опущена в сосуд со ртутью. После подъема трубки уровни ртути в сосуде и трубке совпадают. При этом длина части трубки, занятой воздухом, 100 см. Затем трубку поднимают на 10 см. Какой будет после этого высота уровня ртути в трубке, если атмосферное давление 1,05×105 Па? Капиллярными явлениями пренебречь.
9.11.В двух сосудах объемами 5,0 л и 7,0 л находится воздух под давлением 2,0 атм и 1,0 атм. Температура в обоих сосудах одинакова. Какое давление установится, если сосуды соединить между собой? Температура воздуха не меняется.
9.12.В баллоне емкостью 10 л находятся 3,0 г аргона и 5,0 г азота
при температуре 27 °С. Определить молярную массу смеси газов.
9.13. В баллоне емкостью 5,0 л находятся 2,0 г водорода и 1,0 моль азота при температуре 17 °С. Определить плотность смеси газов.
9.14.Какова плотность воздуха в сосуде, емкость которого 2,0 л, если сосуд откачан до 10-3 мм рт. ст., а температура воздуха 15 °С? Как и насколько изменится плотность воздуха в сосуде, если добавить в него 5×10-8 кг воздуха? Какое давление установится в сосуде? Процесс происходит при постоянной температуре.
9.15.В баллоне, емкость которого 20 л, находится 150 г смеси водорода и азота. Давление газовой смеси 1,0 ×106 Па, температура в баллоне 17 °С. Каковы массы азота и водорода в баллоне?
9.16.В сосуде объемом 10 л содержатся 15 г углекислого газа и 5,0 г водорода при температуре 300 К. Определить давление в сосуде при таких условиях, а также давление после нагревания смеси до 400 К.
9.17.В закрытом сосуде содержится смесь газов, состоящая из 100 г углекислого газа и 150 г азота. Определить плотность смеси при температуре 27 °С и давлении 760 мм рт. ст.
9.18.Определить давление газа, содержащего 1,0 ×1019 молекул и имеющего объем 1,0 см3, при температурах 3,0 Κ и 1000 К.
147
9.19.Какой объем занимает смесь азота массой 1,0 кг и гелия массой 1,0 кг при нормальных условиях?
9.20.В баллоне вместимостью 15 л находится смесь, содержащая 10 г водорода, 54 г водяного пара и 60 г оксида углерода. Температура смеси 27 °С. Определить давление.
9.21.В цилиндр длиной 1,6 м, заполненный воздухом при нор-
мальном атмосферном давлении, начали медленно вдвигать поршень, площадь основания которого 200 см2. Определить силу, действующую на поршень, если его остановить на расстоянии 10 см от дна цилиндра.
9.22.В баллоне находится газ при температуре 400 К. До какой температуры надо нагреть газ, чтобы его давление увеличилось в 1,5 раза?
9.23.Баллон вместимостью 20 л заполнен азотом при температуре 400 К. Когда часть газа израсходовали, давление в баллоне понизилось на 200 кПа. Определить массу израсходованного газа. Процесс происходит при постоянной температуре.
9.24.В баллоне вместимостью 15 л находится аргон под давлением 600 кПа и при температуре 300 К. Когда из баллона было взято некоторое количество газа, давление в баллоне понизилось до 400 кПа, а температура установилась 260 K. Определить массу аргона, взятого из баллона.
9.25.Два сосуда одинакового объема содержат кислород. В одном сосуде давление 2,0 МПа и температура 800 К, в другом – 2,5 МПа, 200 К. Сосуд соединили трубкой и охладили находящийся в них кислород до температуры 200 К. Определить установившееся в сосудах давление.
9.26.В сосуде вместимостью 40 л находится кислород при температуре 300 К. Когда часть газа израсходовали, давление в баллоне понизилось на 100 кПа. Определить массу израсходованного кислорода. Процесс происходит при постоянной температуре.
9.27.В сосуде емкостью 200 см3 находится газ при температуре 47 °С. Из-за утечки газа из колбы просочилось 1,0 ×1021 молекул. На сколько снизилось давление газа в сосуде?
148
9.28.Сосуд объемом 20 л содержит смесь водорода и гелия при температуре 20 °С и давлении 2,0 атм. Масса смеси 5,0 г. Найти отношение массы водорода к массе гелия в смеси.
10.МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ
10.1.Определить среднюю кинетическую энергию вращательного движения одной молекулы двухатомного газа, если суммарная кинетическая энергия молекул одного киломоля этого газа 6,02 МДж.
10.2.Сколько молекул водорода находится в сосуде емкостью 2,0 л, если средняя квадратичная скорость движения молекул 500 м/с, а давление на стенки сосуда 1,0 ×103 Па?
10.3.Найти среднюю кинетическую энергию вращательного движения всех молекул, содержащихся в 0,25 г водорода при температуре 13 °С.
10.4.Давление идеального газа 2,0 мПа, концентрация молекул
2,0 ×1010 см-3. Определить среднюю кинетическую энергию поступательного движения одной молекулы и температуру газа.
10.5.Определить среднее значение полной кинетической энергии одной молекулы неона, кислорода и водяного пара при температуре 690 К.
10.6.Средняя кинетическая энергия поступательного движения каждой молекулы газа равна 5,0 ×10−21 Дж. Концентрация молекул 3,0 ×1019 см-3. Определить давление газа.
10.7.Определить внутреннюю энергию водорода, а также среднюю кинетическую энергию молекулы этого газа при температуре 300 К, если количество вещества этого газа равно
0,50 моль.
10.8.Определить суммарную кинетическую энергию поступательного движения всех молекул газа, находящегося в сосуде вместимостью 3,0 л под давлением 540 кПа.
10.9.Количество вещества гелия 1,5 моль, его температура 120 К. Определить суммарную кинетическую энергию поступательного движения всех молекул этого газа.
149
10.10.Молярная внутренняя энергия некоторого двухатомного газа равна 6,02 кДж/моль. Определить среднюю кинетическую энергию вращательного движения одной молекулы этого газа. Газ считать идеальным.
10.11.Определить среднюю кинетическую энергию одной молекулы водяного пара при температуре 500 К.
10.12.Определить среднюю квадратичную скорость молекулы газа, заключенного в сосуд вместимостью 1,0 л под давлением 200 кПа. Масса газа 0,30 г.
10.13.Водород находится при температуре 300 К. Найти среднюю кинетическую энергию вращательного движения одной молекулы, а также суммарную кинетическую энергию всех молекул этого газа; количество водорода 0,50 моль.
10.14.При какой температуре средняя кинетическая энергия поступательного движения молекулы газа равна 4,14 ×10−21 Дж?
10.15.В азоте взвешены мельчайшие пылинки, которые движутся так, как если бы они были очень крупными молекулами. Масса каждой пылинки равна 6,0 ×10−10 г. Газ находится при температуре 400 К. Определить средние квадратичные скорости, а также средние кинетические энергии поступательного движения молекулы азота и пылинки.
10.16.Определить среднюю кинетическую энергию поступательного движения и вращательного движения молекулы азота при температуре 10 K. Определить полную кинетическую энергию каждой молекулы газа при тех же условиях.
10.17.В сосуде, объем которого 3,0 л, находится кислород при
температуре 17 °С. Давление газа 1,0 ×10−3 мм рт. ст. Опреде-
лить: а) сколько |
молекул кислорода |
имеется в |
сосуде; |
б) внутреннюю энергию газа. |
|
|
|
10.18. При нормальных |
условиях 1,0 л |
газа имеет |
массу |
1,429 ×10−3 кг. Определить: а) плотность газа; б) его молярную массу; в) число молекул в данной массе газа.
10.19.В баллоне емкостью 0,50 л содержится смесь газов, состоящая из 1,0 ×1015 молекул кислорода, 4,0 ×1015 молекул азота
150
