
get_2 физика
.pdfУдельная теплоемкость – физическая величина, определяемая количеством теплоты, необходимым для нагревания 1 кг вещества на 1 К:
c = |
δQ |
. |
(13.7) |
||
|
|
||||
|
mdT |
|
|||
Молярная теплоемкость при постоянном объеме: |
|
||||
CMV = |
i |
R , |
(13.8) |
||
|
|||||
2 |
|
|
|
||
CMV = cV M , |
(13.9) |
||||
где cV – удельная теплоемкость при постоянном объеме.
Молярная теплоемкость при постоянном давлении:
CMp = |
i + 2 |
R , |
(13.10) |
|
|||
2 |
|
|
|
CMp = c p M , |
(13.11) |
||
где c p – удельная теплоемкость при постоянном давлении.
Соотношение между молярными теплоемкостями выражается
уравнением Майера:
CMV + R = CMp , |
|
|
|
(13.12) |
|||
где CMV |
и CMp |
– молярные теплоемкости при постоянном объеме |
|||||
и давлении соответственно. |
|
||||||
Работа расширения (сжатия) газа при изобарном |
|||||||
(p=const) процессе: |
|
|
|||||
A = p(V |
2 |
−V ) = |
m |
R(T − T ), |
(13.13) |
||
|
|||||||
|
|
1 |
M |
2 |
1 |
|
|
|
|
|
|
|
|
|
|
где V1 |
– начальный объем, занимаемый газом, V2 |
– конечный объ- |
|||||
ем, T1 |
– начальная, T2 – конечная температуры. |
|
|||||
Из выражения (13.13) можно выяснить физический смысл универсальной газовой постоянной R :
111
универсальная газовая постоянная численно равна работе изобар- ного расширения 1 моль идеального газа при нагревании его на 1 К.
Работа расширения (сжатия) газа при изотермическом
(T=const) процессе:
A = |
mT |
R ln |
V2 |
= |
mT |
R ln |
p1 |
. |
(13.14) |
|
M |
V |
M |
|
|||||||
|
|
|
|
p |
2 |
|
|
|||
|
|
1 |
|
|
|
|
|
|
||
Отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме для данного идеального газа остается величиной постоянной и называется показателем адиабаты
g = |
C p |
= |
i + 2 |
. |
(13.15) |
|
C |
i |
|||||
|
|
|
|
|||
|
V |
|
|
|
|
Адиабатный процесс – процесс, который происходит без теплообмена с окружающей средой ( δQ = 0 ). Это может быть реали-
зовано либо теплоизоляцией системы от внешней среды, либо быстрым протеканием процесса, когда нетеплоизолированная система за время процесса не успевает обменяться теплотой с окружающими ее телами (рис. 2.5).
Используя определение работы в термодинамике, можно найти
работу расширения (сжатия) газа при адиабатном процессе:
|
|
é |
æ |
|
ö |
γ−1 |
ù |
|
||
|
m |
|
RT1 ê |
|
|
ú |
|
|||
A = |
|
ç V1 |
÷ |
|
|
|||||
|
|
|
1 |
- ç |
|
÷ |
|
. |
||
M |
|
|
|
ú |
||||||
|
|
(g -1)ê |
èV2 |
ø |
|
|
||||
|
|
ë |
|
|
|
|
û |
|
||
Сам адиабатный процесс описывается
впараметрах (p,V ): pV γ = const ,
впараметрах (T ,V ): TV γ−1 = const ,
впараметрах (p,T ): Tp(1−γ ) γ = const .
γ = const .
(13.16)
уравнением Пуассона: (13.17) (13.18) (13.19)
В координатах (p,V ) адиабата представляет собой гиперболу, которая является более крутой, чем изотерма (рис. 2.5), т.к. γ >1,0 .
112

Рис. 2.5
14. ТЕПЛОВЫЕ МАШИНЫ
Процесс, при котором система, пройдя через ряд промежуточных состояний, возвращается в первоначальное, называется круговым процессом (циклом). Одним из примеров кругового процесса является цикл Карно, состоящий из двух изотерм и двух адиабат
(рис. 2.6).
Если за цикл работа, совершаемая газом, положительная ( A > 0 ), то цикл называется прямым, если отрицательная ( A < 0 ) – об-
ратным.
Рис. 2.6
Коэффициент полезного действия (КПД) цикла представ-
ляет собой отношение совершенной полезной работы A к количе-
113
ству теплоты Q , полученному за цикл от нагревателя:
η = |
|
A |
. |
|
|
|
(14.1) |
|
|
|
|
|
|||
|
|
Q |
|
|
|
|
|
КПД теплового двигателя определяется из выражения: |
|||||||
η = |
Q − Q0 |
, |
|
|
(14.2) |
||
|
|||||||
|
|
|
Q |
|
|
|
|
а КПД цикла Карно: |
|
||||||
η = |
Q − Q0 |
= |
T − T0 |
, |
(14.3) |
||
|
|
||||||
|
|
|
Q |
|
T |
|
|
где Q – количество теплоты, полученное рабочим телом от нагре- |
|||||||
вателя, Q0 |
– количество теплоты, отданное рабочим телом холо- |
||||||
дильнику, |
T – температура нагревателя, T0 |
– температура холо- |
|||||
дильника. |
|
|
|
|
|||
Из приведенного выражения очевидно, что КПД тепловой машины не может быть большим 1,0 (100 %).
Теорема Карно: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей и холо- дильников, наибольшим КПД обладают обратимые машины, ра- ботающие по циклу Карно; КПД обратимых машин, работающих при одинаковых температурах нагревателя и холодильника, оди- наковы и не зависят от природы рабочего тела (тела, совершаю- щего круговой процесс).
15. ЭНТРОПИЯ
Обратимый процесс – процесс, который может происходить как в прямом, так и обратном направлениях, причем в окружающей среде не происходит никаких изменений.
Любой другой процесс, не соответствующий данным требованиям, является необратимым. Все реальные процессы необратимые. Обратимые процессы – лишь идеализация реальных процессов.
114

Отношение количества теплоты δQ , полученной телом в изотер-
мическом процессе, к температуре теплоотдающего тела T назы-
вается приведенной теплотой:
δQ |
. |
(15.1) |
|
||
T |
|
|
В любом круговом обратимом процессе приведенная теплота (интеграл по замкнутому контуру) равна нулю:
ò |
δQ |
= 0 . |
(15.2) |
T |
Энтропия – функция состояния системы, изменение которой не зависит от пути, по которому система пришла в это состояние, определяется лишь параметрами начального и конечного состояний:
S = |
Q |
. |
(15.3) |
|
|||
|
T |
|
|
Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2:
2 |
δQ |
(15.4) |
S = ò |
T |
|
1 |
|
и не зависит от вида процесса перехода. Физический смысл имеет не сама энтропия, а ее изменение.
Поскольку для адиабатного процесса |
Q = 0 , то он является изо- |
энтропийным, т.е. протекающим |
при постоянной энтропии |
S = const . |
|
Первое начало термодинамики выражает закон сохранения и превращения энергии, но не позволяет установить направление протекающих процессов.
Второе начало термодинамики определяет направление про-
текания термодинамических процессов, указывая при этом, какие процессы возможны в природе, а какие – нет:
115
по Клаузиусу: невозможен круговой процесс, единственным ре- зультатом которого является передача теплоты от менее на- гретого тела к более нагретому;
по Кельвину: невозможен круговой процесс, единственным ре- зультатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу.
Энтропия в замкнутой системе может либо возрастать (для необратимых процессов), либо оставаться постоянной (для обратимых процессов) – неравенство Клаузиуса:
DS ³ 0 . |
(15.5) |
16. РЕАЛЬНЫЕ ГАЗЫ
В модели реальных газов (газов в широком диапазоне плотностей), в отличие от идеальных, необходимо учитывать как собственный объем молекул, так и силы взаимодействия на расстоянии между молекулами.
Для описания состояния реального газа существует несколько соотношений. Наиболее простую форму имеет уравнение Ван-
дер-Ваальса:
æ |
|
|
m2 |
a |
öæ |
m |
ö |
|
m |
|
|
|||
ç p |
+ |
|
|
|
|
|
|
֍V - |
|
b÷ |
= |
|
RT , |
(16.1) |
|
|
2 |
|
|
2 |
|
|
|||||||
ç |
|
|
M |
|
V |
÷ |
M |
ø |
|
M |
|
|
||
è |
|
|
|
|
|
øè |
|
|
|
|||||
где a |
и b – постоянные Ван-дер-Ваальса, определяемые для каж- |
|||||||||||||
дого газа. |
|
|
|
|
|
|
|
|
|
|||||
При наложении условий идеальности газа уравнение Ван-дер- Ваальса преобразуется в известное уравнение состояния идеального газа Менделеева-Клапейрона.
Состояние, в котором теряется различие между жидким и газообразным состоянием вещества, называется критическим и может быть описано соответствующими термодинамическими параметрами, которые также называются критическими. Для каждого ре-
116
ального газа критические параметры имеют определенное значение и выражаются через постоянные Ван-дер-Ваальса:
p |
|
= |
a |
, T |
= |
8a |
, V |
μкр |
= 3b (для одного моля). |
(16.2) |
|
27b2 |
27bR |
||||||||
|
кр |
|
кр |
|
|
|
|
Для реальных газов собственный объем молекулы определяется ее эффективным диаметром d :
V = |
b |
= |
πd |
3 |
. |
(16.3) |
|
|
|
||||
0 |
4N A |
|
6 |
|
|
|
|
|
|
|
|
17. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Если имеется граница раздела жидкого и газообразного вещества, то следует говорить о поверхностных явлениях в жидкости, которые обусловлены стремлением уменьшить свою свободную поверхность.
Для увеличения площади поверхности жидкости необходимо приложить некоторую силу и совершить работу.
Коэффициентом поверхностного натяжения называется отношение работы A , совершаемой при постоянной температуре, необходимой для увеличения поверхности жидкости, к величине
изменения ее площади |
S : |
||
σ = |
A |
. |
(17.1) |
|
|||
|
S |
|
|
Совершенная работа равна изменению поверхностной энергии.
Коэффициент поверхностного натяжения можно также определить как отношение силы поверхностного натяжения F , действующей вдоль контура, ограничивающего поверхность, к длине контура l :
σ = |
F |
. |
(17.2) |
|
|||
|
l |
|
|
|
|
|
117 |
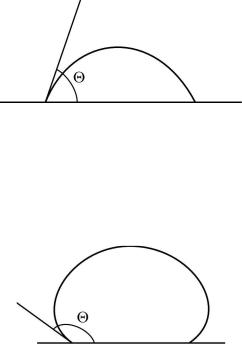
При соприкосновении жидкости с поверхностью твердого тела возникает искривление ее свободной поверхности.
Краевой угол смачивания ( Θ ) – угол между касательными к поверхности жидкости и твердого тела, отсчитываемый внутри жидкости (рис. 2.7 и 2.8).
Рис. 2.7
В случае, когда краевой угол острый ( Q < 90o ), имеем смачива-
ние (рис. 2.7), тупой ( 90o < Q < 180o ) – несмачивание (рис. 2.8).
При полном смачивании Θ = 0 ; при полном несмачивании
Q =180o .
Рис. 2.8
В случае искривления поверхности жидкости возникает избыточное давление, которое описывается формулой Лапласа:
æ |
1 |
|
1 |
ö |
|
|
||
ç |
+ |
÷ |
, |
(17.3) |
||||
|
R |
|
||||||
Dp = sç R |
|
÷ |
||||||
è |
1 |
|
|
2 |
ø |
|
|
|
где R1 и R2 – радиусы кривизны двух взаимно перпендикулярных сечений поверхности жидкости в рассматриваемой точке. Радиус
118
кривизны считается положительным, если центр кривизны находится внутри жидкости, и отрицательным, если вне жидкости.
Избыточное давление под сферической поверхностью жидкости обратно пропорционально радиусу ее кривизны:
p = |
2σ |
. |
(17.4) |
|
|||
|
R |
|
|
Капилляры (капиллярные трубки) – узкие цилиндрические трубки (диаметром d ≤ 1мм в условиях земного притяжения). В капиллярах жидкость за счет сил поверхностного натяжения может подниматься на некоторую высоту.
Высота подъема жидкости в капиллярной трубке зависит от ее радиуса R , плотности жидкости ρ , коэффициента поверхно-
стного натяжения σ и краевого угла смачивания Θ :
h = |
2σcosΘ |
, |
(17.5) |
|
ρgR |
||||
|
|
|
где g – ускорение свободного падения.
119

ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. В сосуде объемом 2,0 м3 находится смесь 4,0 кг гелия и 2,0 кг водорода при температуре 27 °С. Определить давление и молярную массу смеси газов.
Дано:
V = 2,0 м3, m1 = 4,0 кг,
M1 = 4,0 ×10−3 кг/моль, m2 = 2,0 кг,
M 2 = 2,0 ×10−3 кг/моль,
T = 300 К.
Найти: p , M .
Решение. Воспользуемся уравнением Менделеева – Клапей-
рона [9.3]:
p1V = Mm1 RT , (1)
1
p2V = Mm2 RT , (2)
2
где p1 – парциальное давление гелия; m1 – масса гелия; M1 – его молярная масса; V – объем сосуда; T – температура газа; R – универсальная газовая постоянная; p2 – парциальное давление водорода; m2 – масса водорода; M 2 – его молярная масса.
Под парциальным давлением понимается давление, которое производил бы газ, если бы только он один находился в сосуде. По закону Дальтона [9.4] давление смеси равно сумме парциальных давлений газов, входящих в состав смеси:
p = p1 + p2 . |
(3) |
Из выражений (1) и (2) определим p1 и p2 и подставим в (3):
120
