
- •А.С. Бадаев а.В. Чернышов
- •1. Микроэллектронные структуры и их строение
- •1.1. Виды химической связи
- •1.2. Основные свойства материалов, определяемые особенностями химических связей.
- •1.3.1. Кристаллические тела
- •1.3.3. Структура аморфных твердых тел
- •1.3.4. Структура тонких металлических пленок
- •1.3.5. Перспективные углеродные структуры
- •1.3.6. Проблема атомных радиусов
- •2. Механические свойства твердых тел
- •2.1. Деформация и механическое напряжение. Закон Гука.
- •2.2. Пластическая деформация кристаллов
- •2.3. Прочность и разрушение твердых тел
- •3. Тепловые свойства твердых тел
- •3.1. Нормальные колебания кристаллической решетки
- •3.1.1. Колебания в одномерной решетке
- •3.1.2. Колебания трехмерной кристаллической решетки
- •3.1.3. Энергия нормальных колебаний. Фононы
- •3.2. Теплоемкость твердого тела
- •3.3. Тепловое расширение твердых тел
- •3.4. Теплопроводность твердых тел
- •3.5. Диффузия в твердых телах
- •4. Основы зонной теории твердых тел
- •4.1. Волновые свойства электронов
- •4.2. Энергетические уровни электрона в изолированном атоме
- •4.3. Энергетический спектр электронов в кристалле
- •4.4. Эффективная масса электрона
- •4.5. Заполнение зон электронами у металлов, диэлектриков и полупроводников
- •5. Физические свойства диэлектриков
- •5.1. Диэлектрическая проницаемость и виды поляризации диэлектриков
- •5.2. Электропроводность диэлектриков
- •5.3. Диэлектрические потери
- •5.4. Электрическая прочность
- •5.5. Сегнетоэлектрики
- •5.6. Пьезоэлектрики
- •5.7. Электреты
- •6. Магнитные свойства твердых тел
- •6.1. Классификация твердых тел по магнитным свойствам
- •6.2. Природа ферромагнитизма
- •6.3. Процессы при намагничивании ферромагнетиков
- •6.4. Поведение ферромагнетиков в переменных магнитных полях
- •6.5. Ферриты
- •6.6. Тонкие магнитные пленки
- •6.7. Магнитный резонанс
- •Часть I
- •394026 Воронеж, Московский просп., 14
4. Основы зонной теории твердых тел
Понимание физических явлений, происходящих в твердых телах, невозможно без знания основных положений зонной теории твердого тела. Зонная теория твердого тела – это теория валентных электронов, движущихся в периодическом потенциальном поле кристаллической решетки.
4.1. Волновые свойства электронов
Микрочастицы – электроны, протоны, атомы и т.д. подобно свету сочетают в себе корпускулярные и волновые свойства. Микрочастице, обладающей энергией Е и импульсом Р, должна соответствовать волна с частотой
![]() , (4.1)
, (4.1)
и длиной
![]() , (4.2)
, (4.2)
где
h
– постоянная Планка;
![]() - скорость движения частиц;m
– масса частицы.
- скорость движения частиц;m
– масса частицы.
Эти волны называют волнами де Бройля.
Волновые процессы описываются волновыми уравнениями. Для электрона, движущегося в силовом поле и обладающего потенциальной энергией U(х,y,z,t), волновое уравнение Шредингера имеет вид:
![]() . (4.3)
. (4.3)
Функция
![]() ,
являющаяся решением этого уравнения,
называется волновой функцией.
,
являющаяся решением этого уравнения,
называется волновой функцией.
Уравнение
(4.3) удовлетворяется только комплексными
волновыми функциями, поэтому физический
смысл имеет не функция![]() ,
а произведение
,
а произведение![]() на функцию
на функцию![]() *,
комплексно сопряженную с
*,
комплексно сопряженную с![]() .
Это произведение пропорционально
вероятности
.
Это произведение пропорционально
вероятности![]() нахождения электрона в объемеdV
в момент времени t:
нахождения электрона в объемеdV
в момент времени t:
![]() . (4.4)
. (4.4)
Отсюда
следует, что
![]() должна быть непрерывной и конечной во
всех точках пространства.
должна быть непрерывной и конечной во
всех точках пространства.
Волновая функция является нормированной:
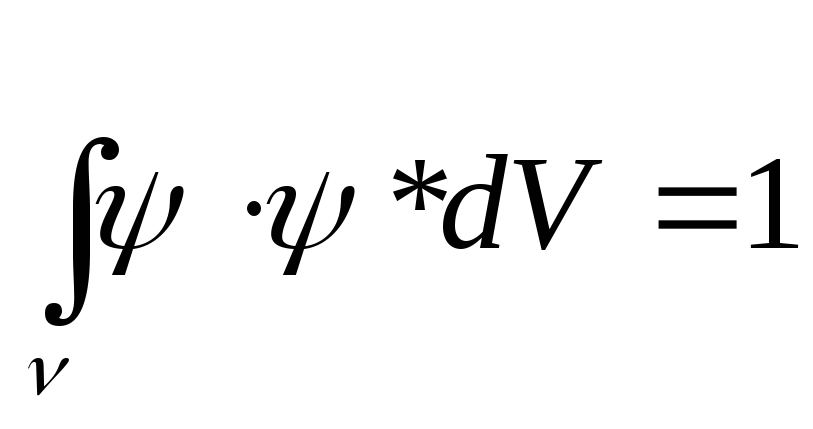 (4.5)
(4.5)
Выражение (4.5) выражает достоверный факт, что электрон находится в этом пространстве (во всем объеме V).
Для одномерного случая уравнение (4.3) принимает следующий вид:
![]() . (4.6)
. (4.6)
Во многих случаях U является только функцией координат и не зависит от времени, тогда
![]() . (4.7)
. (4.7)
Подставив
(4.7) в (4.6) и разделив на
![]() ,
получим:
,
получим:
![]() . (4.8)
. (4.8)
Поскольку левая и правая части (4.8) содержат разные переменные, они могут быть равны только в том случае, если каждая из них равна одной и той же постоянной. Можно показать, что эта постоянная равна Е – полной энергии электрона.
Приравниваем обе части (4.8) Е, после преобразования получим
![]() , (4.9)
, (4.9)
![]() . (4.10)
. (4.10)
Решением уравнения (4.10) является
![]() . (4.11)
. (4.11)
Решение полного уравнения Шреденгера может быть представлено в виде:
![]() , (4.12)
, (4.12)
где
![]() .
.
В трехмерном случае:
![]() . (4.13)
. (4.13)
В этом случае вероятность обнаружения электрона в объеме dV, равная
![]() (4.14)
(4.14)
не зависит от времени. Состояние электрона, удовлетворяющее этому условию называется стационарным.
4.2. Энергетические уровни электрона в изолированном атоме
Нахождение стационарных состояний является очень важной задачей, поскольку любое другое состояние в том числе нестационарное, может быть представлено в виде суперпозиции стационарных функций. Решение уравнения Шреденгера получено лишь для некоторых простых систем, в частности для атома водорода.
Согласно модели Резерфорда-Бора электроны в атоме вращаются вокруг ядра по четко определенным круговым и эллиптическим орбиталям (рис 4.1)
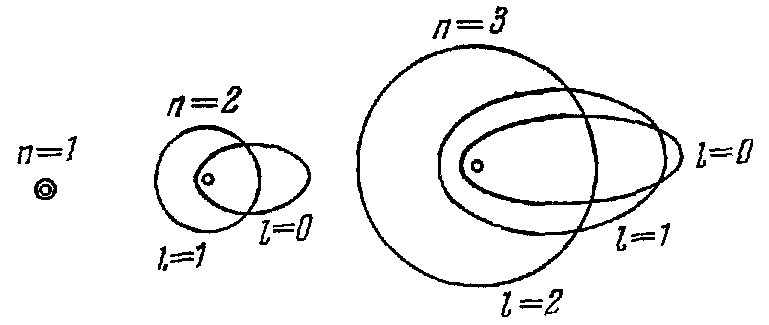
Рис.4.1. Возможные орбиты электрона в атоме водорода для различных квантовых чисел
Эти орбитали называются стационарными.
Определенным стационарным орбитам электронов (стационарным состоянием атома) соответствует определенные значения энергии (дискретные уровни энергии). Уровни энергии Еn и радиусы rn определяются по формулам
![]() , (4.15)
, (4.15)
![]() , (4.16)
, (4.16)
где
me
– масса электрона; е – заряд электрона;
![]() - диэлектрическая постоянная,h
– постоянная Планка; n=1,2,3,….
- диэлектрическая постоянная,h
– постоянная Планка; n=1,2,3,….
С точки зрения квантовой механики, электронных орбит не существуют; имеется «электронное облако», которое называют орбиталью и рассчитывается лишь вероятность того, что электрон находится на определенном расстоянии от ядра. Движение электрона по круговой орбите соответствует сферическому электронному облаку, а движение по эллиптической орбите – облаку в форме гантели. Однако понятие о дискретных уровнях энергии атома остается в силе.
Состояние электрона в атоме определяется четырьмя квантовыми числами: главным n, орбитальным l, магнитным m1 и спиновым s. Для атома водорода главное квантовое число определяет энергию атома в стационарном состоянии Е(n) (радиус круговой орбиты или большую полуось эллиптической) (4.15). Оно может принимать значения n=1,2,3 и т.д. Состояние электрона, определяемое главным квантовым числом, называют энергетическими уровнями.
Орбитальное квантовое число t определяет орбитальный момент количества движения электрона рl (малую полуось эллиптической орбиты):
![]() (4.17)
(4.17)
(![]() ,
гдеh
– постоянная Планка). Квантовое число
l
может принимать лишь следующий ряд
значений:
,
гдеh
– постоянная Планка). Квантовое число
l
может принимать лишь следующий ряд
значений:
![]() ;
;
всего n значений. Значение l=0 соответствует круговой орбите.
Магнитное квантовое число определяет ориентацию орбитального момента количества движения рm относительно избранного направления (пространственную ориентацию элептической орбиты. Вектор рm может ориентироваться относительно выбранного направления лишь так, что его проекция на это направление кратна ћ:
![]() , (4.18)
, (4.18)
где m=0, ±1, ±2,…,±l; всего 2l+1 значений. Каждому квантовому числу l соответствует (2l+1)по –разному ориентированных орбит.
Спиновое квантовое число определяет ориентацию собственного момента количества движения электрона (спина рs) относительно направления. Вектор рs может ориентироваться относительно выбранного направления лишь так, что его проекция равна
![]() . (4.19)
. (4.19)
При
этом s
может принимать лишь два значения
![]() и
и![]() .
.
Вектор собственного момента количества движения может быть параллелен или антипараллелен вектору орбитального момента.
Состояния, для которых орбитальное квантовое число l=0 при любых значениях других квантовых чисел, называются s-состояниями; состояния с l=1 называются р-состояниями, с l=2 – d-состояниями, с l=3 – f-состояниями и т.д. Электроны, находящиеся в этих состояниях, называются соответственно s-,p-,d-,f- и т.д. электронами.
В отличие от атома водорода энергия электрона в многоэллектронных атомах зависит не только от n, но и от l, а также от полного момента j, являющегося результатом векторного сложения Рl и Рs. В соответствии с тем, что n,l,j могут принимать лишь дискретные значения, энергетический спектр электронов в изолированном атоме является также дискретным: он состоит из ряда разрешенных уровней Е(n,l,j), разделенных интервалами запрещенных энергий (рис.4.2).
Рассмотрим число возможных энергетических состояний на энергетических уровнях атома.
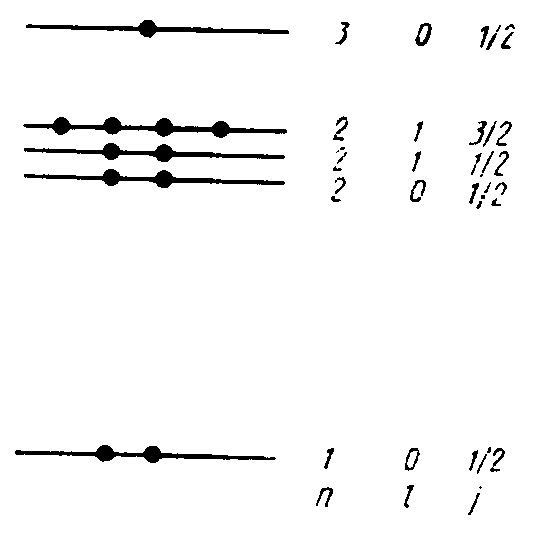
Рис. 4.2. Схема энергетических уровней атома Na
Все уровни s являются невырожденными. Это означает, что каждому из них отвечает единственное состояние электрона в атоме. В соответствии с принципом Паули в таком состоянии могут находиться два электрона, отличающиеся друг от друга направлением своих спинов.
Уровни р являются трехкратно вырожденными каждому из них отвечает не одно, а три состояния, которые отличаются друг от друга магнитным квантовым числом ml. При l=1 оно может принимать следующие три значения. ml=-1,0,+1. Так как в каждом состоянии может находиться два электрона, то для полного комплектования уровня р требуется 6 электронов.
Уровни d имеют пятикратное вырождение, так как при l=2 магнитное квантовое число ml=-2,-1,0,+1,+2. На этом уровне может разместиться 10 электронов.
В общем случае уровень с орбитальным квантовым числом l имеет (2l+1)-кратное вырождение и на нем может разместиться 2(2l+1) электронов.
