
- •Е.А. Михайлов, ю. С. Кашенков, а. Г. Маланов
- •Введение
- •1. Основные проблемы выбора методов водоподготовки
- •1.1. Основные виды водозабора для энергетических предприятий коммунального хозяйства
- •1.2. Выбор методов химводоподготовки
- •1.3. Влияние эффективности химводоподготовки на технико-экономические показатели работы оборудования
- •Отложений солей жесткости
- •1.4. Контроль процессов водоподготовки на коммунальных теплоэнергетических объектах области
- •1.5. Современное состояние развития систем химводоподготовки и подготовка инженерных кадров для этих целей
- •1.6. Требования мчс рф, Минздрава рф, Минэкологии рф и органов гтн к системам химводоподготовки
- •2. Основные загрязняющие компоненты природных вод и их влияние на процессы в теплоэнергетике
- •2.1. Неорганические вещества
- •2.1.1. Кислород
- •2.1.2. Кальций
- •2.1.3. Магний
- •2.1.4. Кремний
- •2.1.5. Углерод
- •2.1.6. Азот общий
- •2.1.7. Фосфор общий
- •2.1.8. Сера
- •2.1.9. Натрий
- •2.1.10. Калий
- •2.1.11. Фтор
- •2.1.12. Хлор
- •2.1.13. Бром
- •2.1.16. Цианиды
- •2.1.17. Роданиды (тиоцианаты)
- •2.1.18. Стронций
- •2.1.19. Алюминий
- •2.1.20. Титан
- •2.2. Органические вещества
- •0,1 Мг/дм3 - для остальных участков водоемов.
- •2.3. Общие показатели качества вод
- •2.4. Тяжелые металлы
- •3. Проблемы подготовки воды к процессам тепломассообмена
- •3.1.1. Умягчение
- •3.1.2. Обезжелезивание
- •3.1.3. Стабилизационная обработка воды
- •3.1.4. Очистка воды от растворенных газов
- •3.1.4.1. Деаэрация
- •3.1.4.2. Декарбонизация
- •Насадочного декарбонизатора:
- •От концентрации углекислоты в воде до декарбонизатора при концентрации со2 в декарбонизованной воде 3 (1), 5 (2) и 10 (3) мг/л соответственно
- •Десорбции от температуры, обрабатываемой воды
- •4. Современные конструкции аппаратов для проведения процессов водоподготовки
- •4.1. Аппараты для умягчения воды
- •1) Фильтры "фип".
- •2) Автоматизированные аппараты дозирования химических реагентов типа «Комплексон».
- •2) Автоматизированные аппараты дозирования химических реагентов типа «Комплексон»
- •Водоподготовительного оборудования
- •3) Оборудование для дозирования реагентов фирмы ооо "Аркон-хим", г. Москва.
- •4) Антинакипной электрохимический аппарат марки аэа-т, изготовитель - оао "Азов".
- •Электрохимических аппаратов марки аэа-т оао "Азов"
- •5) Аппарат нехимической водоподготовки фирмы aquatech (Словакия).
- •6) Электронный преобразователь солей жесткости «Термит»
- •7) Приборы «Water King»
- •8) Современное оборудование и технологии очистки воды фирмы "Национальные водные ресурсы"
- •Модели «Соло» серии аква
- •Серии «Нептун»
- •Серии 5р-малогабаритные
- •Серии 8р – производственные
- •Серии 3р-а
- •4.2. Аппараты для процессов декарбонизации
- •4.3. Аппараты для процессов деаэрации
- •5. Учет тепла в коммунальной энергетике
- •5.1. Актуальность реконструкции приборов учета
- •5.2. Требования к приборам учета тепловой энергии на источнике теплоты
- •5.3. Обзор приборов учета тепла
- •5.3.1. Элементы, определяющие метрологические характеристики теплосчетчика на трубопроводах больших диаметров
- •5.3.2. Методы измерений, положенные в основу работы расходомеров, их достоинства и недостатки
- •5.4. Анализ характеристик расходомеров на основе результатов их практического использования
- •5.4.1. Сложность монтажа
- •5.4.2. Сложность проведения монтажа в условиях пуско-наладочных работ
- •5.4.3. Надежность работы расходомеров
- •5.4.4. Точность измерений
- •5.4.5. Возможность измерения расхода в случае реверса теплоносителя
- •Заключение
- •Библиографический список
- •Оглавление
- •Методы подготовки питательной воды котлов
3.1.4. Очистка воды от растворенных газов
Удаление из воды растворенных газов – важная часть комплексного технологического процесса обработки воды, реализуемого на ТЭС и АЭС.
Необходимость этого процесса, вызвана стремлением уменьшить интенсивность коррозии внутренних поверхностей теплосилового оборудования под действием растворенных, в теплоносителе агрессивных газов.
Кроме того, наличие в воде растворенной углекислоты отрицательно сказывается на эффективности работы анионитных фильтров, установленных в схеме очистки добавочной воды.
Один из основных потоков, подвергаемых дегазации, – питательная вода котлов. Однако растворенные газы удаляют и из потоков, не являющихся непосредственно рабочим телом. Такими потоками являются химически очищенная вода, подпиточная вода тепловых сетей, конденсат пара, возвращаемый в тепловой цикл станции от внешних потребителей, охлаждающая вода конденсаторов турбин.
Кислород О2 и диоксид углерода СО2 присутствуют в воде в результате растворения при контакте воды с атмосферным воздухом. Углекислота появляется в воде также в процессе химического обессоливания после стадии Н+-катионирования, а при умягчении воды методами Na+- и Н+-катионирования вода дополнительно насыщается связанным диоксидом углерода.
Азот – инертный газ, его наличие в воде обусловлено контактом воды с атмосферным воздухом, появление водорода Н2 в воде – коррозией внутренних поверхностей теплосилового оборудования.
Аммиак NН3 попадает в воду главным образом в результате аминирования питательной воды и, кроме того, присутствует в химически очищенной воде, если в схеме подготовки воды установлены NН4-катионит-ные фильтры.
Такие газы, как сернистый ангидрид SO2 и сероводород H2S, могут присутствовать в теплоносителе при использовании на станции котлов среднего давления и обработке питательной воды сульфитом натрия.
Наиболее эффективный способ удаления растворенных газов из воды – десорбция. Этот способ основан на известном законе Генри - Дальтона, характеризующих зависимость между концентрацией в воде растворенного газа и его парциальным давлением.
Применение этих законов дает возможность определить концентрацию газа при том условии, что в паровом пространстве над водой находится лишь рассматриваемый газ и отсутствуют другие газы. Концентрация растворенного в воде газа выражается уравнением
Сг = Кгpг = Кг (pобщ – рH20), (3.1)
где Сг – концентрация растворенного в воде газа;
Кг - коэффициент абсорбции газа водой;
Робщ – общее давление;
рH20 – парциальное давление водяного пара;
рг – парциальное давление газа.
Как видно из уравнения (3.1), понижение концентрации газа в воде происходит с уменьшением разности pобщ – рH20, т.е. в случае приближения парциального давления водяных паров к значению полного давления газовой смеси.
Это достигается созданием над поверхностью воды, содержащей рассматриваемый газ, смеси газов, в составе которой практически отсутствует удаляемый из воды газ.
Таким образом, для удаления газа из воды необходимо создать условия, при которых парциальное давление его над поверхностью воды было бы равно нулю.
Удаление газа из воды существенно зависит от кинетики десорбции, которая может быть выражена уравнением
dCг/dτ = - (Сг - Сpг) kf , (3.2)
где dCг/dτ – скорость десорбции;
Сг – концентрация удаляемого газа;
Сpг – равновесная концентрация газа;
k – коэффициент пропорциональности;
f – удельная поверхность раздела фаз.
Наибольший эффект достигается при Сpг = 0, т. е. при парциальном давлении удаляемого газа, близком к нулю.
В этом случае уравнение (3.2) преобразуется к виду
dCг/dτ = - Сг kf. (3.3)
При постоянных k и f для данного аппарата концентрация газа в воде зависит только от времени дегазации, с увеличением времени дегазации концентрация растворенного газа в воде уменьшается.
Полного освобождения воды от растворенного газа в какой-либо реальный отрезок времени достичь невозможно, поэтому время, необходимое для дегазации, находят, задаваясь определенной конечной концентрацией растворенного в воде газа.
Эффект дегазации можно повысить, увеличив удельную поверхность раздела фаз пара и воды. В этом случае при прочих равных условиях увеличивается время контакта воды с паром, не содержащим удаляемого из воды газа.
На эффект дегазации существенно влияет повышение температуры воды, это обусловлено тем, что с повышением температуры уменьшается коэффициент абсорбции газа водой. На рис. 2 показана зависимость коэффициента абсорбции от температуры для кислорода, углекислоты и азота.
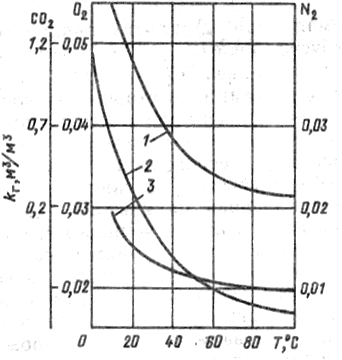
Рис. 2. Коэффициенты абсорбции СО2 (1), N2 (2) и О2 (3) водой
