
- •Для студентов фармацевтического факультета
- •Введение
- •Требования техники безопасности при работе в химической лаборатории
- •Меры оказания первой помощи при несчастных случаях
- •Методические рекомендации по выполнению и оформлению лабораторных работ
- •Отчет должен содержать следующие сведения:
- •Свойства основных классов неорганических соединений.
- •Определение молекулярной массы эквивалента металла.
- •Приготовление раствора заданной концентрации.
- •Определение теплового эффекта реакции нейтрализации.
- •Кинетика химических реакций, качественные опыты по химическому равновесию.
- •Гетерогенные равновесия и процессы. Произведение растворимости (пр), условия образования и растворения осадков.
- •Гидролиз. Смещение равновесия в реакциях гидролиза.
- •Учебно-исследовательский комплекс (уирс)
- •Окислительно-восстановительные реакции (овр)
- •Получение, состав и свойства комплексных соединений
- •Водород, вода, пероксид водорода.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Свойства элементов Iв группы: Cu, Ag, Au.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Элементы Vа группы периодической системы и свойства их соединений. Азот и фосфор. Мышьяк, сурьма и висмут.
- •Учебно-исследовательский комплекс (уирс)
- •Элементы vIа группы периодической системы и свойства их соединений. Сера.
- •Элементы viIа группы периодической системы. Галогены и свойства их соединений.
- •Учебно-исследовательский комплекс (уирс)
- •Приложение 1 лабораторная техника
- •Образец оформления титульного листа
- •Литература
- •Содержание
Приготовление раствора заданной концентрации.
Значение темы: в практической деятельности провизор использует и готовит растворы различной концентрации, а также производит пересчет одного способа выражения концентрации в другой.
Цель: ознакомиться со способами количественного выражения состава растворов, методиками расчета, приготовления и определения их состава, научиться правильно обращаться с мерной посудой, рефрактометром, ареометром.
Опыт 1.
Приготовьте 250 мл 9,4% раствора хлорида натрия из 7,5% и 22,5% растворов той же соли. По таблице найдите значения относительных плотностей всех трех растворов и рассчитайте их объемы, необходимые для приготовления заданного раствора по правилу «креста».
Отмерив рассчитанные объемы растворов, слейте их и, тщательно перемешав, определите массовую долю полученного раствора рефрактометрическим методом.
Рефрактометр (ознакомьтесь с инструкцией к прибору) используется для измерения показателя преломления луча, проходящего через раствор. Прибор состоит из серии призм, главной из которых является рефрактометрическая (измерительная). Она находится в футляре. Сверху – горизонтально расположенная измерительная плоскость, на которую наносят 3-4 капли исследуемого раствора. Закрывают измерительную призму подвижной призмой, функция которой – пропускать пучок лучей через окошко. Поток лучей попадает на раствор, преломляется, проходит через серию призм и фокусируется на объективе.
Смотрим через окуляр, в поле зрения видим шкалу и две пересекающиеся линии (Рис.2.).
Рис. 2. Рефрактометрическое
определение концентрации раствора.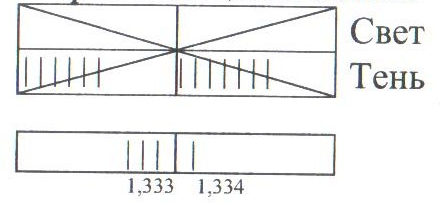
Для растворов граничная линия (между тенью и светом) смещается. Левым винтом – тумблером выводим границу света – тени на точку пересечения и измеряем по шкале показатель преломления D. Затем по кривой на графике «D-ɷ» определяем концентрацию раствора (ɷ).
D – показатель преломления для дистиллированной воды, равен 1,333.
Опыт 2.
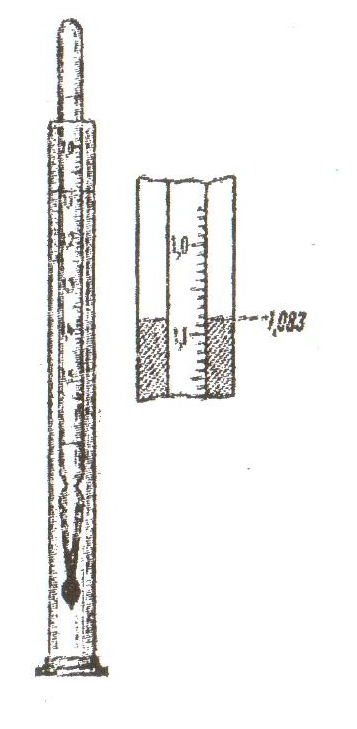
Приготовьте 250 мл раствора заданной концентрации из исходного раствора (вещества) и воды. Определите концентрацию полученного раствора с помощью ареометра. Ареометр – прибор для определения плотности раствора. А между плотностью раствора и концентрацией растворенного вещества существует непосредственная связь.
В цилиндр наливаем приготовленный раствор, осторожно опускаем в него ареометр (рис. 3).
Отмечаем по шкале ареометра его показание. Во время наблюдения ареометр не должен касаться стенок цилиндра. Приподняв на 1-2 см ареометр, вновь опустите его в раствор и еще раз определите показание. По таблице 2 определяем массовую долю исследуемого раствора. Если в таблице относительная плотность 1,083 для данного раствора отсутствует, но указаны величины: меньшая 1,076 и большая 1,090, тогда процентную концентрацию находим интерполяцией – определением промежуточной величины по двум крайним. Для этого производят следующие расчеты:
Рис. 3. Измерение плотности раствора ареометром
Находят разность величин относительных плотностей и концентраций растворов по табличным данным 1,090 – 14%
1,076 – 12%
0,014 – 2%
Находят разность между величиной, определенной ареометром, и меньшей табличной 1,083 – 1,076 = 0,007
Составляют пропорцию: 0,014 – 2%
0,007
- Х%

Найденное число прибавляют к меньшей величине концентрации, взятой из таблицы: 12% + 1% = 13% - это отвечает концентрации исследуемого раствора.
Проведите расчеты с данными, полученными при испытании вашего раствора.
Таблица 2
Зависимость массовой доли ɷ растворенных веществ от плотности ρ раствора (Т=293 К)
|
ɷ, % |
ρ, г/см3 | ||||
|
H2SO4 |
HNO3 |
HCl |
KOH |
NaOH | |
|
2 |
1,013 |
1,011 |
1,009 |
1,016 |
1,013 |
|
4 |
1,027 |
1,022 |
1,019 |
1,033 |
1,046 |
|
6 |
1,040 |
1,033 |
1,029 |
1,043 |
1,069 |
|
8 |
1,055 |
1,044 |
1,039 |
1,065 |
1,092 |
|
10 |
1,069 |
1,056 |
1,049 |
1,082 |
1,115 |
|
12 |
1,083 |
1,068 |
1,059 |
1,100 |
1,137 |
|
14 |
1,098 |
1,080 |
1,069 |
1,118 |
1,159 |
|
16 |
1,112 |
1,093 |
1,079 |
1,137 |
1,181 |
|
18 |
1,127 |
1,106 |
1,083 |
1,156 |
1,213 |
|
20 |
1,143 |
1,119 |
1,100 |
1,176 |
1,225 |
|
22 |
1,158 |
1,132 |
1,110 |
1,196 |
1,247 |
|
24 |
1,174 |
1,145 |
1,121 |
1,217 |
1,268 |
|
26 |
1,190 |
1,158 |
1,132 |
1,240 |
1,289 |
|
28 |
1,205 |
1,171 |
1,142 |
1,263 |
1,310 |
|
30 |
1,224 |
1,184 |
1,152 |
1,286 |
1,332 |
|
32 |
1,238 |
1,198 |
1,163 |
1,310 |
1,352 |
|
34 |
1,255 |
1,211 |
1,173 |
1,334 |
1,374 |
|
36 |
1,273 |
1,225 |
1,183 |
1,358 |
1,395 |
|
38 |
1,290 |
1,238 |
1,194 |
1,384 |
1,416 |
|
40 |
1,307 |
1,251 |
|
1,411 |
1,437 |
|
42 |
1,324 |
1,264 |
|
1,437 |
1,458 |
|
44 |
1,342 |
1,277 |
|
1,460 |
1,478 |
|
46 |
1,361 |
1,290 |
|
1,485 |
1,499 |
|
48 |
1,380 |
1,303 |
|
1,511 |
1,519 |
|
50 |
1,399 |
1,316 |
|
1,538 |
1,540 |
|
52 |
1,419 |
1,328 |
|
1,564 |
1,560 |
|
54 |
1,439 |
1,340 |
|
1,590 |
1,580 |
|
56 |
1,460 |
1,351 |
|
1,616 |
1,601 |
|
58 |
1,482 |
1,362 |
|
|
1,643 |
|
60 |
1,503 |
1,373 |
|
|
1,662 |
ЛАБОРАТОРНАЯ РАБОТА № 4
