
- •Для студентов фармацевтического факультета
- •Введение
- •Требования техники безопасности при работе в химической лаборатории
- •Меры оказания первой помощи при несчастных случаях
- •Методические рекомендации по выполнению и оформлению лабораторных работ
- •Отчет должен содержать следующие сведения:
- •Свойства основных классов неорганических соединений.
- •Определение молекулярной массы эквивалента металла.
- •Приготовление раствора заданной концентрации.
- •Определение теплового эффекта реакции нейтрализации.
- •Кинетика химических реакций, качественные опыты по химическому равновесию.
- •Гетерогенные равновесия и процессы. Произведение растворимости (пр), условия образования и растворения осадков.
- •Гидролиз. Смещение равновесия в реакциях гидролиза.
- •Учебно-исследовательский комплекс (уирс)
- •Окислительно-восстановительные реакции (овр)
- •Получение, состав и свойства комплексных соединений
- •Водород, вода, пероксид водорода.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Свойства элементов Iв группы: Cu, Ag, Au.
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Учебно-исследовательский комплекс (уирс)
- •Элементы Vа группы периодической системы и свойства их соединений. Азот и фосфор. Мышьяк, сурьма и висмут.
- •Учебно-исследовательский комплекс (уирс)
- •Элементы vIа группы периодической системы и свойства их соединений. Сера.
- •Элементы viIа группы периодической системы. Галогены и свойства их соединений.
- •Учебно-исследовательский комплекс (уирс)
- •Приложение 1 лабораторная техника
- •Образец оформления титульного листа
- •Литература
- •Содержание
Определение молекулярной массы эквивалента металла.
Значение темы: знание методики расчета, связанной с законом эквивалентов, определением эквивалента, используется при расчетах концентрации растворов, массы и объема веществ, образующихся при реакциях обмена.
Цель: научиться вычислять молярную массу эквивалента вещества и определять ее опытным путем.
Определение молярной массы эквивалента металла методом вытеснения водорода проводится в газометрической установке, изображенной на рисунке 1.
Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее металла
Рис. 1. Газометрическая
измерительная установка.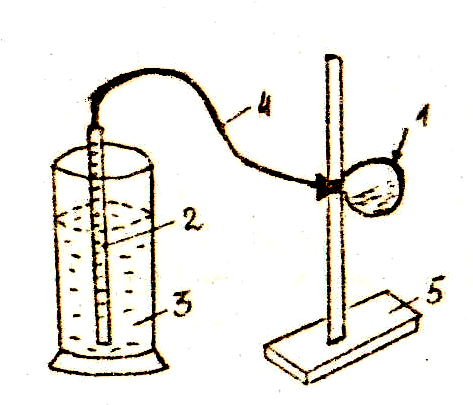
Методика определения:
В колбу (1) через воронку налейте 10 мл кислоты. Закрепите колбу в горизонтальном положении. На сухое горлышко колбы положите навеску металла (магния или цинка), предварительно записав ее массу – m(Ме) в рабочий журнал. Плотно закройте колбу пробкой, соединенной трубкой (4) с бюреткой (2). Бюретка опущена в цилиндр (3) с водой.
1. Проверяем прибор на герметичность (по постоянству уровня воды в приподнятой на 10-15 см бюретке). Устанавливаем воду в бюретке и цилиндре на одинаковом уровне, записываем в журнале положение уровня до начала опыта (V1).
2. Поворачиваем колбу (1) так, чтобы навеска металла попала в кислоту. Выделяющийся водород вытесняет воду из бюретки (2) в цилиндр (3).
3. После окончания реакции дайте прибору охладиться и приведите воду в бюретке (2) и цилиндре (3) к одинаковому уровню. Записываем положение уровня воды в бюретке (2) после реакции (V2).
4. Записываем уравнение происходящего процесса.
5. Вычисляем теоретическое значение молярной массы эквивалента:
МЭ
(Ме)теор.
=
 гдеz
– валентность метала.
гдеz
– валентность метала.
По полученным данным определяем:
Объем вытесненного водорода:
 ,
см3
,
см3Приводим объем газа (см3) к нормальным условиям (н.у.), пользуясь объединенным газовым законом:
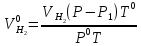 ,
,
где Р – атмосферное давление по барометру, кПа; Р1 – давление водяных паров, кПа (табл. 1); Т0 – абсолютная температура, равная 273 К; Р0 – давление при н.у., равное 101,3 кПа; Т – комнатная температура, К
Таблица 1
Парциальное давление водяного пара в зависимости
от температуры воздуха
|
Температура, 0С |
Давление водяного пара, кПа |
Температура, 0С |
Давление водяного пара, кПа |
Температура, 0С |
Давление водяного пара, кПа |
|
11 |
1,317 |
17 |
1,929 |
23 |
2,793 |
|
12 |
1,397 |
18 |
2,064 |
24 |
2,966 |
|
13 |
1,490 |
19 |
2,195 |
25 |
3,153 |
|
14 |
1,583 |
20 |
2,328 |
26 |
3,352 |
|
15 |
1,702 |
21 |
2,474 |
27 |
3,551 |
|
16 |
1,809 |
22 |
2,633 |
28 |
3,764 |
Рассчитываем практическое значение молярной массы эквивалента металла, используя закон эквивалентов:
а)
по эквивалентному объему:
 ,
где
,
где =
11,2 дм3
= 11200 см3.
=
11,2 дм3
= 11200 см3.
б)
по массе водорода:
 ,
где
,
где , г
, г
в) по среднему значению Мэ(Ме), найденного опытным путем:
 ,
г/моль
,
г/моль
Вычисляем погрешность определения:
а)
абсолютную ошибку эксперимента:
 ,
г/моль
,
г/моль
б)
относительную ошибку эксперимента:
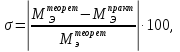
ЛАБОРАТОРНАЯ РАБОТА № 3
