
- •Оглавление
- •Введение
- •1. Классические распределения
- •1.1. Некоторые общие теоретические сведения
- •1.2. Распределение Максвелла. Теоретические сведения
- •1.3. Распределение Максвелла. Задачи для самостоятельного решения
- •1.4. Распределение Больцмана. Теоретические сведения
- •1.5. Распределение Больцмана. Задачи3 для самостоятельного решения
- •2. Квантовые распределения
- •2.1. Некоторые общие теоретические сведения
- •2.2. Распределение Ферми-Дирака. Применение распределения Ферми-Дирака к электронному газу в металлах. Теоретические сведения
- •2.3. Распределение Ферми-Дирака. Применение распределения Ферми-Дирака к электронному газу в металлах. Задачи для самостоятельного решения
- •2.4. Распределение Бозе-Эйнштейна. Теоретические сведения
- •2.5. Тепловое излучение. Применение распределения Бозе-Эйнштейна к тепловому излучению. Теоретические сведения.
- •2.6. Тепловое излучение. Применение распределения Бозе-Эйнштейна к тепловому излучению. Задачи для самостоятельного решения
- •3. Справочные данные
- •Лицензия ид № 01094.
1.2. Распределение Максвелла. Теоретические сведения
Найдем функцию распределения для импульса частицы ИГ.
Интегралы по компонентам импульса в правой части равенства (1.6) разделяются и вычисляются с помощью табличного интеграла [2]:
![]() .
.
![]()
Тройное
интегрирование в условии нормировки
![]() (вероятность найти частицу хоть с
каким-нибудь импульсом равна единице)
дает значение
(вероятность найти частицу хоть с
каким-нибудь импульсом равна единице)
дает значение![]() ,
а формула (1.6) принимает вид:
,
а формула (1.6) принимает вид:
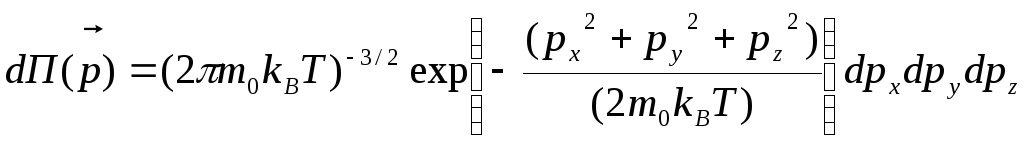 .
.
![]()
Используя
выражение
![]() ,
можно перейти от импульсов к скоростям
и получить распределение вероятности
для скорости:
,
можно перейти от импульсов к скоростям
и получить распределение вероятности
для скорости:
![]() .
.
![]()
Функция распределения по скоростям классических нерелятивистских частиц физической системы, находящейся в статистическом равновесии, задаваемая формулой
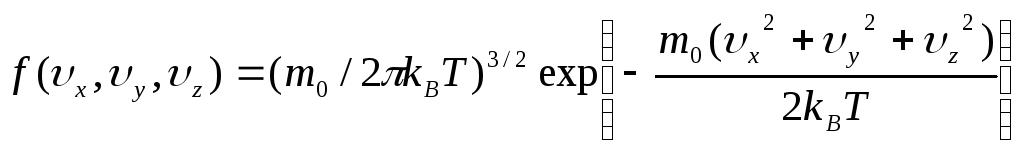 ,
,
![]()
называется
распределением
Максвелла
по проекциям скорости.
Распределение Максвелла (1.11) определяет
вероятное число частиц ИГ, компоненты
скоростей которых лежат в интервалах
от
![]() до
до
![]() ,
от
,
от
![]() до
до
![]() ,
от
,
от
![]() до
до
![]() .
.
Отсюда можно найти функцию распределения для модуля скорости частиц ИГ, которая называется распределением Максвелла по модулю скорости и задается формулой:
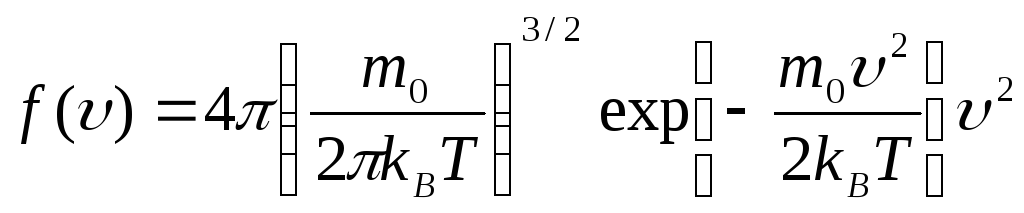 .
.
![]()
Она
позволяет определить число молекул в
объеме
![]() ,
занимаемом ИГ, модуль скорости которых
лежит в интервале значений от
,
занимаемом ИГ, модуль скорости которых
лежит в интервале значений от
![]() до
до
![]() :
:
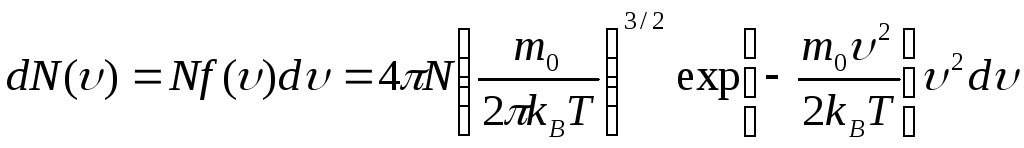
![]()
где
![]() – полное число частиц ИГ.
– полное число частиц ИГ.
Чтобы
найти среднее число частиц
![]() ,
модули скоростей которых лежат в
интервале значений от
,
модули скоростей которых лежат в
интервале значений от
![]() до
до
![]() ,
нужно проинтегрировать функцию (1.13) в
заданных пределах1:
,
нужно проинтегрировать функцию (1.13) в
заданных пределах1:
 .
.
![]()
Вероятность
обнаружения, или, другими словами,
относительное
число частиц
ИГ, модуль скорости которых лежит в
интервале значений от
![]() до
до
![]() ,
равна:
,
равна:
![]() .
.
![]()
Вероятность
обнаружения (относительное
число) частиц
ИГ, модуль скорости которых принимает
значение в интервале от
![]() до
до
![]() ,
находится по формуле:
,
находится по формуле:
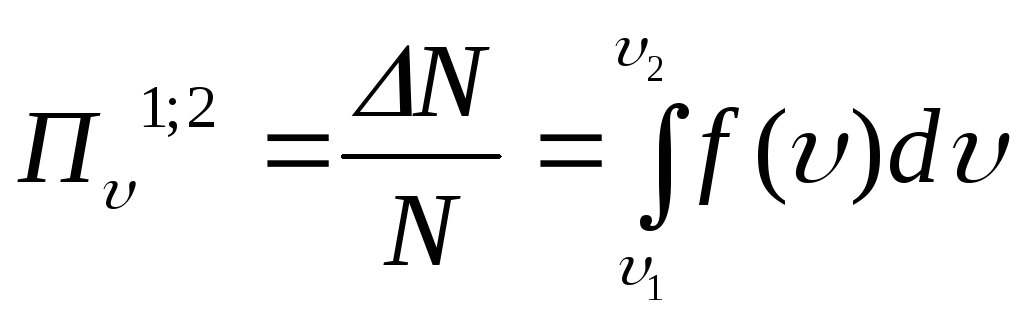 .
.
![]()
Значение
модуля скорости, при котором распределение
Максвелла (1.12) максимально, называется
наиболее
вероятной скоростью.
Наиболее вероятная скорость
![]() .
.
С
помощью распределения Максвелла можно
найти среднее значение любой функции,
зависящей от скорости частицы. Например,
среднее значение модуля скорости и
среднеквадратичная скорость соответственно
равны:
![]() и
и
![]() .
.
Для решения задач на распределение Максвелла в дополнение к интегралу (1.8) понадобятся следующие интегралы [2]:
![]() ;
;
![]() ;
;![]() .
.
Кроме
того, с учетом свойства монотонности
подынтегральной функции значение
интеграла (1.14) (и подобных ему) при близких
значениях пределов интегрирования
![]() и
и
![]() (
(![]() )
достаточно точно вычисляется по
приближенной формуле:
)
достаточно точно вычисляется по
приближенной формуле:
![]() ,
где
,
где
![]() – значение функции распределения
Максвелла (1.12) при
– значение функции распределения
Максвелла (1.12) при
![]() .
.
1.3. Распределение Максвелла. Задачи для самостоятельного решения
1(1). При н. у. в сосуде объемом 5 л находится аргон. Вычислить количество молекул аргона, скорости которых лежат в интервале от 300 до 310 м/с.
2(2). Найти отношение вероятностей обнаружения молекул азота и кислорода со скоростями, отличающимися на 20 м/с от первой космической скорости при температуре 27 C.
3(2).
Найти вероятность того, что молекула
кислорода при 297 K
имеет скорость, отличающуюся от
![]() не более, чем на 1 %.
не более, чем на 1 %.
4(2). У какой части молекул водорода при температуре 127 C скорости движения отличаются от наиболее вероятной не более, чем на 2 %?
5(1). Найти отношение вероятности обнаружить молекулы аргона со скоростями, отличающимися на 1 м/с от наиболее вероятной при температуре 200 K, к вероятности обнаружить эти же молекулы со скоростями, отличающимися на 1 м/с от наиболее вероятной при температуре 300 K.
6(2).
Определить относительное число
![]() молекул азота, модуль скорости которых
при 24 C
меньше
молекул азота, модуль скорости которых
при 24 C
меньше
![]() на 1 %.
на 1 %.
7(2). Вычислить долю молекул ксенона, находящихся при температуре -73 C, скорости которых лежат в интервале от 100 до 110 м/с.
8(2). Во сколько раз для молекул аргона при температуре 400 C вероятность иметь скорость, отличающуюся на 15 м/с от первой космической скорости, больше, чем вероятность иметь скорость, отличающуюся на 15 м/с от второй космической скорости?
9(2). Во сколько раз относительное число молекул кислорода больше относительного числа при 280 К, если модуль скорости и тех, и других частиц принадлежит интервалу: а) от 19,8 до 20,2 м/с; б) от 1980 до 2020 м/с?
10(3). Используя распределение Максвелла, получить выражение для наиболее вероятной скорости частиц ИГ.
11(3). Используя распределение Максвелла, получить выражение для средней кинетической энергии поступательного движения и среднеквадратичной скорости частиц ИГ.
12(3). Используя распределение Максвелла, получить выражение для средней скорости частиц ИГ.
