
МЕТОДИЧЕСКОЕ ПОСОБИЕ- Орг. химия-Часть 2
.pdf
асимметрических атомов углерода, находится по формуле N=2n , где n – число асимметрических атомов углерода.
Следовательно, для винной кислоты следует ожидать существования четырёх оптических стереоизомеров:
|
COOH |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
COOH |
|||||||||||||||||||||||||||
H |
|
|
OH |
HO |
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
HO |
|
|
|
H |
|||||||||
HO |
|
|
H |
H |
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HO |
|
C |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
COOH |
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
COOH |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
(+)-винная |
|
(− )-винная |
|
|
|
|
|
|
|
|
мезовинная |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(недеятельная) |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
I |
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
|
|
|
|
IV |
|
||||||||||||||||||||||||||
В соответствии с правилами обращения с проекционными формулами, при наложении последних двух форм друг на друга они оказываются идентичными (одну из форм следует повернуть в плоскости чертежа на 180°). Таким образом, вместо четырех стереоизомерных форм винная кислота реализуется в трех. Кроме того, третий стереоизомер (III) оказывается оптически недеятельным из-за своей симметрии (на рисунке показана плоскость симметрии): вращение плоскости поляризации света, вызываемое верхним тетраэдром, полностью компенсируется равным по величине, но противоположным по знаку вращением нижнего. Перед нами пример стереоизомерной
формы с асимметрическими углеродными атомами оптически недеятельной вследствие ее симметрии. Такие стереоизомеры называют мезоформами.
Стереоизомеры вещества, не являющиеся зеркальным отображением друг друга, называются диастереоизомерами. В
соответствии с этим определением, первая и вторая пространственные формы винной кислоты являются диастереомерами по отношению к мезовинной кислоте (и наоборот).
Поскольку антиподы имеют одинаковое (только зеркально обратное) строение, их свойства за исключением отношения к поляризованному свету тоже одинаковы. Диастереомеры не одинаковы по своему пространственному строению, поэтому их свойства несколько различаются.
Заключая анализ пространственной изомерии винной кислоты, можно сказать, что она представлена двумя антиподами (формы I и II), их рацематом, называемым виноградной кислотой, и диастереоизомерной
61

мезоформой (III).
Правовращающая, (+)-винная кислота весьма распространена в природе, особенно её много в соке винограда. При брожении виноградного сока она выделяется в виде винного камня, состоящего из кислого виннокислого калия.
HOOC CHOH CHOH COOK
Эта соль применяется в качестве протравы при крашении и печатании тканей.
Другая, калий-натриевая соль (+)-винной кислоты – так называемая сегнетова соль,
NaOOC CHOH CHOH COOK . 4H2O
используется в качестве пьезокристалла в радиотехнике. Она входит в состав фелинговой жидкости, которая употребляется для аналитического определения восстановителей (например, альдегидов).
Мезовинная кислота получается вместе с виноградной при кипячении в течении нескольких часов (+)-винной кислоты с избытком едкого натра.
Лимонная кислота
HCH COOH
HO C COOH
HCH COOH
Она довольно часто встречается в природе: в свекле, крыжовнике, винограде, лимонах, малине, листьях табака. Оптически недеятельна.
Лимонная кислота используется в пищевой промышленности, при крашении, в фотографии, для консервирования крови и т.д.
Альдоновые кислоты
Альдоновые кислоты – это полигидроксикарбоновые кислоты
общей формулы HOCH2[CH(OH)]nCOOH, формально являющиеся продуктами окисления альдегидной группы углеводов (альдоз). Наиболее типичным лабораторным методом синтеза альдоновых кислот является окисление легкодоступных альдоз бромом в его водном растворе.
62

O
C H
H
H C OH
HO C H H C OH H C OH
CH2OH глюкоза
Br2
водный раствор
O
C OH H C OH
OH H C OH
HO C H H C OH H C OH
CH2OH
глюконовая
кислота
Альдоновые кислоты и их производные играют важную роль в синтетической химии моносахаридов.
Методы разделения рацематов на оптически активные компоненты
В настоящее время стремительно растет потребность в энантиомерно чистых веществах для получения современных высокоэффективных медицинских препаратов, а также нужд сельского
хозяйства и защиты лесов: получения |
новых |
высокоактивных |
||
инсектицидов, |
гербицидов, |
фунгицидов |
и |
других веществ |
избирательного действия для борьбы с вредными организмами. Получение энантиомерно чистых веществ для этих целей возможно либо на путях разработки методик их полного химического синтеза (ряд достижений в этой области отмечен присуждением Нобелевских премий по химии), либо разделением рацемических смесей. Рассмотрим принципы некоторых методов разделения рацематов на оптически активные компоненты.
–Механический отбор. При кристаллизации рацематы иногда кристаллизуются отдельно в виде правой и левой форм. Причем их кристаллы по форме относятся друг к другу как предмет к своему зеркальному отражению. В этом случае их можно отобрать механически по внешнему виду.
–Биохимическое разделение. Оно основано на том, что
микроорганизмы в процессе своей жизнедеятельности способны потреблять предпочтительно лишь один из оптических изомеров. Обычно эта оптическая форма более распространена в природе. Поэтому при размножении и прорастании грибков в растворе рацемата через некоторое время остается только одна оптически активная форма.
– Способы, основанные на различии свойств диастереомеров
Так, соли антиподов оптически деятельной кислоты с одним и тем
63
же оптически деятельным основанием должны давать диастереомеры различной растворимости. Это позволяет разделить их кристаллизацией.
(+)-кислота + (− )-кислота (− )-основание
соль (+)-кислоты |
соль (− )-кислоты |
||
и (− )-основания |
и (− )-основания |
||
|
|
|
|
(+)-кислота |
(− )-кислота |
||
9.3 Ароматические гидроксикислоты (фенолокислоты)
Наибольшее значение имеет орто-гидроксибензойная или
салициловая кислота.
Получают её действием СО2 под давлением на фенолят натрия:
ONa |
OH |
|
OH |
|
CO2 |
O |
H2SO4 |
O |
|
C |
C |
|||
|
|
|||
1300, 5 ат. |
ONa |
|
OH |
сильнее бензойной
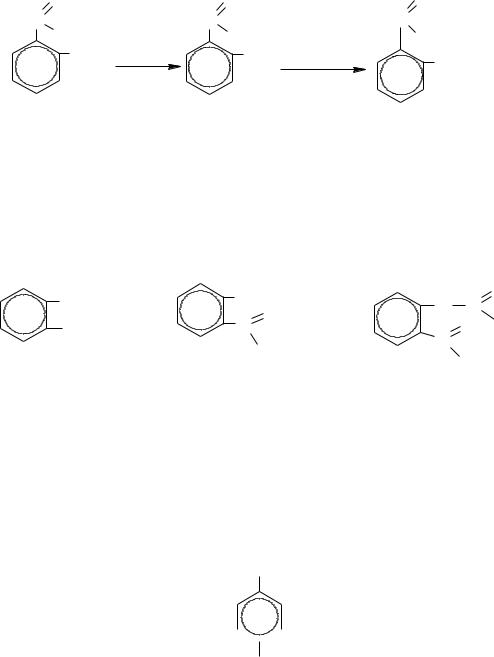
Салициловая кислота значительно сильнее бензойной: образование водородной связи между водородом фенольной и кислородом кислотной групп существенно повышает положительный заряд на атоме углерода карбоксила и тем самым – силу кислоты.
Салициловая кислота образует два ряда производных (по обеим функциональным группам):
– с галогенангидридами и ангидридами она реагирует по фенольной группе:
COOH
 OH
OH
CH3 |
C |
O |
COOH |
|
O |
||||
CH3 |
C |
|
||
O |
O C CH3 + CH3 COOH |
|||
|
|
|||
|
|
|
O |
ацетилсалициловая кислота (аспирин)-жаропонижающее
64
– хлорангидрид салициловой кислоты образует с фенолами или спиртами сложные эфиры по карбоксилу
O |
|
O |
|
O |
C OH |
|
C Cl |
|
C |
POCl3 |
C6H5OH |
OC6H5 |
||
OH |
|
OH |
OH |
|
|
|
|
|
|
|
|
|
фенилсалицилат |
|
|
|
|
(салол) антисептик − |
|
|
|
|
желудочно-кишечные |
|
|
|
|
заболевания |
|
В больших масштабах салициловая кислота используется в производстве красителей и лекарственных препаратов. Вот, например, широко известные лекарства
OH |
OH |
O C O |
||
COONa |
C O |
C |
O |
CH3 |
|
OC6H5 |
|
|
|
|
|
OH |
|
|
салициловокислый |
(фениловый эфир |
аспирин |
|
|
натрий |
салициловой |
(уксуснокислый эфир |
||
|
кислоты) салол |
салициловой кислоты) |
||
|
(дезинфицирует |
(жаропонижающее) |
||
|
кишечник) |
|
|
|
Из полигидроксикарбоновых кислот наиболее известна 3,4,5-тригидроксибензойная или галловая кислота.
COOH
HO
 OH
OH
OH
Она входит в состав природных дубильных веществ, находится в чае, чернильных орешках.
Танины, извлекаемые из дубильных орешков, представляют собой глюкозу, ацилированную галловой кислотой.
65
|
|
|
O |
CH2OG |
где G − |
C |
|
H |
O H |
|
|
OGH |
H |
HO |
OH |
ОG |
OG |
||
OG |
|
OH |
|
H |
|
||
|
|
||
Дубильные вещества – это органические соединения растительного происхождения, имеющие вяжущий вкус. Особенно много их в коре дуба. Применяются, например, для дубления сырых кож. Дубление с химической точки зрения – процесс соединения дубильных веществ с белками кожи (денатурация белков). Отсюда: «дубленка». При этом образуется термически и химически стойкий слой, трудно проницаемый для воды и газов. Получены и синтетические дубители.
В медицине дубильные вещества употребляются как противоядие при отравлении алкалоидами, желудочно-кишечных заболеваниях, при ожогах (таннин) и т.д. Большое значение имеют дубильные вещества в пищевой промышленности, где они нередко определяют характер переработки и вкусовые достоинства готового продукта. Например, производство черного чая основано на превращении дубильных веществ, содержащихся в молодых побегах чайного растения. От правильно проведенного окисления дубильных веществ при ферментации зависит в основном цвет, вкус и аромат чая. Дубильные вещества используются также в производстве какао и ряда других пищевых продуктов.
10АМИНОКИСЛОТЫ, ПОЛИПЕПТИДЫ
10.1Аминокислоты
Аминокислотами называют соединения, в которых одновременно содержатся аминная и карбоксильная группы. Простейшие аминокислоты имеют тривиальные названия. Обычно же их называют как замещённые соответствующих кислот, обозначая положение аминогрупп относительно кислотной буквами α, β, γ, δ и т. д. Используется также названия по номенклатуре ИЮПАК:
CH2NH2 |
|
|
COOH |
глицин, гликокол, |
|||||||
|
|
||||||||||
CH3 |
|
CHNH2 |
|
|
COOH |
аминоуксусная, аминоэтановая |
|||||
|
|
|
α-аланин, α-аминопропионовая, |
||||||||
|
|
|
|||||||||
CH2NH2 |
|
|
CH2 |
|
|
|
2-аминопропановая |
||||
|
|
|
|
COOH |
β-аланин, β-аминопропионовая, |
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
3-аминопропановая |
66

CH3 |
|
|
|
CH2 |
|
|
|
CH2 |
|
|
|
CHNH2 |
|
|
COOH |
валин, α-аминовалериановая, |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
CH3 |
|
CH2 |
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-аминопентановая |
||||||
|
|
|
|
|
|
CH2 |
|
CHNH2 |
|
COOH |
α-аминокапроновая |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
CH3 |
|
|
|
CH2 |
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-аминогексановая |
|||
|
|
|
|
|
|
|
|
|
|
|
CH2NH2 |
|
COOH |
изолейцин, |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-амино-3-метилпентановая |
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
CHNH2 |
|
CH2 |
|
CH2 CHNH2 |
|
COOH |
лизин, α,δ-диаминокапроновая, |
|||||||||||||||||||||||
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,6-диаминогексановая |
Аминокислоты могут содержать одну или несколько кислотных групп и различаться по основности. В молекулу аминокислоты может также входить и несколько аминогрупп.
Методы получения
–Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды.
При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты.
–Действие аммиака на галоидзамещённые кислоты
CH2Cl |
|
COOH + NH3 |
|
CH2NH2 |
|
COOH + HCl |
|
|
|
аминоуксусная
– α-Аминокислоты получают действием аммиака на оксинит-
рилы
|
|
OH |
|
|
HNH |
|
|
|
NH2 |
|
2H2O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
||||
CH3 C СN |
|
2 |
CH3 |
|
C СN |
|||||||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
H |
|
|
|||||||
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
CH3 |
|
|
|
|
COOH + NH3 |
|
|
|||||||||
|
|
|
|
|
C |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
||||
α -аланин
Оксинитрилы получают действием на альдегиды HCN
|
|
O |
HCN |
|
|
OH |
|||
|
|
|
|
|
|
|
|
|
|
CH |
|
C |
CH3 |
|
C |
|
СN |
||
|
|
|
|
||||||
|
|
|
|||||||
|
|
|
|
||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
H |
|||
67

Физические свойства
Аминокислоты в настоящее время рассматриваются как продукты нейтрализации карбоксила и аминогруппы в одной и той же молекуле, т.е. как внутренние соли
+
NH2 CH2 COOH 
 NH3 CH2 COO
NH3 CH2 COO
2
Молекула внутренней соли является биполярным ионом, то есть молекулой с разноимёнными зарядами на противоположных концах молекулы.
Существованием аминокислот в виде биполярных ионов объясняются высокие температуры плавления аминокислот, их малая летучесть, нерастворимость в углеводородах и хорошая растворимость в воде. Некоторые аминокислоты оптически активны.
Химические свойства
Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп. Эти реакции были рассмотрены ранее в соответствующих разделах курса.
Дополнительно к этому познакомимся со свойствами
аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп.
– Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.
|
|
|
|
|
|
|
|
|
|
+H+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
CH |
2 |
|
|
C |
|
|
|
OH |
||||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
32 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
NH2 |
|
CH2 |
|
C O |
H |
|
|
|
|
|
|
|
|
|
|
|
O |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
+OH− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
CH2 |
|
|
|
C |
|
|
|
|
|
O |
|
+ H2O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
||||||||||
Концентрация водородных ионов (рН среды), при которой амфотерное соединение наименее и в равной мере диссоциировано по обоим направлениям, называется изоэлектрической точкой.
В изоэлектрической точке аминокислота существует в виде
68
биполярного иона (в целом электрически нейтрального соединения), поэтому в изоэлектрической точке водные растворы аминокислот неэлектропроводны. Изоэлектрическая точка для каждой аминокислоты является индивидуальной характеристикой и может использоваться для их идентификации.
– С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями
H2C NH O C O
O
O C |
O |
Cu3- |
NH2 CH2 |
– Химическое поведение аминокислот в значительной мере
определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот.
α-Аминокислоты при нагревании легко отщепляют воду и дают
дикетопиперазины.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
||
CH2 |
|
COOH H |
|
|
NH |
|
|
CH2 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
C |
|
|
NH |
||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
NH |
|
|
|
H HOOC |
|
|
CH2 |
|
NH |
|
|
|
C |
|
CH2 |
|||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
||
β-Аминокислоты отщепляют аммиак и образуют аммонийную соль непредельной кислоты
CH2 |
|
CH |
|
COOH |
|
H2C |
|
CH |
|
COONH4 |
|
|
|
|
|||||||
|
|
|
|
|||||||
|
|
|
|
NH2 H
γ- и δ-Аминокислоты отщепляют воду внутримолекулярно и дают
лактамы
|
CH2 |
|
CH2 |
|
CH2 |
|
C |
|
O |
|
|
CH3 |
|
CH2 |
|
|
CH2 |
|
C |
|
O + H2O |
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||||||||||||
|
|
|
|
|
|||||||||||||||||||||
|
NH |
|
H |
|
|
|
OH |
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|||||||
69

Отдельные представители
α-Аминопропионовая кислота (α-аланин)
* |
|
|
|
|
|
|
|
||||||||
|
|
|
CH3 |
|
|
|
CH |
|
COOH |
|
|
||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|||
В α-аланине имеется асимметрический атом углерода. Поэтому он |
|||||||||||||||
оптически активен. L(+)-аланин входит в состав всех белков. Его можно |
|||||||||||||||
получать гидролизом фиброина шёлка. |
|
|
|
|
|||||||||||
2,6-диаминогексановая кислота (лизин) |
|
|
|||||||||||||
* |
|
|
|
|
|||||||||||
CH2NH2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
CHNH2 |
|
COOH |
|||||
|
|
|
|
|
|
||||||||||
В состав лизина входят две аминогруппы и один карбоксил. Поэтому он является сильным основанием. L(+)-лизин входит в состав белков и относится к незаменимым аминокислотам.
6-Аминогексановая кислота (ε-аминокапроновая)
CH2NH2 CH2 CH2 CH2 CH2 COOH
Эта кислота и её лактам, капролактам, используется для получения синтетического волокна капрон.
10.2 Полипептиды
Известно, что аминокислоты входят в состав белков. Белки находятся во всех растительных и животных организмах и являются
главными носителями жизни |
(Ф.Энгельс: «Жизнь есть способ |
существования белковых тел…»). |
|
Несмотря на многочисленность белков, в их состав входят не более 22 разных аминокислот. При гидролизе белок превращается в смесь аминокислот.
Изучение состава, строения и свойств белков составляет предмет последующего курса «Биологическая химия». В рамках курса «Органическая химия» рассмотрим вопросы об основных формах связи аминокислот в сложной молекуле белка и основные принципы химического синтеза полипептидов. Гидролиз природных белков показал, что в их состав входят α-аминокислоты. Ещё в 1891 г. А.Я. Данилевский высказал предположение, что α-аминокислоты связываются в белке за счёт амидных связей, образованных карбоксилом одной молекулы аминокислоты и аминогруппой другой.
70
