
- •Основы биохимии Учебное пособие для студентов заочной формы обучения
- •Глава I. Общий химический состав живых
- •Глава 2. Белковые вещества
- •Рис 2.6. Схема денатурации белка
- •Глава 3. Нуклеиновые кислоты
- •Глава 4. Ферменты
- •Глава 5. Общее понятие об обмене веществ и энергии
- •Глава 6. Биологическое окисление
- •О о
- •Глава 7. Обмен углеводов
- •Глюкоза Этиловый
- •Аэробное окисление углеводов.
- •Глава 8. Обмен липидов
- •Глава 9. Обмен белков
- •Обмен нуклеопротеид0в
- •Глава 10. Взаимосвязь между обменом белков жиров и углеводов связь между обменом белков и углеводов
- •Глава 11. Водно-солевой обмен роль воды в организме и ее обмен
- •Обмен минеральных веществ
- •Глава 12. Витамины
- •Антивитамины
- •Глава 13. Гормоны
- •Глава 14. Биохимические основы рационального питания
- •Глава 1. Общий химический состав живых организмов
Глава 2. Белковые вещества
2.1. Общая характеристика белков
Белки, или протеины (греч. протос - первый, важнейший, главный) -высокомолекулярные органические полимеры, построенные из остатков -аминокислот. Массовая доля белков в пересчете на сухое вещество в среднем составляет в организме животных 40 - 50%, в семенах растений - 10 - 35 %.
Независимо от источников получения белки содержат при пересчете на сухое вещество (в %) углерода 50-55, кислорода 21-24, азота 15-18, водорода 6,5 - 7,3, серы 0,3 - 2,5 , фосфора 0 -2, золы 0 - 0,5.
Б е л к и - важнейшие вещества, входящие в состав живых систем. Они обладают многими свойствами и функциями, отсутствующими у других органических соединений.
С т р о и т е л ь н а я (с т р у к т у р н а я) ф у н к ц и я. Белки образуют основу цитоплазмы любой живой клетки, с липидами создают структуру всех клеточных мембран и органелл.
К а т а л и т и ч е с к а я ф у н к ц и я. Все катализаторы биохимических реакций, называемые ферментами, по своей химической природе являются белками. Эта функция белков является уникальной, не свойственной другим полимерным соединениям.
Д в и г а т е л ь н а я ф у н к ц и я. Любые формы движения в живой природе (сокращение и расслабление мышц, движение ресничек и жгутиков у простейших, движение протоплазмы в клетке и т.д.) осуществляется белковыми веществами клеток.
Т р а н с п о р т н а я ф у н к ц и я. В крови имеются белки, которые могут связывать и переносить определенные молекулы или ионы из одного органа в другой. В клеточных мембранах присутствует тип белков, способных связывать многие вещества и переносить их через мемрану.
З а щ и т н а я ф у н к ц и я. Многие белки защищают организм от вторжения других организмов или предохраняют его от повреждений. Антитела, образующиеся в организме - это специфические белки, обладающие способностью распозанавать проникшие в организм бактерии, чужеродные белки, токсины, а затем обезвреживать их. Белки, участвующие в процессе свертывания крови, предохраняют организм от потери крови при повреждении кровеносных сосудов. Токсические белки (змеиные яды, токсины бактерий, токсичные белки
растений), по-видимому, также выполняют защитные функции.
Р е г у л я т о р н а я ф у н к ц и я. Некоторые белки участвуют в регуляции обмена веществ в организме. Одни из регуляторных белков вырабатываются железами внутренней секреции животных и носят название гормонов. Каждый из белков-гормонов регулирует какую-либо из сторон обмена веществ, например, обмен глюкозы, транспорт ионов кальция и фосфора. Другие регуляторные белки, называемые репрессорами, регулируют биосинтез ферментов в бактериальных клетках. К регуляторным белкам можно отнести белковые ингибиторы ферментов.
З а п а с н а я (п и щ е в а я) ф у н к ц и я. Семена многих растений образуют запасы белков, потребляемые как питательные вещества на первых стадиях развития зародыша. Пищевые белки имеются в яйце птиц, молоке и т.д.
Перечисленные функции белков не охватывают все их многообразие. Можно указать и на другие функции белков, в частности, участие их в размножении, поддержании онкотического давления, реакциях “узнавания”, поведенческих реакциях человека и животных.
Белки - это органические соединения, в состав которых входит азот. Массовая доля азота в белке зависит от вида биологического объекта и составляет в белках животных тканей 16 %, молока (казеин) - 15,65%, зерна пшеницы, ржи, ячменя, овса - 17,54%, зерна кукурузы и грчихи - 16,67%. По содержанию азота (определяемому, как правило, методом Кьельдаля) высчитывают массовую долю белка в биологических объектах и продуктах, используя коэффициенты пересчета.
2.2. Аминокислоты - структурные элементы белков
2.2.1. Определение и стереохимия аминокислот
Аминокислоты - это органические соединения, в молекуле которых одновременно присутствуют основная аминогруппа (NH2) и кислая карбоксильная группа (СООН).
Из белков при помощи гидролиза выделено 20 аминокислот, которые представляют собой карбоновые кислоты , замещенные в -положении (или в положении 2) аминогруппой и имеют следующую общую формулу:
СООН Буквой R обозначена боковая группа ( R -
группа). Каждая -аминокислота имеет
NH2СHсвою характерную для нее R -группу.
R
Аминокислоты, входящие в состав белков, называют с т а н д а р т н ы м и, о с н о в н ы м и или н о р м а л ь н ы м и. Каждая из них имеет тривиальное (традиционное) название и трехбуквенное условное обозначение (см. классификацию аминокислот). Все стандартные аминокислоты, кроме глицина, содержат а с и м м е т р и ч н ы й атом углерода в -положении (атом углерода, с которым связаны четыре разные замещающие группы) и, следовательно, оптически активны. Они способны вращать плоскость поляризованного луча в разные стороны, существовать в виде пары энантиомеров - D и L (молекул, имеющих несовместимые друг с другом зеркальные изображения).
Заглавные буквы D и L указывают на конфигурацию молекулы. Если аминогруппа расположена справа от оси СООН R, то это D-аминокислота, если находится слева от оси СООНR, то L-аминокислота:
СООН COOH
NH2CH HCNH2
R R
L-аминокислота D -аминокислота
Направление вращения плоскости поляризации света обозначают знаком (+) - вращение вправо (по часовой стрелке) и знаком () - вращение влево (против часовой стрелки):
СООН COOH
NH2CH HCNH2
R R
L () - серин D (+) - серин
Знак и величина оптического вращения зависят от природы растворителя, реакции среды, наличия в растворе солей и от природы боковой цепи (R - группы).
Следует отметить, что знак оптической активности можно не указывать.
В состав белков входят только аминокислоты L - ряда. При гидролизе белков в мягких условиях аминокислоты сохраняют свою оптическую активность. Аминокислоты, присутствующие в организме животных и растений в свободном виде также принадлежат к L - ряду. D-аминокислоты встречаются в природе очень редко и обнаружены в составе некоторых микроорганизмов и пептидных антибиотиков.
2.2.2. Физико-химические свойства аминокислот
Аминокислоты представляют собой белые кристаллические вещества хорошо растворимые ( за некоторым исключением) в воде, аммиаке и других полярных растворителях; в неполярных и слабополярных растворителях (метанол, этанол, ацетон) растворяются плохо.
В водных растворах все -аминокислоты существуют в виде биполярных ионов (цвиттер-ионов) с диссоциированной карбоксильной группой и протонированной аминогруппой:
СООН COO
+

 NH2CH
NH3CH
NH2CH
NH3CH
R R
В зависимости от рН среды аминокислоты могут быть в форме катионов, анионов, электронейтральных биполярных ионов или смеси этих форм, одна из которых обычно доминирует. Аминокислоты - амфотерные соединения; в сильнокислых растворителях имеют положительный заряд, в щелочных - отрицательный заряд:
СООН COO COO
+ +Н+++ОН
NH3CHNH3CHNH2CH + H2O
R R R
Значение рН среды, при которой аминокислоты электронейтральны, называется изоэлектрической точкой.
Вследствие амфотерности аминокислоты в зависимости от состава раствора могут реагировать с кислотами и основаниями, образуя соответствующие соли:
СООН COONa
+
Cl NH3CH NH2CH
R R
Cолянокислая соль Натриевая соль
Благодаря амфотерности аминокислоты являются буферными веществами, выполняющими важную функцию регулирования рН в организме.
Аминокислоты могут вступать в реакцию как по карбоксильной группе, так и по аминогруппе.
При взаимодействии аминокислот с формальдегидом образуются метиленовые соединения, представляющие собой кислоты, которые можно титровать щелочью:
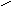
 О
О
R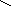
 CHCOOH + HС RCHCOOH + H2O
CHCOOH + HС RCHCOOH + H2O
Н
NH2N= CH2
R CHCOOH + NaOH
RCHCOONa + H2O
CHCOOH + NaOH
RCHCOONa + H2O
N= CH2N= CH2
Эта реакция лежит в основе метода формольного титрования при количественном определении аминокислот по Серенсену.
Все -аминокислоты реагируют с нингидрином (трикетогидринден-гидратом) с образованием продукта, окрашенного в сине-фиолетовый цвет (см. практикум по биохимии). Эта реакция применяется для точного определения очень маленьких количеств аминокислот.
Карбоксильная группа аминокислот может реагировать со спиртами, образуя сложные эфиры:
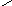
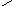 О
О
RCHCOOH + СН3OHRCHCOСН3+ H2O
NН2NH2
Эту реакцию используют для разделения и определения аминокислот путем фракционной перегонки их эфиров в вакууме.
Аминокислоты могут вступать в реакцию с соединениями, содержащими карбонильную группу (С=О), например с восстанавливающими сахарами и альдегидами.
В результате этой реакции из аминокислты образуются соответствующий альдегид , аммиак и диоксид углерода, а из сахарафурфурол или оксиметилфурфурол. Образующиеся альдегиды обладают определенным запахом, от которого зависит аромат пищевых продуктов. Фурфурол и оксиметилфурфурол легко вступают в соединение с аминокислотами, образуя темноокрашенные соединения - м е л а н о и д и н ы. Особенно интенсивна реакция между аминокислотами и восстанавливающими сахарами происходит при повышенных температурах, имеющих место при сушке овощей, фруктов, молока и солода, при упаривании сахарных сиропов, выпечке хлеба и изготовлении кондитерских изделий, самосогревании зерна, обработке вина теплом.
Реакция образования меланоидинов может происходить при взаимодействии сахаров с белками.
2.2.3. Строение и классификация аминокислот
К настоящему времени описано около 200 природных аминокислот, выделенных из животного и растительного материала. Все природные аминокислоты делят на две группы: п р о т е и н о г е н н ы е, или белковые (обнаружены только в белках) и н е п р о т е и н о г е н н ы е, или небелковые ( в белках не обнаружены).
2.2.3.1. Протеиногенные аминокислоты
Аминокислоты, обнаруженные в белках, можно классифицировать по разным признакам. По строению боковой цепи (R-группы) различаюталифатические, ароматические и гетероциклические аминокислоты, по числу аминных и карбоксильных групп - моноаминомонокарбоновые (одна NH2-группа и одна СООН-группа), диаминомонокарбоновые (две NH2 -группы и одна СООН-группа), моноаминодикарбоновые (одна NH2 -группа и две СООН-группы), по положению изоэлектрической точки - нейтральные, основные и кислые. Аминокислоты, содержащие в радикалах ОН - группы, называют гидроксиаминокислотами, а содержащие серу - серосодержащими кислотами. По способности к синтезу в животном организме биохимики делят аминокислоты на заменимые и незаменимые. Аминокислоты, содержащие NH-группы вместо NH2 - групп, называют иминокислотами.
По полярности R-групп, т.е. способности R-групп к взаимодействию с водой при соответствующих внутриклеточных условиях рН (рН вблизи 7,0) , аминокислоты делят на четыре группы: с неполярными или гидрофобными R-группами, полярными, но не заряженными R-группами, отрицательно заряженными R-группами и положительно заряженными R-группами. Рассмотрим строение аминокислот этих групп.
А м и н о к и с л о т ы с н е п о л я р н ы м и (гидрофобными) R-г р у п п а м и. Эти аминокислоты, по сравнению с другими аминокислотами, медленно растворяются в воде; их R-группы представляют собой углеводороды, и, следовательно, гидрофобны. При растворении в воде диссоциируют только аминная и карбоксильная группы расположенные у -углеродного атома.
В эту группу входят восемь аминокислот:
1.NH2CHCOOH 2. NH2CHCOOH
CH3CHCH3
Аланин, ала (-амино- CH3
пропионовая кислота) Валин, вал (-амино--метил-
масляная кислота)
3. NH2CHCOOH 4. NH2CHCOOH
СН2CHCH3
CHCH3СН2
СН3 СН3
Лейцин, лей (-амино--метил- Изолейцин, иле (-амино--
валериановая кислота) метилвалериановая кислота)
5. NH2CHCOOH 6. NH2CHCOOH
СН2 СН2

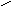
 СН2SCH3
СН2SCH3
М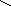
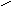
етионин
,мет (-амино--
метилмасляная кислота) Фенилаланин, фен (-амино--
фенилпропионовая кислота)
7. NH2CHCOOH
8.
СН2COOH
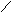

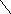
N
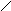 NH
NH

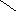 H
H




Триптофан, три (-амино-- Пролин, про (пирролидин-
индолилпропионовая кислота) карбоновая кислота)
А м и н о к и с л о т ы с н е п о л я р н ы м и н е з а р я ж е н н ы м и R-г р у п п а м и. Эти аминокислоты лучше растворяются в воде, т.е. они более гидрофильны, чем неполярные аминокислоты, т.к. их радикалы имеют группы, способные образовывать водородные связи с молекулами воды . В эту группу входят пять аминокислот и два амида:
1. NH2CHCOOH 2. NH2CHCOOH
Н СН2
Глицин, гли (аминоуксус-
ная кислота) ОН
Серин, сер (-амино--гидрокси-
пропионовая кислота)
3. NH2CHCOOH 4. NH2CHCOOH
СН2 СНОН
SH СН3
Цистеин, цис (-амино-- Треонин, тре (-амино--гидрокси-
тиопропионовая кислота) масляная кислота)
5. NH2CHCOOH 6. NH2CHCOOH
СН2 СН2
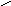
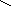
 С=О
С=О

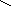
NH2
ОН
Тирозин, тир (-амино--пара- Аспарагин, асн (-амид аспараги-
гидроксифенилпропионовая новой кислоты, или полуамид -
кислота) аминоянтарной кислоты)
7. NH2CHCOOH
(СН2)2
С=О
NH2
Глутамин, глн (-амид глутаминовой
кислоты, или полуамид -аминоглута-
ровой кислоты).
R-группа глицина, представленная атомом водорода, не может компенсировать сильную полярность -аминогруппы и -карбоксильной группы. Тиоловая группа цистеина и гидроксильная группа тирозина, диссоциирующие с образованием водорода, при рН 7,0 ионизированы в незначительной степени.
Аспарагин и глутамин в водных растворах практически нейтральны, т.к. свзяи СN в амидах имеют частично двоесвязный характер из-за взаимодействия неподеленной пары азота с карбонильной группой:
RC =ОRС =О
NH2+NH2
А м и н о к и с л о т ы с о т р и ц а т е л ь н о з а р я ж е н н ы м и (кислыми) R- г р у п п а м и. Каждая из аминокислот этой группы содержит вторую карбоксильную группу, диссоциирующую с образованием ионов Н+ и при рН 7 несет суммарный отрицательный заряд. В группу входят две аминокислоты:
1. NH2CHCOOH 2. NH2CHCOOH
СН2 (СН2)2
СООН СООН
Аспарагиновая кислота, Глутаминовая кислота,
асп (-аминоянтарная глу (-аминоглутаровая
кислота) кислота)
А м и н о к и с л о т ы с п о л о ж и т е л ь н о з а р я ж е н н ы м и (основными) R - г р у п п а м и. К этой группе относят три следующие аминокислоты:
1. NH2CHCOOH 2. NH2CHCOOH
(СН2)4(СН2)3
NH2NH
Лизин, лиз (,-диамино-
капроновая кислота) C = NH
NH2
Аргинин, арг (-амино--
гуанидинвалериановая кислота)
3. NH2CHCOOH
СН2
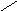 NH N
NH N
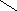
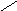
Гистидин, гис (-амино--имидазол-
пропионовая кислота)
Эти аминокислоты в радикалах имеют группы, способные принимать ион Н+. Такими группами служат: в радикале лизина -аминогруппа, в радикале аргинина - гуанидиновая группа, в радикале гистидина - имидазольное кольцо.
1.
NH2CNH 2.

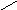
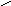 +NH2NH+NH
+NH2NH+NH
положительно заряженная
гуанидиновая группа ра- положительно заряженное имида-
дикала аргинина зольное кольцо радикала гистидина
3. +NH3 - положительно заряженная аминогруппа радикала лизина.
Все основные аминокислоты несут суммарный положительный
Н е з а м е н и м ы е а м и н о к и с л о т ы. Растения и некоторые микроорганизмы могут синтезировать все аминокислоты, нужные им для построения клеточных белков. Животный организм способен синтезировать только около половины аминокислот, необходимых ему для построения белков своего тела. Эти аминокислоты получили название з а м е н и м ы е. Остальные десять протеиногенных аминокислот животные организмы синтезировать не могут и должны получать их с пищей. Эти аминокислоты называют н е з а м е н и м ы м и или о б я з а т е л ь н ы м и. К ним принадлежат: валин, изолейцин, метионин, лейцин, лизин, треонин, триптофан, фенилаланин, аргинин и гистидин. Отсутствие или недостаток в пище каких-либо незаменимых аминокислот приводит к угрожающим жизни явлениям (задержка роста, расстройство биосинтеза белков, возникновение заболеваний и т.п.).
С понятиями заменимые и незаменимые аминокислоты связаны понятия п о л н о ц е н н ы е и н е п о л н о ц е н н ы е белки. Полноценными называют белки, содержащие все незаменимые аминокислоты. Белки, не содержащие хотя бы одну незаменимую аминокислоту, называют н е п о л н о ц е н н ы м и. На основании аминокислотного состава суммарного белка данного пищевого продукта можно говорить лишь о его меньшей или большей биологической ценности. Б и о л о г и ч е с к а я ц е н н о с т ь б е л к а - это интегральный показатель, который определяется качеством (аминокислотным составом ) и количеством белка в рационе, переваримостью белка в желудочно-кишечном тракте, скоростями всасывания аминокислот и последующим использованием их на нужды организма. Высокую биологическую ценность имеют белок куриного яйца и белок молока. Эти белки содержат незаменимые аминокислоты не только в достаточном количестве, но и в необходимом для человека соотношении. Если принять биологическую ценность белков молока или яйца (их называют идеальными белками) за 100%, то для белков мяса и рыбы она будет составлять в среднем 90-95%, белков клубней картофеля - 85%, белков бобовых культур - 75-85%, белков пшеницы и ячменя - 60 - 70 %. Низкая ценность многих белков связана с небольшим содержанием в них незаменимых аминокислот (главным образом лизина, метионина, триптофана и треонина).
2.3. Строение и пространственная структура белковой молекулы
2.3.1. Химические связи в молекуле белка
Многочисленными исследованиями установлено, что в молекуле белка имеются следующие типы связей: пептидные, дисульфидные, водородные, ионные (солевые), гидрофобное взаимодействие.
П е п т и д н а я с в я з ь. Взаимодействие аминогруппы одной аминокислоты с карбоксильной группой другой сопровождается выделе-нием молекулы воды. Реакция, идущая с выделением воды, называетсяреакцией к о н д е н с а ц и и , а возникающая ковалентная азот-углеродная ( СО NH ) связь - п е п т и д н о й (амидной) связью:
NH2CHCOOH + NH2CHCOOH NH2 CHCONHCHCOOH + H2 O
R R1 R R1
Образование пептидной связи в белках происходит только за счет взаимодействия -аминогруппы и -карбоксильной группы аминокислот. Соединение, образованное в результате конденсации двух аминокислот, называют дипептидом. На одном конце его молекулы находится свободная -аминогруппа, а на другом - свободная -карбоксильная группа. Благодаря этому к дипептиду можно присоединить еще одну аминокислоту и получить трипептид и т.д.
Аминокислотные звенья, входящие в состав пептида называют а м и н о к и с л о т н ы м и остатками.
Д и с у л ь ф и д н а я с в я з ь. Эта прочная ковалентная связь образуется в результате окисления SH-групп двух, рядом расположенных радикалов цистеина:
NHCHCO NHCHCO
CH2 CH2
SH 2Н S


SH + 2Н S
CH2 CH2
NHCHCO NHCHCO
Дисульфидные связи могут возникать как между разными полипептидными цепями, так и между различными участками одной и той же полипептидной цепи.
В о д о р о д н а я с в я з ь. Это особый вид химической связи, в которой атом водорода, ковалентно связанный с одним из электроотрицательных атомов, образует дополнительную связь с соседним электроотрицательным атомом. Известно несколько типов водородных связей:
ОН••••О=С = =NН••••О=С =
ОН••••N = = NН••••О=
ОН••••О= = NН••••N =
Различают межмолекулярные и внутримолекулярные водородные связи.
И о н н а я (солевая) с в я з ь. При определенном значении рН ионизированная аминогруппа может взаимодействовать с ионизированной карбоксильной группой, в результате чего возникает и о н н а я или с о л е в а я связь:
NH NH
CHCH2CH2CH2CH2NH3 •••OOCCH2CH2CH
CO CO
остаток лизина остаток глутаминовой кислоты
Эта связь образуется как между положительно заряженными группами радикалов аминокислот, так и NH2 и СООН - группами свободных концов полипептидных цепей. Ионные связи легко разрываются при изменении рН среды.
Г и д р о ф о б н ы е в з а и м о д е й с т в и я. Это особый вид слабых межмолекулекулярных сил, действующих только между неполярными молекулами (и радикалами) и только в водной среде. Суть гидрофобного взамодействия состоит в том, что две или большее число неполярных групп (например, радикалы валина, лейцина, аланина), сближаясь друг с другом, могут образовывать такую неполярную фазу молекулярного масштаба, из которой вытеснены все молекулы воды.
2.3.2. Пептиды
Аминокислоты, соединяясь друг с другом при помощи пептидных связей, образуют пептиды. По числу аминокислотных остатков, содержащихся в пептиде, различают ди- , три-, тетра-, ... нона-, декапептиды и т.д. Пептиды, в молекулах которых меньше 10 аминокислотных остатков,условно относят к о л и г о п е п т и д а м; пептиды, построенные из большего числа аминокислотных остатков (до 50) - к п о л и п е п т и д а м.
Свободные пептиды обладают высокой биологической активностью. Многие из них служат гормонами (химические вещества, участвующие в регуляции обмена веществ и функционировании органов и тканей), некоторые представлениы сильнейшими ядами (яды змей, жаб, насекомых,высших грибов, микроорганизмов), антибиотиками (химические вещества, вырабатываемые одними микроорганизмами и “убивающие” другие микроорганизмы), регуляторами клеточного деления, регуляторами психической деятельности, переносчиками молекул и ионов через клеточные мембраны.
Приведенная формула соответствует так называемому восстановлен-ному глутатиону (SH-глутатион). В клетках наряду с восстановленным глутатионом всегда присутствует окисленный глутатион (-S-S-глутатион), состоящий из двух молекул восстановленного глутатиона, соединенных дисульфидной (-S-S-)- связью, которая образовалась в результате отнятия от каждой SH-группы по одному водороду:
2 Н
2 Г SHГSSГ
SH - глутатион SS - глутатион
Восстановление окисленного глутатиона происходит за счет источников водорода, вырабатываемых в процессе обмена веществ в организме.
Глутатион - сильный внутриклеточный восстановитель и его основная функция состоит в том, чтобы защитить SH-группы белков от окисления и тем самым сохранить биологическую функцию белков. Глутатион выполняет специфическую роль при восстановлении пероксида водорода и аскорбиновой кислоты, служит небелковой группой отдельных белков - ферментов, играет определенную роль в транспорте аминокислот через мембрану клеток, активирует протеолитические ферменты.
2.3.3. Полипептидная теория строения белков
В последующие годы было предложено еще несколько разнообразных теорий строения белковых веществ, но лишь одна из них - п о л и п е п т и д н а я т е о р и я с т р о е н и я б е л к о в - предложенная Э.Фишером в 1902г., выдержала испытание временем.
Согласно пептидной теории основой структуры белковой молекулы признана полипептидная цепь. Эта цепь построена из нескольких десятков, а иногда и сотен остатков аминокислот, связанных между собой пептидными связями.
В самой общей форме полипетидную цепь можно изобразить следующим образом:
R1 R3
NH2CHCONHCHCONHCHCO............NHCHCOОН
R2Rn
Граница между полипептидами и белками проведена условно. К белкам относят полипептиды с молекулярной массой 6 тысяч и более и числом аминокислотных остатков свыше 50. Такой принцип деления основан на способности к диализу через природные мембраны.
Белковая молекула может состять из одной или нескольких полипептидных цепей. Цепи могут быть соединены между собой ковалентными или нековалентными связями. Белки, состоящие из двух или нескольких полипептидных цепей, не связанных между собой ковалентными связями, называют о л и г о м е р н ы м и. Отдельные полипептидные цепи в таких белках называют п р о т о м е р а м и; функционально активные части белка - с у б ъ е д и н и ц а м и.
2.3.4. Пространственная структура белковой молекулы
Полипептидная цепь нативного белка (белка, сохранившего структуру присущую ему в живой клетке) в нормальных биологических условиях - обычная температура и нейтральные значения рН имеет, как правило, одну к о н ф о р м а ц и ю, называемую н а т и в н о й (натуральной, естественной). Эта нативная конформация достаточно устойчива. Существуют первичная, вторичная, третичная и , введенная в 1958 г. Берналом, четвертичная структура белковой молекулы. Рассмотрим каждую из этих структур. П е р в и ч н а я с т р у к т у р а - это число и последовательность расположенния аминокислотных остатков, образующих полипептидную цепь белковой молекулы. Для первичной структуры характерны только ковалентные связи (включая и дисульфидные мостики) и поэтому ее обозначают как ковалентную структуру.
Белки отличаются друг от друга по первичной струтуре. Соединяя аминокислоты в различном порядке, можно получить почти бесконечное число последовательностей и , значит, почти бесконечное множество разнообразных белков. также идентичны цитохромы С коровы, овцы и свиньи. Следовательно, первичная структура гомологичных белков может быть применена в качестве критерия для установления родства между отдельными видами живых существ.
Первичная структура белков - основа для определения более высоких уровней их пространственной организации.
В т о р и ч н а я с т р у к т у р а - это способ укладки остова (стержня, хребта) полипептидной цепи без учета укладки радикалов. Она включает два различных типа регулярных структур, встречающихся во многих белках: спиральные структуры и структуры складчатого слоя (листа).
Из спиральных структур признанной является -спираль (спираль Полинга и Кори). Она стабилизирована водородными связями, образованными между находящимися поблизости СО и NHгруппами пептидных связей данной полипептидной цепи. При этом кислород каждой СОгруппы образует водородную связь с водородом четвертой по ходу цепи NHгруппой. Благодаря -спирали белковая молекула напоминает растянутую пружину (рис 2.1). Один виток спирали включает 3,6 остатка аминокислот (11 атомов полипептидной цепи), высота одного витка по оси (шаг спирали) равна 0,54 нм, вертикальный прирост, соответствующий одному аминокислотному остатку, составляет 0,15 нм; внутренний диаметр спирали равен 1,01 нм. Водородные связи приблизительно параллельны оси спирали.
Другой тип вторичной структуры - -структура (или структура складчатого листа) стабилизирован водородными связями, возникающими между СО- и NH-группами прилегающих друг к другу различных полипептидных цепей или различных участков одной и той же полипептидной цепи.
Р ис.
2.1. Структура-спирали.
А. Показаны-атомы
углерода. Соединяющая их линия описывает-спираль. Б. Часть-спирали в растянутом
виде. Спираль стабилизирована водородными
связями.
ис.
2.1. Структура-спирали.
А. Показаны-атомы
углерода. Соединяющая их линия описывает-спираль. Б. Часть-спирали в растянутом
виде. Спираль стабилизирована водородными
связями.
В пространственном представлении -структура обнаруживает “плиссированность” (складчатость), причем радикалы аминокислотных остатков стоят попеременно с разных сторон складчатого листа (рис 2.2). В зависимости от взаимного положения атомов в разных цепях или участках одной цепи возможно существование двух типов складчатого листа. Если обе цепи направлены в одну сторону, такое расположение называют п а р а л л е л ь н ы м, если цепи направлены в противоположные стороны - а н т и п а р а л л е л ь н ы м.
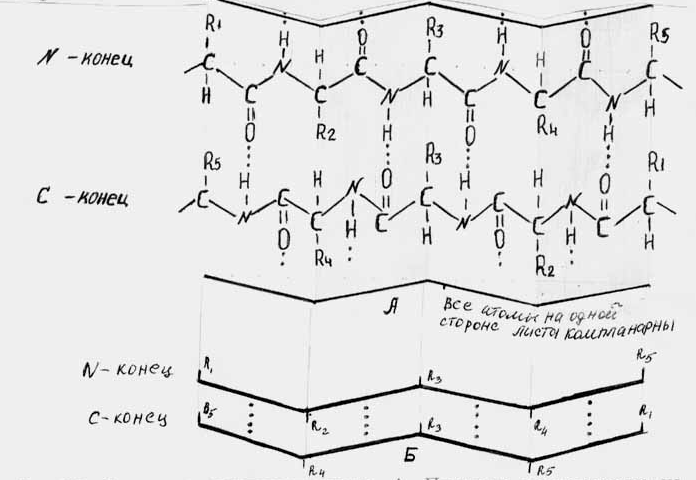
Рис 2.2. Структура складчатого листа.
А.Показано расположение на листах атомов двух антипараллельных полипептидных цепей. Б. Схематическое изображение структуры складчатого листа. Водородные связи между СО- и NH-группами обозначены пунктиром.
Т р е т и ч н а я с т р у к т у р а - это способ компактного расположения в пространстве всех атомов и групп полипептидной цепи, имеющей вторичную структуру. Эта структура трехмерна и характеризует конформацию молекулы белка в целом. В стабилизации третичной структуры участвуют водородные связи как между пептидными группами, так и радикалами аминокислотных остатков, ионные дисульфидные связи, гидрофобное взаимодействие и некоторые другие связи (рис 2.3).
Важное значение в формировании третичной структуры белковой молекулы имеют последовательность аминокислотных остатков полипептидной цепи, размер, форма и полярность радикалов аминокислотных остатков. При формировании третичной структуры большая часть гидрофобных радикалов располагается внутри белковой молекулы; полярные (гидрофильные) радикалы находятся на ее поверхности, т.е. поверхность молекулы белка преимущественно гидрофильна.
Рис 2.3.Схема третичной структуры белка.
1.Водородные связи -структуры. 2.Водородные связи между R-группами аминокислотных остатков. 3. Водородные связи-спирали. 4. Гидрофобные взаимодействия. 5. Солевые (ионные) связи. 6. Дисульфидные связи.
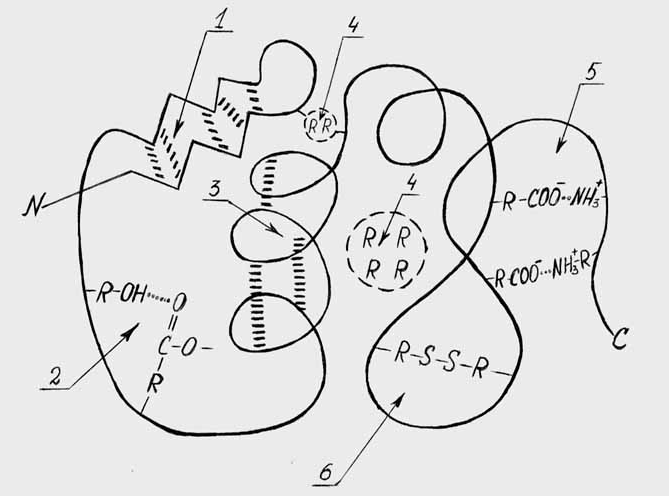
Ч е т в е р т и ч н а я с т р у к т у р а. Белки, имеющие молекулярную массу более 50000 состоят из двух или нескольких отдельных полипептидных цепей и называются л и г о м е р н ы м и. Ранее указывалось, что отдельные полипептидные цепи в таких белках называют п р о т о м е р а м и, а функциональные части - с у б ъ е д и н и ц а м и. Субъединицы могут состоять из одной или более полипептидных цепей. Каждая из полипептидных цепей, образующих субъединицу, характеризуется своей первичной, вторичной и третичной структурами.
Наиболее часто в составе олигомерных белков содержится 2 или 4 протомера, реже - от 6 до 12 или 24 и в редчайших случаях их число может быть нечетным. Между собой отдельные протомеры соединяются водородными, ионными, гидрофобными и другими нековалентыми связями.
Способ совместной упаковки и укладки в пространстве полипептидных цепей олигомерного белка в его нативной конформации называют ч е т в е р т и ч н о й с т р у к т у р о й. Эта структура олигомерных белков определяется первичной структурой, входящих в их состав протомеров.
Классическим примером белка, для которого методом рентгено-структурного анализа М.Перуц и его сотрудники установили третичную и четвертичную структуры, является г е м о г л о б и н. Молекула гемоглобина состоит из четырех полипептидных цепей - двух -цепей (по 141 остатку) и двух -цепей (по 146 остатков аминокислот), каждая из которых связана с небелковым железосодержащим веществом - г е м о м ( рис 2.5). При образовании единой молекулы гемоглобина одинаковые цепи ( - и - ) мало соприкасаются и между ними осуществляется лишь ион-ионное взаимодействие конце-вых групп. В то же время между - и -цепями образуется большое число неполярных и водородных связей. При этом в образовании связей меж-ду 1 и 1 ( 2 и 2 ) димерами участвуют 34 боковых остатака, а между 1 и 2 ( 2 и 1) - лишь 19 остатков.
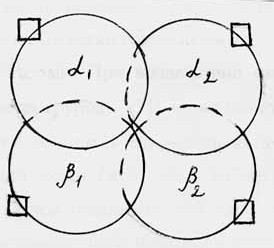
Рис.2.5.Схема строения гемоглобина. Прямоугольником обозначен гем.
То обстоятельство, что крупные молекулы белков состоят обычно из нескольких полипептидных цепей, а не из одной очень длинной цепи, дает ряд преимуществ: при их биосинтезе требуется значительно меньшая генетическая информация (меньший участок структурного гена ДНК), чем при большой одноцепочечной молекуле; сводятся к минимуму появления случайных ошибок при их биосинтезе, становятся возможными регуляторные взаимодействия.
2.4. Физико-химичекие свойства белков
2.4.1. Молекулярная масса белков. Размеры молекул белка
Молекулярные массы белков колеблются от 6 000 (условно принятый нижний предел) до 1 000 000 и выше.
Молекулярные массы белков определяют с помощью специальных методов: по скорости осаждения в центробежном поле, по скорости диффузии белков в растворителе, по осмотическому давлению, на основании рентгеноструктурного анализа и др.
Белки относят к высокомолекулярным соединениям, так как их молекулярные массы колеблются от нескольких тысяч до миллионов. Размеры молекул белков составляют 1- 100 нм и соответствуют размерам частиц высокодисперсных систем. Молекулы белков вследствие необычайно больших размеров называют макромолекулами.
2.4.2. Амфотерные свойства и изоэлектрическая точка белков
Макромолекулы белков несут на своей поверхности большое количество карбоксильных и аминных групп, что придает им свойства амфотерных полиэлектролитов. Карбоксильные группы, способные к диссоциации с образованием протонов (Н+), определяют кислотные свойства молекулы белка; аминогруппы, способные присоединять протоны, определяют ее основные свойства.
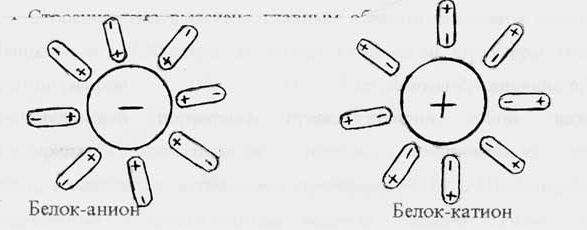
Соотношение между количеством кислых и основных группировок варьирует у различных белков. Белки, в которых преобладают кислые группировки, имеют при рН 7 (или близких к 7) суммарный отрицательный заряд и их называют кислыми; белки, в которых преобладают основные группировки, имеют при указанных значениях рН положительный заряд и их называют основными. В живых организмах преобладают кислые белки.
В растворе молекулы белков могут менять свой заряд в зависимости от рН среды:
+
+
O +
+
NH3 NH3 NH3


 +H+
+ H+
+H+
+ H+
ООС
COO
HOOC
COO
HOOC
COOH
при рН 7 при снижении рН
+ + O
NH3
NH2
NH2


 ++OH
+
+OH
++OH
+
+OH



 ООС
NH3
ООС
NH3
ООСNH2
ООС
NH3
ООС
NH3
ООСNH2
H2OH2O
при рН 7 при увеличении рН
Следовательно, изменяя рН среды добавлением кислот или щелочей, можно не только уравнять положительные и отрицательные заряды на поверхности молекулы белка, но и усилить один из них или изменить на противоположный. В кислой среде молекулы белка приобретают положительный заряд и в поле постоянного электрического тока движутся к катоду; в щелочной среде они приобретают отрицательный заряд и в поле постоянного электирческого тока движутся к аноду. Передвижение заряженных растворенных частиц в поле постоянного электрического тока получило название э л е к т р о ф о р е з а (“движение посредством электрического поля”).
Для каждого белка (равно пептида и аминокислоты) существует рН при котором положительные и отрицательные заряды в молекуле белка уравновешиваются и суммарный заряд ее становится равным нулю. Такая молекула теряет подвижность в электрическом поле. Величина рН, при котором молекула белка не несет суммарного заряда и не движется в электрическом поле, называется и з о э л е к т р и ч е с к о й т о ч к о й (ИЭТ) и обозначается рНJ; это одна из характерных констант белков.
В изоэлектрической точке белок обладает наименьшей растворимостью, легко выпадает в осадок, растворы его менее вязки. Эти явления можно объяснить отсутствием электростатического отталкивания между молекулами белка.
2.4.3. Растворимость и осаждаемость белков
Подавляющее большинство белков обладает гидрофильными свойствами, т.е. способностью легко взаимодействовать с молекулами воды. Гидрофильность белков обусловлена полярными заряженными и полярными незаряженными группами, расположенными на поверхности их молекул. Полярными заряженными группами в молекуле белка являются радикалы лизина, гистидина, аргинина, аспарагиновой и глутаминовой кислот; полярными незаряженными - радикалы серина, треонина, тирозина, цистеина, аспарагина, глутамина и др. Гидрофильные вещества легко растворяются в воде и водных растворах.
Растворимость белков в растворителях неодинакова и зависит от многих факторов: природы, состава и рН растворителя, ионной силы и температуры раствора, структурных особенностей молекулы данного белка и других факторов. В результате чего одни белки хорошо растворимы в воде, другие - в водных растворах нейтральных солей, третьи - в слабых растворах кислот или щелочей, четвертые - в смеси воды и органических растворителей (например, этанола или ацетона). В большинстве чистых органических растворителей белки не растворяются. Среди белков есть и нерастворимые во всех перечисленных растворителях. Это связано с особенностью их структуры.
Большое значение для растворимости белка имеет ионная сила раствора ( в частности, концентрация электролита). При низких ионных силах растворимость белка увеличивается, а при высоких - уменьшается. Зависимость раствримости большинства белков от рН при данной ионной силе описывается U -образной кривой с минимумом растворимости вблизи изоэлектрической точки и увеличенной растворимостью при значениях рН меньше и больше изоэлектрической точки. С повышение температуры до определенной величины (например, от 0 до 25 - 40О С) растворимость большинства белков повышается ( это правило имеет исключение).
При растворении белков в воде и водных растворах происходит гидратация каждой белковой молекулы, т.е. взаимодействие полярных групп белка с водой. При этом например, -СО-NH- группы связывают по одной молекуле воды, карбоксильные группы - по четыре молекулы воды, аминогруппы - по одной молекуле воды.
В результате гидратации вокруг заряженных молекул белка образуется электрозаряженный водный слой (гидратная оболочка), состоящая из молекул воды, ориентированных по отношению к молекуле белка строго определенным образом.
Чем дальше молекулы воды удалены от поверхности молекулы белка, тем беспорядочнее их расположение в растворе. Вокруг электронейтральных молекул белка гидратная оболочка не образуется.
Гидратная оболочка препятствует агрегации белковых частиц и тем самым способствует устойчивсти раствора белка. Таким образом, заряд и гидратная оболочка являются важными факторами, обусловливающими устойчивость белковых растворов.
При осаждении белков необходимо устранить факторы, обусловливающие устойчивость их растворов, т.е. разрушить гидратную оболочку и снять электрический заряд.
Разрушить гидратную оболочку можно прибавлением к раствору белка достаточно больших количеств в о д о о т н и м а ю щ и х (дегидратирующих) веществ, таких как этанол, ацетон, сульфат аммония, нейтральные соли.
Осаждение белка из раствора при добавлении нейтральных солей и сульфата аммония называют в ы с а л и в а н и е м .
Разные белки высаливаются при неодинаковых концентрациях нейтральных солей. Это свойство широко используют для разделения смеси белков.
Электрический заряд можно снять добавлением к раствору белка кислоты или щелочи до рН, равной изоэлектрической точке растворенного белка. Как указывалось выше в изоэлектрической точке отсутствует электростатическое отталкивание между молекулами белка и они легко выпадают в осадок. Поскольку разные белки имеют разные изоэлектрические точки, то их можно отделить друг от друга путем осаждения в изоэлектрической точке.
Наиболее полное осаждение белка может быть достигнуто путем разрушения гидратной оболочки и снятия электрического заряда.
2.4.4. Коллоидные свойства белков
Растворы белков обладают свойствами как истиных, так и коллоидных растворов. Это связано с тем, что белки в растворе диспергированы до единичных молекул, но, вследствие большой молекулярной массы и связанного с ней большого размера частиц (1 - 100 нм), растворы белков имеют коллоидный характер.
Растворы белка, в связи с коллоидным характером, рассеивают свет (явление Тиндаля), характеризуются высокой вязкостью, при определенных условиях могут терять текучесть и образовывать г е л и, или с т у д н и (студни, сформированные из молекул белков, рассматривают как частную форму гелей).
Молекулы белка вследствие большого размера медленно диффундируют в растворе в направлении более низкой концентрации и неспособны проникать через поры искусственных мембран из целлофана, коллодия, пергамента, а также большинства мембран клеток растений и животных. В то же время молекулы низкомолекулярных веществ (вода, этанол, соли, аминокислоты, сахара и т.п.) свободно проходят через такие мембраны.
2.4.5. Денатурация белков
Под денатурацией понимают вызванную различными физическими и химическими факторами утрату молекулой белка присущей ей нативной конформации. Денатурация - характерное свойство белков. При денатурации происходит разрыв нековалентных (в первую очередь водородных) связей в молекуле белка, что сопровождается нарушением четвертичной, третичной и частично вторичной структур белка без каких-либо изменений первичной структуры. Разрыв нековалентных связей приводит к тому, что компактная молекула белка превращается в беспорядочный клубок (рис 2.6).



А Б
