
- •Глава 1. Галоидпроизводные углеводородов
- •Номенклатура алкилгалогенидов, алкенилгалогенидов, алкинилгалогенидов и арилгалогенидов
- •1. Получение алкилгалогенидов
- •1.1. Галогенирование алканов
- •1.2. Присоединение галогеноводородов к алкенам
- •1.3. Замещение гидроксильной группы на галоген.
- •1.4. Свойства Галоидпроизводных углеводородов
- •1.4.1. Реакции нуклеофильного замещения
- •1.4.2. Механизм sn1
- •Дифенилметилгалогенид Трифенилметилгалогенид
- •1.4.3. Механизм sn2
- •1.4.4. Реакции отщепления
- •1.4.5. Реакции алкилгалогенидов с металлами
- •Глава 2. Спирты
- •Номенклатура одноатомных спиртов
- •2.4. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •2.5. Гидролиз алкилгалогенидов
- •2.6. Свойства одноатомных спиртов
- •Температуры кипения некоторых спиртов и изомерных им простых эфиров
- •Кислотно-основные свойства спиртов
- •Кислотность спиртов
- •Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
- •Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
- •Получение алкилгалогенидов из спирта и галогеноводородных кислот
- •Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •Дегидратация спиртов
- •2.10. Образование простых эфиров из спиртов
- •2.11. Получение простых эфиров по Вильямсону
- •2.12. Окисление спиртов
- •Восстановление спиртов
- •Взаимодействие с щелочными и щелчноземельными металлами.
- •2.15. Двухатомные спирты
- •2.16. Получение диолов
- •2.17. Свойства диолов
- •2.21. Расщепление простых эфиров кислотами
- •Глава 3. Тиолы и сульфиды
- •3.1 Получение тиолов
- •3.2 Свойства тиолов
- •Решения некоторых тестовых задач по теме спирты и тиолы
- •Только в реакциях 3) и 4) используются третичные спирты. Поскольку стабильность третичного карбениевого иона бензильного типа выше, чем стабильность третичного карбениевого иона алкильного типа:
- •5. Какого алкена образуется меньше при дегидратации 3-метилгексанола-3?
- •Глава 4. Альдегиды и кетоны
- •Альдегиды классификация
- •Строение карбонильной группы
- •4.1. Реакционные центры в молекулах альдегидов и кетонов
- •4.2. Химические свойства альдегидов и кетонов
- •4.3. Реакции альдегидов и кетонов по механизму нуклеофильного присоединения (an)
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе с последующим отщеплением воды.
- •4.5. Окисление альдегидов и кетонов.
- •4.6. Реакция Канниццаро -Тищенко
- •4.7. Реакции полимеризации.
- •Получение альдегидов и кетонов
- •4.9. Медико-биологическое значение соединений с карбонильной группой
- •Отдельные представители альдегидов и кетонов
- •Эталонное решение задач
1.4.2. Механизм sn1
Общая схема механизма SN1 (символ расшифровывается как замещение нуклеофильное мономолекулярное; замещение по английски substitution) включает две стадии:
1) ионизация алкилгалогенида с образованием карбениевого иона и аниона галогена, это самая медленная стадия
![]()
2) быстрая рекомбинация образовавшегося карбениевого иона с нуклеофи-лом, это быстрая стадия и как правило необратимая.
![]()
1. Уравнение скорости. Поскольку скорость всей реакции определяет стадия ионизации, реакция подчиняется кинетическому уравнению первого порядка:
![]()
Таким образом, скорость ионизации субстрата не должна зависеть от концен-трации нуклеофила.
2. Природа радикала в алкилгалогениде. При прочих равных условиях (один-аковы и галоген и растворитель) ионизация будет происходить тем легче, чем более стабилен образующийся карбениевый ион. В ряду алкильных карбени-евых ионов стабильность возрастает от первичных к третичным ионам вслед-ствие положительного индукционного эффекта алкильных групп.
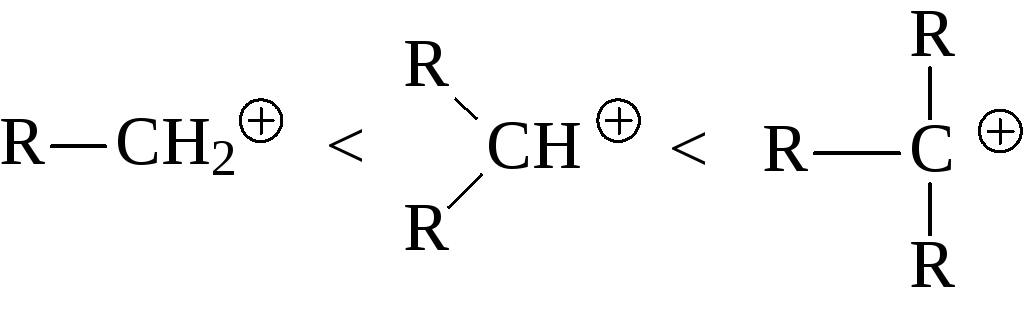
действительно, механизм SN1 характерен только для третичных алкилгало-генидов, в то время как для вторичных и особенно первичных алкилгалоге-нидов более характерен SN2 механизм. Были получены экспериментальные данные, подтверждающие существование третичных и даже вторичных карбениевых ионов в средах с низкой нуклеофильностью, к которым относятся «суперкислоты» (смеси HSO3F и SbF5 или HF и SbF5), однако первичные ионы не существуют даже в этих средах.
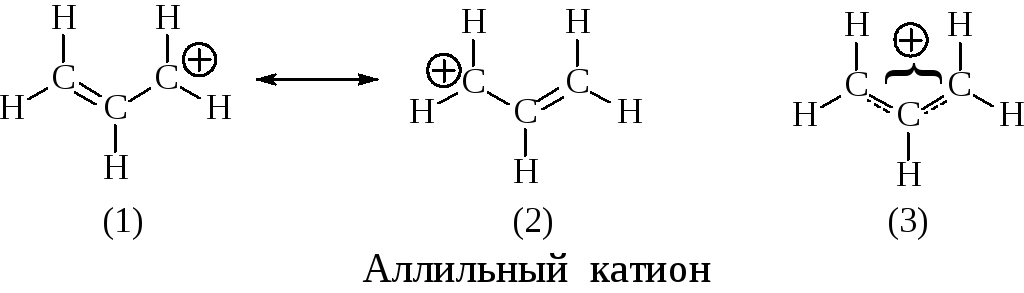
Стабильность карбениевых ионов сильно возрастает, если вместо алкильных заместителей в них присутствуют винильные или фенильные заместители, такие карбениевые ионы относятся к аллильному или бензильному типу. Увеличение стабильности происходит вследствие делокализации заряда за счёт мезомерного эффекта (структуры 1 и 2), а реальный аллильный катион представляет собой симметричную молекулу (структура 3), в которой положительный заряд преимущественно локализо-ван на С1 и С3 атомах углерода.
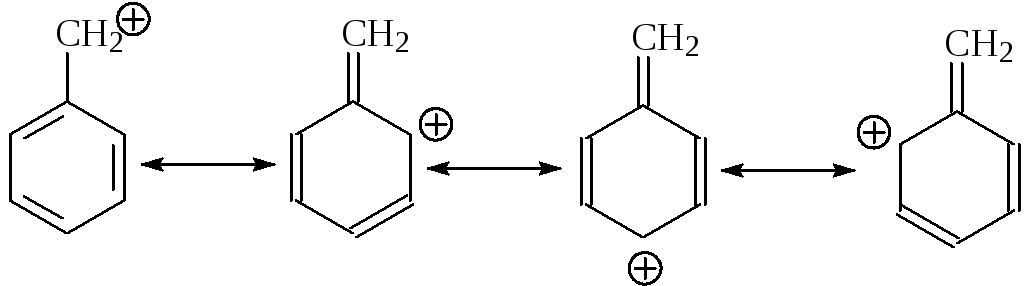
Точно так же объясняется более высокая стабильность бензильного катиона:
Повышенная стабильность этих катионов приводит к тому, что даже вторичные аллил- (CH2=CH–CHR–Hal) и бензилгалогениды (C6H5–CHR–Hal) реагируют с нуклеофилами в соответствии с механизмом SN1. Естественно, что дифенилметил- и трифенилметилгалогениды, из которых могут образо-
C6H5–CHHal–C6H5 (C6H5)3CHal
Дифенилметилгалогенид Трифенилметилгалогенид
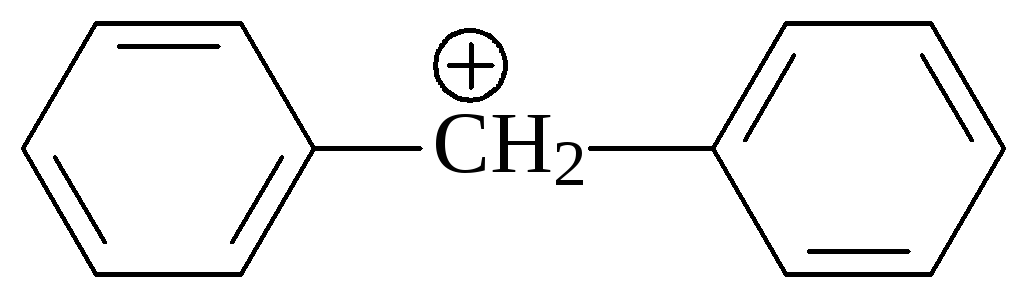
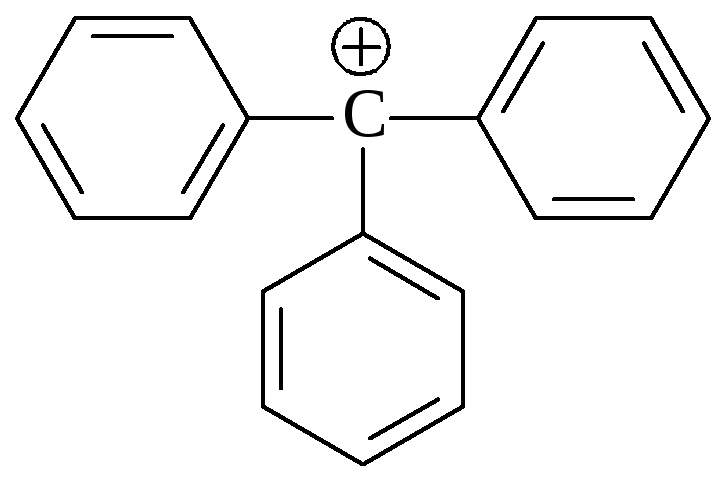
Дифенилметилкарбениевый ион Трифенилметилкарбениевый ион
ваться ещё более стабильные дифенилметил- и трифенилметильные катионы будут также реагировать в соответствии с механизмом SN1.
3) Влияния растворителя. Влияния растворителя на скорость реакции нуклео-фильного замещения может быть рассмотрено на основе простой модели сольватации при учете только электростатического взаимодействия между ионами и молекулами растворителя в исходном и переходном состоянии. В SN1 реакциях (этот термин для краткости далее будет использоваться вместо – в реакциях нуклеофильного замещения, протекающих по механизму SN1) переходное состояние более полярно чем исходный алкилгалогенид
![]()
и увеличение полярности растворителя должно приводить к увеличению скорости нуклеофильного замещения. Полярность растворителя может быть оценена по величине его диэлектрической проницаемости ε; чем больше величина ε, тем больше полярность растворителя. В качестве иллюстрации высказанных выше аргументов в таблице 2 приведены данные по SN1 гидролизу трет-бутилхлорида в водном спирте.
Таблица 2
Зависимость скорости SN1 гидролиза трет-бутилхлорида в водном этиловом спирте от содержания воды
трет-C4H9Cl + H2O → трет-C4H9OH + HCl
|
Содержание воды в спирте (% объёмн.) |
ε растворителя |
Относительная константа скорости |
|
10% |
39 |
1 |
|
20% |
48 |
5.3 |
|
30% |
56 |
23.6 |
|
40% |
61 |
73.7 |
|
50% |
66 |
214.6 |
|
100% |
78.3 |
756.7 |
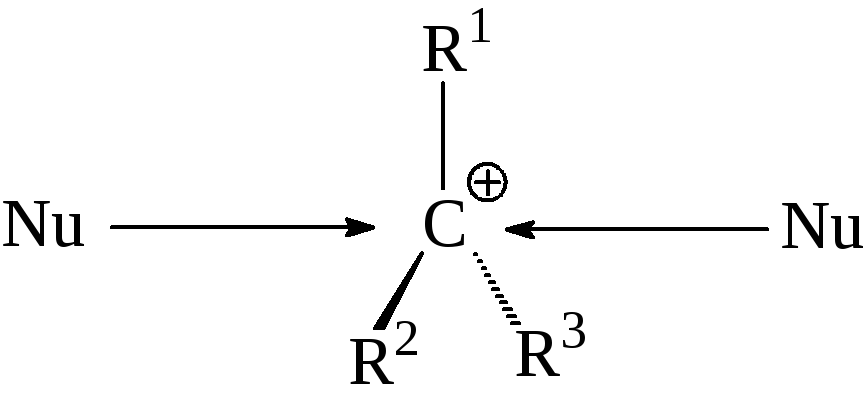
4. Стереохимия. Стереохимия SN1 замещения непосредственно связана с геометрией карбениевого иона. Если карбениевый ион, образующийся при ионизации, достаточно стабилен, он примет наиболее выгодную плоскую конфигурацию, которая ахиральна. Следовательно, стереохимическим результатом SN1 -механизма должна быть рацемизация, т.к. атака нуклеофила с обеих сторон плоской молекулы карбокатиона равновероятна.
5. Влияние уходящей группы. В SN1-реакциях уходящая группа Hal отщепляется вместе со связывающей электронной парой, поэтому следует ожидать определенной корреляции между стабильностью аниона Hal¯ и скоростью реакции. Влияние уходящей группы на скорость SN1 реакций кратко может быть охарактеризовано следующим образом: чем сильнее кислота HHal, тем лучшей уходящей группой является Hal¯. Величины pKa для галогеноводо-родных кислот составляют –11 для HJ, –9 для HBr , –7 для HCl и 3.2 для HF. Таким образом, лучшей уходящей группой должен быть J¯, а худшей - F¯, что и наблюдается на практике.
