
- •Глава 1. Галоидпроизводные углеводородов
- •Номенклатура алкилгалогенидов, алкенилгалогенидов, алкинилгалогенидов и арилгалогенидов
- •1. Получение алкилгалогенидов
- •1.1. Галогенирование алканов
- •1.2. Присоединение галогеноводородов к алкенам
- •1.3. Замещение гидроксильной группы на галоген.
- •1.4. Свойства Галоидпроизводных углеводородов
- •1.4.1. Реакции нуклеофильного замещения
- •1.4.2. Механизм sn1
- •Дифенилметилгалогенид Трифенилметилгалогенид
- •1.4.3. Механизм sn2
- •1.4.4. Реакции отщепления
- •1.4.5. Реакции алкилгалогенидов с металлами
- •Глава 2. Спирты
- •Номенклатура одноатомных спиртов
- •2.4. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •2.5. Гидролиз алкилгалогенидов
- •2.6. Свойства одноатомных спиртов
- •Температуры кипения некоторых спиртов и изомерных им простых эфиров
- •Кислотно-основные свойства спиртов
- •Кислотность спиртов
- •Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
- •Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
- •Получение алкилгалогенидов из спирта и галогеноводородных кислот
- •Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •Дегидратация спиртов
- •2.10. Образование простых эфиров из спиртов
- •2.11. Получение простых эфиров по Вильямсону
- •2.12. Окисление спиртов
- •Восстановление спиртов
- •Взаимодействие с щелочными и щелчноземельными металлами.
- •2.15. Двухатомные спирты
- •2.16. Получение диолов
- •2.17. Свойства диолов
- •2.21. Расщепление простых эфиров кислотами
- •Глава 3. Тиолы и сульфиды
- •3.1 Получение тиолов
- •3.2 Свойства тиолов
- •Решения некоторых тестовых задач по теме спирты и тиолы
- •Только в реакциях 3) и 4) используются третичные спирты. Поскольку стабильность третичного карбениевого иона бензильного типа выше, чем стабильность третичного карбениевого иона алкильного типа:
- •5. Какого алкена образуется меньше при дегидратации 3-метилгексанола-3?
- •Глава 4. Альдегиды и кетоны
- •Альдегиды классификация
- •Строение карбонильной группы
- •4.1. Реакционные центры в молекулах альдегидов и кетонов
- •4.2. Химические свойства альдегидов и кетонов
- •4.3. Реакции альдегидов и кетонов по механизму нуклеофильного присоединения (an)
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе с последующим отщеплением воды.
- •4.5. Окисление альдегидов и кетонов.
- •4.6. Реакция Канниццаро -Тищенко
- •4.7. Реакции полимеризации.
- •Получение альдегидов и кетонов
- •4.9. Медико-биологическое значение соединений с карбонильной группой
- •Отдельные представители альдегидов и кетонов
- •Эталонное решение задач
3.1 Получение тиолов
Наиболее старым методом получения тиолов является замещение галогенид-иона в первичных и вторичных алкилгалогенидах при действием гидросульфид-иона:
![]()
Выходы тиолов, полученных этим способом, часто невысоки, поскольку тиолат-ионы очень легко подвергаются дальнейшему алкилированию, приводящему к образованию диалкилсульфидов R2S. Для подавления этой последующей реакции необходимо использовать большой избыток гидро-сульфида натрия.
3.2 Свойства тиолов
В некоторых реакциях свойства тиолов аналогичны свойствам спиртов. Анионы тиолов вступают в реакцию Вильямсона, приводящую к получению тиоэфиров (сульфидов):
![]()
Тиолат-ионы являются более сильными нуклеофилами, чем алкоголят-ионы, и скорость образования тиоэфиров в 103-104 раза превышает скорость реак-ции для их кислородных аналогов. Это позволяет осуществлять реакцию в мягких условиях.
![]()
Сульфиды также могут быть получены в результате взаимодействия сульфи-да натрия с двумя молями алкилирующего агента или с дигалогенидами, в последнем случае образуется циклический сульфид
![]()
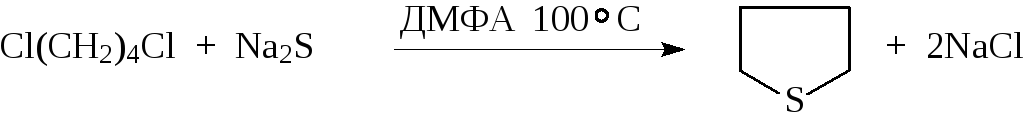
Высокая нуклеофильность атома серы в сульфидах открывает возможность для получения солей сульфония в результате алкилирования сульфидов:
![]()
Подобно своим кислородным аналогам, сульфониевые соли могут быть использованы в качестве алкилирующих агентов в реакциях бимолекулярного нуклеофильного замещения у атома углерода сульфониевой соли:
![]()
Роль уходящей группы в этой реакции играет диметилсульфид.
Наличие нескольких стабильных степеней окисления серы приводит к большему количеству продуктов окисления тиолов по сравнению со спирта-ми. В зависимости от природы окислителя продуктами окисления тиолов являются дисульфиды R-S-S-R, сульфиновые RSO2H или сульфоновые RSO3H кислоты. В отличие от своих кислородных аналогов, органических пероксидов, дисульфиды являются гораздо более устойчивыми соединения-ми, вследствие большей прочности S-S связи по сравнению с O-O связью. Так, в то время как прочность связи S-S в диметилдисульфиде (CH3S-SCH3) составляет 53.8 ккал/мол, в его кислородном аналоге (CH3O-OCH3) она составляет всего 36 ккал/мол.
Образование дисульфидных связей играет важную роль в образовании третичной структуры белка. Дисульфидные связи не определяют характер свёртывания полипептидной цепи, но, несомненно, стабилизируют конфор-мацию молекулы белка после завершения процесса свёртывания. Дисуль-фидные связи образуются самопроизвольно, когда соответствующие тиоль-ные группы оказываются рядом. В общем случае взаимные превращения тиолов и дисульфидов на примере аминокислот цистеина и цистина могут быть представлены следующей схемой:
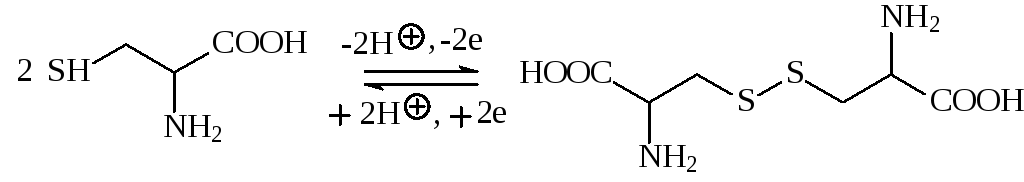
При действии таких окислителей, как йод, бром, пероксид водорода, МnО2, тиолы окисляются до дисульфидов:
![]()
дисульфид
![]()
Дисульфиды легко восстанавливаются до тиолов цинком в уксусной кислоте или растворами щелочных металлов в жидком аммиаке:
![]()
Сильные окислители, такие как азотная кислота или перманганат калия, окисляют тиолы до сульфоновых кислот
![]()
Решения некоторых тестовых задач по теме спирты и тиолы
1. Вторичные одноатомные спирты получают следущим способом:
Восстановлением карбоновых кислот.
При взаимодействии реактивов Гриньяра с кетонами.
При восстановлении кетонов комплексными гидридами металлов.
Присоединением воды к ацетиленам.
Гидролизом третичных галоидпроизводных углеводородов.
Ответ.
Вторичные спирты содержат молекулярный фрагмент :
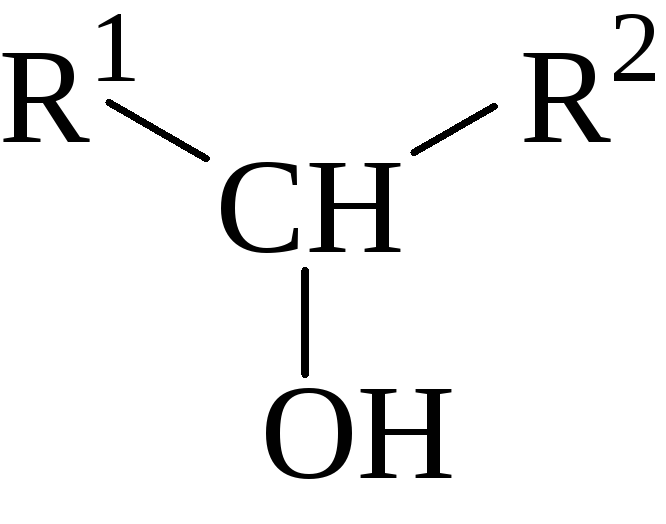
и, таким образом, могут быть получены только при восстановлении кетонов, т.к. способы 2) и 5) приводят к получению третичных спиртов, а способ 1) к получению первичных спиртов; способ 4) вообще не пригоден для получения спиртов.
2. При получении галоидпроизводных углеводородов из спиртов при действии на них галогеноводродных кислот быстрее протекает реакция:
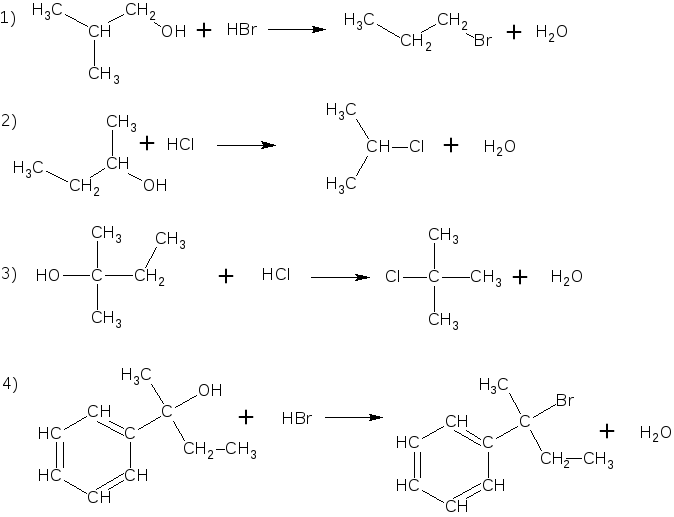
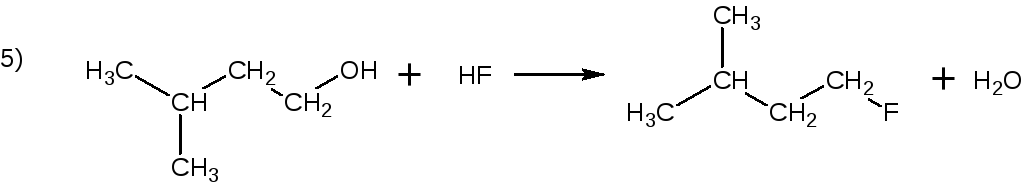
Ответ.
Скорость реакции галогеноводородных кислот со спиртами зависит как от природы кислоты, так и от строения углеводородного радикала спирта. Поскольку эти реакции представляют собой реакции нуклеофильного заме-щения их скорости должны возрастать с увеличением нуклеофильности ани-она кислоты. В водном растворе нуклеофильность анионов возрастает в сле-дующем ряду: F < Cl < Br < J, следовательно, в приведённых примерах ско-рость максимальна для HBr. Замещение гидроксила на галоген в спиртах уве-личивается при переходе от первичных спиртов к третичным. Для третичных спиртов скорость замещения будет зависеть от стабильности соответствую-щего карбениевого иона, т.к. наиболее медленной стадией этой реакции будет являться его образование:
t- ROH + HX → t-ROH2+ + Xˉ (быстро)
t-ROH2+ → t-R+ + H2O (медленно)
t-R+ + X‾ → t-RX (быстро)
