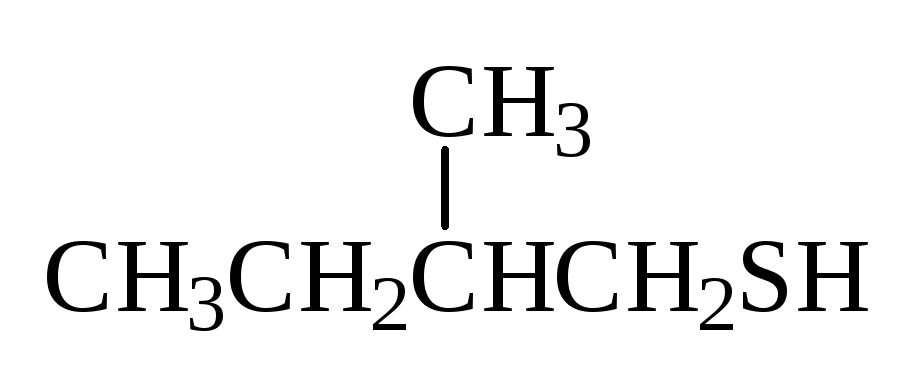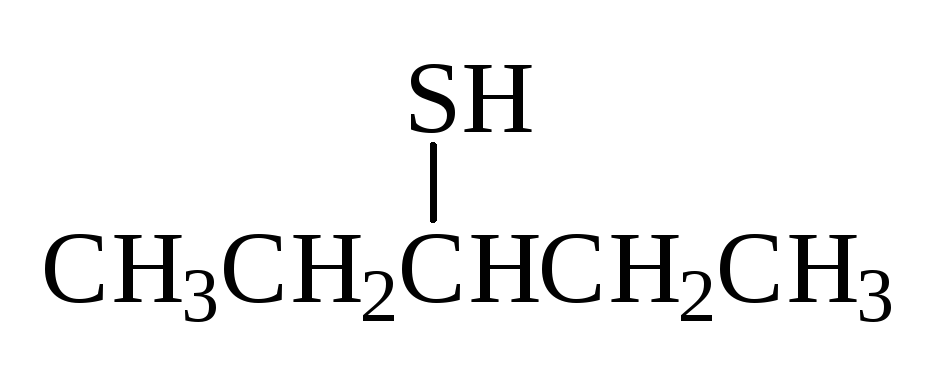- •Глава 1. Галоидпроизводные углеводородов
- •Номенклатура алкилгалогенидов, алкенилгалогенидов, алкинилгалогенидов и арилгалогенидов
- •1. Получение алкилгалогенидов
- •1.1. Галогенирование алканов
- •1.2. Присоединение галогеноводородов к алкенам
- •1.3. Замещение гидроксильной группы на галоген.
- •1.4. Свойства Галоидпроизводных углеводородов
- •1.4.1. Реакции нуклеофильного замещения
- •1.4.2. Механизм sn1
- •Дифенилметилгалогенид Трифенилметилгалогенид
- •1.4.3. Механизм sn2
- •1.4.4. Реакции отщепления
- •1.4.5. Реакции алкилгалогенидов с металлами
- •Глава 2. Спирты
- •Номенклатура одноатомных спиртов
- •2.4. Синтез спиртов из карбонильных соединений с помощью магнийорганических соединений
- •2.5. Гидролиз алкилгалогенидов
- •2.6. Свойства одноатомных спиртов
- •Температуры кипения некоторых спиртов и изомерных им простых эфиров
- •Кислотно-основные свойства спиртов
- •Кислотность спиртов
- •Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
- •Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
- •Получение алкилгалогенидов из спирта и галогеноводородных кислот
- •Получение алкилгалогенидов из спиртов и галогенидов фосфора
- •Дегидратация спиртов
- •2.10. Образование простых эфиров из спиртов
- •2.11. Получение простых эфиров по Вильямсону
- •2.12. Окисление спиртов
- •Восстановление спиртов
- •Взаимодействие с щелочными и щелчноземельными металлами.
- •2.15. Двухатомные спирты
- •2.16. Получение диолов
- •2.17. Свойства диолов
- •2.21. Расщепление простых эфиров кислотами
- •Глава 3. Тиолы и сульфиды
- •3.1 Получение тиолов
- •3.2 Свойства тиолов
- •Решения некоторых тестовых задач по теме спирты и тиолы
- •Только в реакциях 3) и 4) используются третичные спирты. Поскольку стабильность третичного карбениевого иона бензильного типа выше, чем стабильность третичного карбениевого иона алкильного типа:
- •5. Какого алкена образуется меньше при дегидратации 3-метилгексанола-3?
- •Глава 4. Альдегиды и кетоны
- •Альдегиды классификация
- •Строение карбонильной группы
- •4.1. Реакционные центры в молекулах альдегидов и кетонов
- •4.2. Химические свойства альдегидов и кетонов
- •4.3. Реакции альдегидов и кетонов по механизму нуклеофильного присоединения (an)
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе с последующим отщеплением воды.
- •4.5. Окисление альдегидов и кетонов.
- •4.6. Реакция Канниццаро -Тищенко
- •4.7. Реакции полимеризации.
- •Получение альдегидов и кетонов
- •4.9. Медико-биологическое значение соединений с карбонильной группой
- •Отдельные представители альдегидов и кетонов
- •Эталонное решение задач
2.21. Расщепление простых эфиров кислотами
Простые эфиры расщепляются при нагревании до 120-150 °С с концентрированными водными растворами НВr или HI. В таких же жестких условиях расщепляются простые эфиры фенолов:
ROR + HBr → ROH + RBr
C6H5OCH3 + HBr → C6H5OH + CH3Br
Очень легко расщепляются эфиры, содержащие третичную алкильную группу:
![]()
Кислотное расщепление простых эфиров следует рассматривать как типичный случай реакции нуклеофильного замещения у насыщенного атома углерода. В зависимости от природы алкильных групп, связанных с кислородом, реализуется SN2- или SN1-механизм. Если эфир содержит первичные или вторичные алкильные группы, реализуется SN2-механизм, в котором бромид- или йодид-ион атакует протонированную форму эфира по менее замещенному атому углерода:
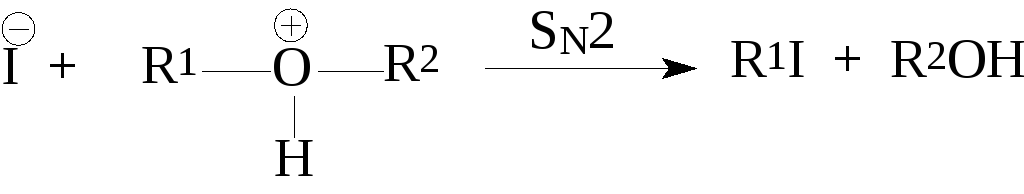
В том случае, когда эфир содержит первичную (R1) и вторичную (R2) алкильные группы, расщепление отличается высокой региоселективностью и, как правило, образуется только один из двух возможных спиртов (вторичный) и только первичный алкилгалогенид. Хлорид- и фторид-ионы в воде сильно сольватированы и обладают низкой нуклеофильностью, поэтому соляная и особенно плавиковая кислоты не пригодны для кислотного расщепления простых эфиров по SN2-механизму.
Простые эфиры, содержащие третичную алкильную, бензильную или аллильную группу, реагируют по SNl-механизму с образованием карбокатиона в качестве промежуточной частицы. Эти реакции идут в очень мягких условиях, а в качестве кислотного агента вместо HI и НВr можно использовать более слабую трифторуксусную кислоту:
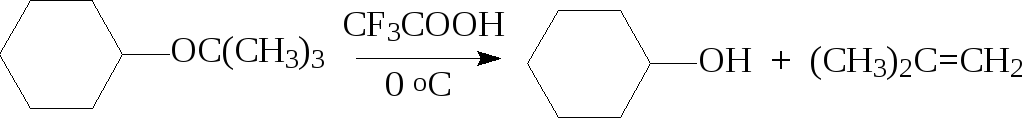
Расщепление эфиров с первичными и вторичными алкильными группами с помощью HI и НВr осуществляется в очень жестких условиях.
Глава 3. Тиолы и сульфиды
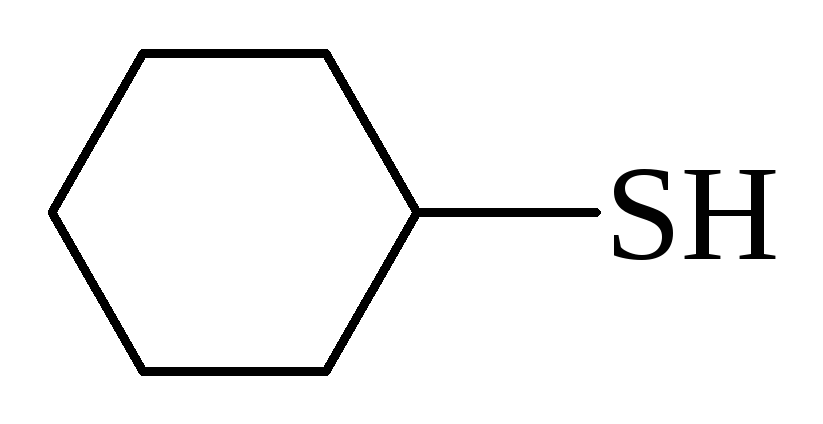
Тиолы RSH и сульфиды R1SR2 следует рассматривать как сернистые производные спиртов и эфиров. Тиолы в номенклатуре IUPAC имеют окончание тиол:
|
2-метилбутантиол-1 |
пентантиол-3 |
|
циклогексантиол |
пропантиол-1 |
Старое название сернистых аналогов спиртов - меркаптаны и SH-группы как меркапто- в настоящее время редко употребляется.
Согласно номенклатуре IUPAC сульфиды называются алкилтиоалка-нами. Префикс алкилтио- подобен префиксу алкокси- в названии простых эфиров. Как и у простых эфиров, большая из алкильных групп дает название главной цепи алкана:
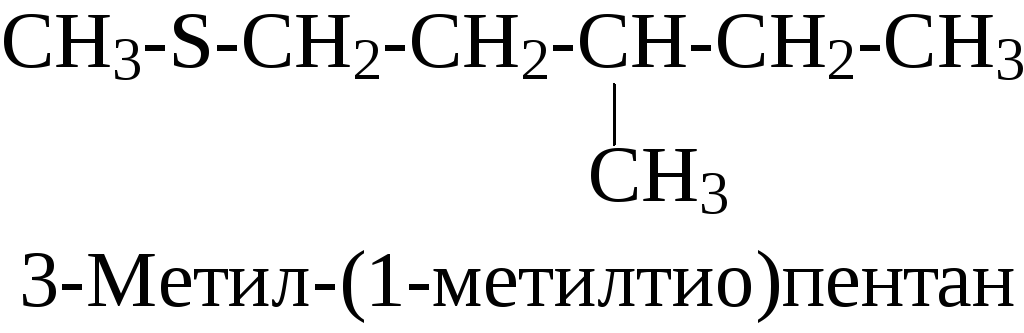
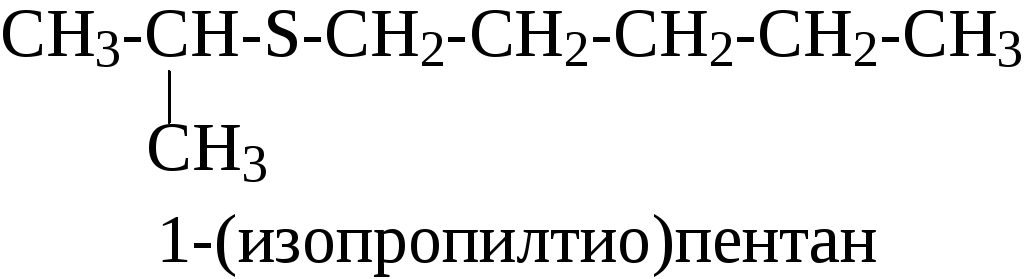
Из курса общей химии известно, что для водородных соединений элементов главных подгрупп с увеличением атомного номера элемента наблюдается уменьшениее прочности связи элемент-водород и уменьшение полярности этой связи, а также увеличение кислотности водородных соединений. Отсюда следует, что 1) тиолы должны быть гораздо менее ассоциированы в жидкой фазе по сравнению со спиртами, вследствие менее прочных водородных связей; 2) тиолы должны быть гораздо более сильными кислотами, чем спирты. В Таблице 3 приведены температуры кипения и величины pKa для низших спиртов и тиолов, которые находятся в соответствии с этими предсказаниями.
Таблица 3
Сравнение свойств спиртов и тиолов
-
Т. кип. °C
pKa
H2O
100
15,7
CH3OH
64
15,5
C2H5OH
78
15,9
изо-C3H7OH
82
17,1
H2S
- 60
7.05
CH3SH
6
10.5
C2H5SH
35
10.6
изо-C3H7SH
60
10.9
Гидроксил-ион практически полностью превращает тиол в тиолат-ион:
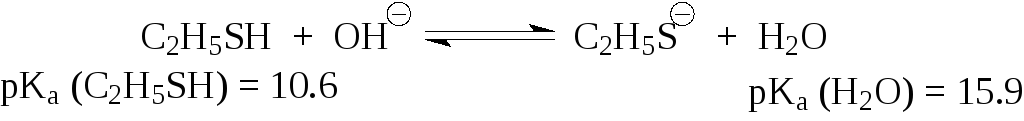
в то время как в случае спиртов, аналогичное равновесие смещено влево.
Отличительной чертой тиолов является отвратительный запах. Челове-ческий нос распознает запах тиола в концентрации 10-7- l0-8 моль/л, которая не достижима для многих спектральных и хроматографических методов. Тиолы в очень низкой концентрации вводят в природный гaз для того, чтобы по запаху можно было определить утечки газа в помещении.