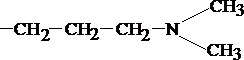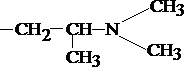- •Токсикологическая химия
- •1. Основы токсикологической химии. Организация и основы судебно-медицинской экспертизы в Российской Федерации
- •2. Биохимическая токсикология
- •2.1. Токсикокинетика чужеродных соединений. Общие закономерности распределения веществ в организме
- •2.2. Метаболизм чужеродных соединений.
- •3. Выделение чужеродных соединений.
- •3. Группа веществ, изолируемых минерализацией («металлические яды»
- •3.1. Общая характеристика группы
- •3.2. Токсидинамика и токсикокинетика металлических ядов
- •3.3.Методы минерализации
- •3.3.1.Методы мокрой минерализации
- •Метод минерализации смесью концентрированных серной, азотной кислот и воды (1:1:1)
- •3.4. Дробный метод анализа «металлических ядов»
- •3.4.1.Маскировка ионов в дробном анализе
- •3.4.2.Применение органических реагентов в дробном анализе "металлических ядов"
- •3.4.3.Применение диэтилдитиокарбаминовой кислоты и её солей
- •3.4.4.Применение дитизона
- •3.6.1.Свинец
- •3.6.2.Барий
- •3.6.3.Марганец
- •3.6.4.Хром
- •3.6.5.Серебро
- •3.6.6.Цинк
- •3.6.7.Медь
- •3.6.10.Ртуть
- •1. Сборка прибора и вытеснение из него воздуха водородом
- •2. Проверка прибора и реактивов на отсутствие мышьяка
- •Современные методы анализа металлов, используеме в аналитической и токсикологической химии (краткий обзор)
- •Группа веществ, изолируемых дистилляцией («летучие яды»)
- •4.1. Общая характеристика группы
- •4.2. Современные методы изолирования «летучих ядов»
- •4.3. Токсикологическое значение некоторых летучих ядов
- •4.3.1.Синильная кислота (цианистый водород, нитрил муравьиной кислоты)
- •4.3.2. Алкилгалогениды
- •4.4.Спирты
- •4.4.2. Химические свойства спиртов. Методы анализа в судебно-химической экспертизе отравлений и экспертизе алкогольного опьянения
- •5. Группа веществ, изолируемых из биологического материала экстракцией и сорбцией (лекарственные и наркотические вещества)
- •5.1.Общая характеристика группы. Номенклатура и классификация веществ
- •5.2. Методы изолирования веществ и их теоретические основы
- •5.2.1.Общие и частные методы изолирования
- •5.3. Аналитический скрининг лекарственных веществ, имеющих токсикологическое значение
- •5.4.1. Барбитураты и методы их исследования
- •1. Коматозное состояние и другие неврологические расстройства (оглушённость, сон, отсутствие рефлексов).
- •5.4.2. Кислота салициловая
- •5.4.3. Антипирин
- •5.4.4. Амидопирин
- •5.4.5. Кофеин
- •5.4.6. Теобромин
- •5.4.7. Теофиллин
- •5.5. Алкалоиды
- •5.5.1. Атропин
- •5.5.2. Скополамин
- •5.5.3. Кокаин
- •5.5.4. Новокаин
- •5.5.5. Дикаин
- •5.5.6. Платифиллин
- •5.5.7. Хинин
- •5.5.8. Резерпин
- •5.5.9. Стрихнин
- •Алкалоиды, производные изохинолина
- •5.5.10.Морфин
- •5.5.11. Кодеин
- •5.5.12. Этилморфин
- •5.5.13. Апоморфин
- •5.5.14. Промедол
- •5.5.15. Папаверин
- •5.5.17. Наркотин
- •5.5.18. Кониин
- •5.5.19. Ареколин
- •5.5.20. Никотин
- •5.5.21. Анабазин
- •5.5.22. Вератрин
- •5.5.23. Эфедрин
- •5.5.24. Производные фенотиазина
- •5.5.25. Производные 1.4-бензодиазепина
- •I этап Гидролиз 1,4-бенз-диазепина
- •II этап Гидролизат
- •III этап Экстракция 1,4-бенздиазепинов из гидролизата
- •IV этап
- •5.6. Аналитическая диагностика острых отравлений, наркотического опьянения. Анализ отдельных групп наркотических средств
- •5.6.1. Понятие о веществах, вызывающих одурманивание
- •5.6.2. Классификация наркотических и одурманивающих веществ
- •5.6.3. Особенности химико-токсикологического анализа на содержание одурманивающих средств
- •5.6.4. Требования, предъявляемые к работе лабораторий, занимающихся анализом наркотических и других одурманивающих веществ
- •5.6.5. Особенности интерпретации результатов при анализе биологических объектов на содержание веществ, вызывающих одурманивание
- •5.6.6. Правила отбора проб на обнаружение наркотических средств, психотропных и других токсических веществ
- •5.6.8. Характеристика биологических объектов. Пробоподготовка
- •5.6.9. Особенности исследования мочи на присутствие наркотиков
- •5.6.10. Экстракция как метод изолирования наркотических и одурманивающих средств. Основные понятия экстракции
- •5.7. Ненаправленный анализ наркотических и одурманивающих веществ
- •5.8. Химико-токсикологический анализ отдельных групп наркотических и одурманивающих веществ (направленный анализ)
- •5.8.1. Производные барбитуровой кислоты
- •5.8.2.Алкалоиды группы опия
- •5.8.3. Производные 1,4-бензодиазепина
- •5.8.4. Производные фенотиазина
- •5.8.5. Каннабиноиды
- •5.8.6. Кокаин
- •5.8.7. Амитриптилин
- •5.8.8. Димедрол (дифенгидрамин)
- •5.8.9. Промедол
- •5.8.10. Эфедрин, эфедрон
- •6. Группа веществ, изолируемых экстракцией и сорбцией. Пестициды
- •6.1. Пестициды как химические загрязнители
- •7. «Химико - токсикологический анализ веществ, изолируемых из объекта настаиванием с водой, с последующим диализом а также требующих или нетребующих особых методов изолирования»
5.5.24. Производные фенотиазина
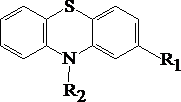
Таблица 4. Производные фенотиазина
|
Исследуемое вещество |
R1 |
R2 |
|
Аминазин |
Cl |
|
|
Дипразин |
H |
|
|
Этаперазин |
H |
|
|
Трифтазин |
CF3 |
|
Физико-химические свойства
Представляют собой белые или желтоватые кристаллические порошки, хорошо растворимые в воде и этаноле, получаемые синтетическим путем. Они экстрагируются органическими растворителями из щелочных водных растворов.
Основной характер производных фенотиазина обусловлен наличием в структуре молекулы гетероциклического атома азота (с рКа 4) и третичного атома азота в алифатическом радикале (рКа 9,1-9,8).
При взаимодействии с кислотами фенотиазины образуют соли, легко растворимые в воде, спирте, хлороформе, но практически нерастворимые в эфире и бензоле.
Основания представляют собой сиропообразную массу, нерастворимую в воде, но растворимую а спирте, эфире, хлороформе, этилацетате.
Логарифм распределения (log P) основания аминазина в системе октанол-вода и хлороформ-вода соответственно равны 5,16 и 1,09, хлористоводородной соли аминазина – 1,51 и 1,22. Для дипразина log P в системе циклогексан-вода и хлороформ-вода – 1,5 и 1,22.
Абсорбция производных фенотиазина в УФ-области спектра характеризуется наличием 2 максимумов: λ мах. 1. 250-260 нм (ε 35000); 2. 300-315 нм (ε 4500)
Сравнение УФ-спектров солей производных фенотиазина со спектрами их оснований показывает, что они практически идентичны. Следовательно, их УФ-спектры отражают только электронную структуру фенотиазиновой части молекулы (хлорпромазин, прометазин).
Исключение представляют те производные, которые во 2-ом положении содержат радикалы со свободными n-электронами (тиоридазин, левомепромазин).
Сульфоксиды фенотиазинов имеют в отличие от нативных (основных) соединений 4 максимума в УФ-области: 230,265,285 и 400 нм.
Фармакокинетика
Всасываются фенотиазины как вещества основного характера преимущественно из кишечника. Гидрофобный характер оснований фенотиазинов способствует взаимодействию их с белками. Кажущийся объем, распределения (Vр) приближается к 100%, поэтому, фенотиазины локализуются в тканях органов (мозг, печень, почки). Выводятся почками, в моче обнаруживается в основном в виде метаболитов.
Метаболизм фенотиазинов протекает в 3-х направлениях:
1 путь - трансформация в радикалах R1 и R2
а) N-O-S-деметилирование, которое приводит к увеличению полярности соединений;
б) окисление N10-боковой цепи.
![]()
2 путь - окисление гетероциклического атома серы в сульфоксид или сульфон Сульфоокисление - образование сульфоксидов со степенью окисления 4 и 6.
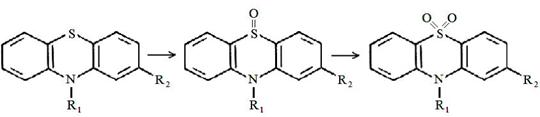
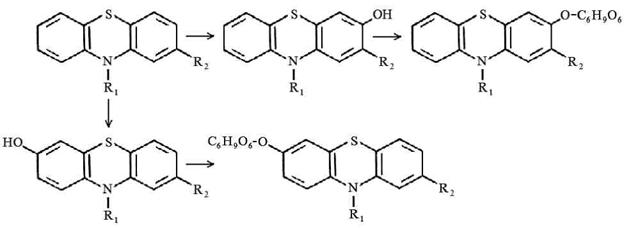
3 путь - ароматическое гидроксилирование в положениях 3, 6 с последующим конъюгированием с глюкуроновой кислотой.
Токсическая доза для производных фенотиазина в среднем колеблется от 15 до 150 мг/кг.
Анализ фенотиазинов.
Обнаружение проводят по общей схеме идентификации лекарственных соединений:
1. Реакции осаждения
Как соединения, содержащие гетероциклический атом азота, фенотиазины образуют с общеалкалоидными осадочными реактивами как простые (с пикриновой и пикролоновой кислотами), так и комплексные соли (с солью Рейнеке, с солями висмута и золота). Наиболее часто используется для обнаружения веществ основного характера раствор йода в йодиде висмута (р-в Драгендорфа).
2. Микрокристаллические реакции: аминазин и дипразин с 5% р-ром хлорного золота образуют характерные кристаллические осадки. Большинство фенотиазинов дают кристаллические осадки с солью Рейнеке, однако дифференциация отдельных представителей этой группы по форме кристаллов затруднительна.
3. Реакции окрашивания
В основе реакций окрашивания лежат следующие химические процессы: - дегидрирование в присутствии кислот (конц. серная кислота);
- каталитическое окисление (HClO4+ NaNO2, р-в Фреде, р-в Манделина и др.);
- конденсация с альдегидами в присутствии водоотнимающих средств (р-в Марки);
- окисление солями металлов с высшей степенью валентности и HPtCl4).
Таблица 5. Реакции окрашивания производных фенотиазина
|
Название препарата |
H2SO4 к. |
HClO4 + NaNO2 |
H2SO4 к. + формальдегид |
10% р-р H2PtCl6 |
|
Хлорпромазин |
малиновое |
малиновое |
розово-малиновое |
сиреневое с фиолетовым осадком |
|
Прометазин |
малиновое |
розово-малиновое |
желто-оранжевое |
серо-синее с розовым осадком |
|
Тиоридазин
|
бледно-голубое |
зелено-голубое |
цвет морской волны |
бледно-сиреневое |
|
Левомепромазин |
фиолетовое |
фиолетовое |
фиолетовое |
ярко-зеленое |
ГХ-анализ
Разделение производных фенотиазина проводят на фазе средней полярности OV-225 (3-5% на хроматоне), в стеклянных микроколонках длиной 1-2 м при 200-250оС. Температура инжектора 250-300оС. Детектор азотнофосфорный (чувствительность 0,006 мкг/мкл), а для хлорсодержащих – по захвату электронов (чувствительность – 0,001). Внутренний стандарт - имизин.
Фотометрия в видимой области спектра
В основу этих методов положено измерение поглощения окрашенных продуктов реакции производных фенотиазина:
- с конц. H2SO4 – эта методика нашла наиболее широкое применение. Недостаток метода – возможность обугливания при наличии соэкстрактивных веществ, особенно при использовании гнилостно-разложившегося биологического материала (аминазин, дипразин);
- с реактивом Манделина и конц. H2SO4. Методика используется для производных фенотиазина, которые с конц. H2SO4 дают нестабильное окрашивание с невоспроизводимыми значениями оптической плотности (тиоридазин, левомепромазин);
- с 18% р-ром кислоты соляной и 1 м р-ром кислоты мышьяковой.Реакция не уступает по чувствительности первым двум методам, однако мягкие условия окисления исключают возможность обугливания соэкстрактивных веществ (тиоридазин, френолон).
Фотометрия в УФ-области спектра
Этот метод требует высокой степени очистки извлечения и обычно сочетается с ТСХ. Измерение проводят при λмах 250-255нм в раствора 0,5 М. H2SO4. Из биологического материала производные фенотиазина (соединения основного характера) выделяют этиловым спиртом, подкисленным 10%-м спиртовым раствором кислоты щавелевой (рН=2-3), очищают жидкость-жидкостной экстракцией. Анализ проводится, как и в случае 1,4-бензодиазепинов, – деструкция при 100-120 0С в течение 30-60 мин в среде 6 М. HCl, затем - экстракция в органический растворитель или метод Стаса-Отто.
Изолирование из мочи и крови
Раздельно 5-10 мл мочи и 2 мл крови подщелачивают 50% раствором едкого натра до рН 13 и смесь кипятят в течение 10 минут на водяной бане. Полученный гидролизат охлаждается до комнатной температуры и дважды (по 20 мл) извлекается н-гептаном, содержащим 3% изоамилового спирта. Гептановые извлечения из мочи объединяют, промывают водой, насыщенной гептаном и делят на две равные части. В одной части проводится обнаружение производных фенотиазина методом тонкослойной хроматографии в системах 3 и 4, а в другой – количественное определение. Экстракт из крови полностью расходуется на количественное определение, т.к. содержит меньшее количество соэкстрактивных веществ.
Хроматографичесткая очистка и обнаружение в тонких слоях
Из аликвоты органического экстракта удаляют в токе теплого воздуха органический растворитель. Сухой остаток растворяют в 0,2-0,5 мл хлороформа и полученный раствор поровну наносят на две пластинки «Силуфол». В качестве метчиков наносят аминазин (обязательно) и те производные фенотиазина, которые были обнаружены в процессе предварительного исследования. Хроматографирование проводят в системе 1 и 2. Длина пробега – 10 см. Одну пластинку опрыскивают раствором конц. H2SO4 в этаноле (1:9) и при положительном результате на второй пластинке обнаружение проводят прокапыванием реактивом Марки.
Таблица 6. Величины и окраски пятен производных фенотиазина
|
Соединение |
Детекция |
Системы растворителей | ||
|
конц. H2SO4 в этаноле (1:9) |
реактив Марки |
1 |
2 | |
|
Rst |
Rst | |||
|
Аминазин
Дипразин
Динезин
Пропазин
Левомепромазин
Мажептил
Мепазил
Трифтазин
Этаперазин
Френолон |
темно-красное
темно-красное
красное
красное
голубое
красное
красное
красное
темно-красное
красное |
темно-красное
темно-красное
красное
красное
голубое
красное
красное
красное
темно-красное
красное |
1,00
0,74
2,10
1,29
1,56
0,08
1,47
0,48
0,34
1,71 |
1,00
2,95
2,95
1,08
1,87
0,13
1,60
0,26
0,48
3,21 |
Система 1: бензол-диоксан-25% аммиак – (60:35:5)
Система 2: этилацетат-ацетон-25% аммиак в этаноле (1:1) – (50:45:5)
Качественное обнаружение
1. С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты получаются аморфные осадки.
2. С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание.
При отрицательном результате двух первых реакций можно сделать заключение о необнаружении аминазина.
3. С формалинсерной кислотой аминазин дает пурпурно-красное окрашивание, усиливающееся при стоянии.
4. С концентрированной азотной кислотой возникает быстро исчезающее пурпурно-красное окрашивание.
5. С 5% раствором золотохлористоводородной кислоты (после 3—4-кратной обработки остатка основания аминазина 0,1 М. раствором НС1) выделяется темно-красный аморфный осадок, переходящий через 20-50 минут в характерный кристаллический. Кристаллы в виде палочек и сростков из них, напоминающих снопы и сфероиды. Кристаллы оптически активны, погасание косое, угол погасания 20-30°, удлинение кристаллов положительное.
Количественное определение
Количественное определение производных фенотиазина проводится без предварительной хроматографической очистки и разделения только в случае, когда установлено отсутствие в биообъекте других веществ основного характера. При их наличии для количественного определения производных фенотиазина проводят хроматографическую очистку методом ТСХ. Для этого на хроматографическую пластинку на стартовую линию, наносят в виде сплошной полосы шириной 1 см всю аликвоту экстракта для количественного определения к хроматографируют в системе 2. По окончании хроматографирования в УФ-свете отмечают зону соединения с соответствующим Rf, параллельно метчикам, снимают слой сорбента, содержащего соединение скальпелем в пробирку. Элюирование проводят 10 мл раствора 25% аммиака в этаноле (1:1) элюат отделяют фильтрованием через стеклянный фильтр № 4, упаривают досуха в токе холодного воздуха. Сухой остаток растворяют в 5 мл 0,1 М. раствора HCl, затем добавляют 4 мл 0,01 М. НCl.
В случае отсутствия других веществ основного характера вторую часть гептанового извлечения (кровь, моча) реэкстрагируют 5 мл 0,1 М. HCl, а затем 4 мл 0,01 М. НCl. Солянокислые растворы объединяют.
К объединенному солянокислому раствору добавляют 12 мл ацетатного буферного раствора (рН 3,5), 2 мл насыщенного раствора метилоранжа и 5 мл хлороформа. Полученная смесь взбалтывается в делительной воронке – при наличии производных фенотиазина хлороформный слой окрашивается в желтый цвет (гелиантаты производных фенотиазина, извлекаемые хлороформом). Хлороформный слой отделяется и определяется оптическая плотность окрашенного раствора (фотоэлектроколориметр ФЭК-56 и др., кювета 10 мм, светофильтр синий с максимумом пропускания при 400 нм).
Для построения калибровочной кривой готовят стандартные растворы в 0,01 М. НСl производных фенотиазина с содержанием 1,2-10 мкг/мл производных: фенотиазина и исследуют их вышеприведенной процедурой. На основании результатов определения оптической плотности строится калибровочный график. Вышеприведенным методом изолируется до 60% производных фенотиазина из крови и до 80% из мочи.
Количественное определение аминазина и его метаболитов
1. Фотоколориметрическое определение основано на реакции с концентрированной серной кислотой. Фотометрирование проводят при λ = 508 нм; эталон сравнения – контрольный опыт. Расчет содержания аминазина и его метаболитов производится по калибровочному графику.
2. Спектрофотометрическое обнаружение. Ультрафиолетовый спектр снимается в диапазоне длин вол 220-400 нм на СФ-4, СФ-4А и др. при концентрации 10 мкг/мл в пересчете на основание.
Максимумы абсорбции неизмененного аминазина при λmax = 254-255 нм (макс.) и λmin = 300-305 нм (мин). Неизмененный аминазин обычно обнаруживается в желудке и желудочно-кишечном тракте и их содержимом. Основной метаболит – сульфоксид – имеет максимумы абсорбции при длинах волн 238-240, 273; 298 и 340 нм. Химико-токсикологическим анализом по описанной методике обнаруживается 53-60% аминазина, добавленного к органам. Граница обнаружения 0,2 мг, граница определения 0,5 мг аминазина в 100 г органов.
Обнаружение фенотиазинов
Фенотиазины часто обнаруживают с помощью тонкослойной хроматографии щелочных экстрактов мочи, но при пероральном поступлении в организм специфическая идентификация этого соединения может оказаться невозможной, если для анализа имеется только моча. Фенотиазины, принимаемые в низких дозах, например флуфеназин, невозможно обнаружить в моче ни одним из известных методов.
Качественный анализ
а) Реакции осаждения - общеалкалоидные осаждающие реактивы (часто реактив Драгендорфа) +соль Рейнеке, Bi, Au.
б) Микрокристаллические реакции - 5% раствор хлорного золота дает характерные кристаллические осадки +соль Рейнеке дает характерные кристаллические осадки
в) Реакции окрашивания:
1) Дегидрирование в присутствии концентрированных кислот (H2SO4):
Элениум – малиновое окрашивание; Тиоридазин – голубое; Левомепромазин – фиолетовое.
2) Каталитическое окисление (HСlO4+NaNO2, реактив Фреде, реактив Манделина): Элениум – малиновое окрашивание; Тиоридазин – зеленовато-голубое; Левомепромазин – фиолетовое.
3) Конденсация с альдегидами в присутствии водоотнимающих средств (реактив Марки):
Элениум – розово-малиновое окрашивание; Тиоридазин – цвет морской волны; Левомепромазин – фиолетовое.
4) окисление солями металлов, имеющих высшую степень окисления (FeCl3 и HPtCl4)
В основе теста лежит реакция многих из этих соединений с ионами трехвалентного железа в кислой среде. Предпринимается для исследования мочи, содержимого желудка и остатков веществ с места происшествия.
а) Реактив FPN (FeCl3+ HClO4+ HNO3). Цвета, варьирующие от розового, красного или оранжевого до фиолетового или синего, могут свидетельствовать о присутствии фенотиазинов или их метаболитов. Моча пациентов, регулярно принимающих в лечебных целях традиционные фенотиазины, например хлорпромазин, обычно дает положительную реакцию. Чувствительность Хлорпромазин, 25 мг/л.
б) Элениум + HPtCl4 → фиолетовый осадок; Тиоридазин – серо-розовый осадок; Левомепромазин –ярко-зеленое окрашивание.
г) Газохроматографический анализ (ГХ)
Разделение ведут в среднеполярной фазе OV-225 на хроматоне в стеклянных микроколонках l = 1-2 м при температуре 200-250 оС, температура инжектора 250-300 оС. Детектор – азотно-фосфорный; для хлорсодержащих фенотиазинов – по захвату электрона. Внутренний стандарт – имизин.
д) Фотометрия в видимой области
В основе – получение окрашенного раствора (с кислотой H2SO4, с реактивом Манделина, с 18% HCl и 1М раствором мышьяковой кислоты).
е) Фотометрия в УФ области спектра.
Метод требует высокой очистки (сочетание с ТСХ). Измерение ведут в растворе 0.5 М H2SO4 (λmax=250–255 нм)
Пример. Краткая информация для составления схемы ХТА аминазина.
Аминазин относится к производным фенотиазина. Является веществом основного характера. Аминазин всасывается преимущественно из кишечника. Локализуется в тканях мозга, печени, почек. Выводится почками, в моче обнаруживается в основном в виде метаболитов.
Метаболизм протекает в трех направлениях:
1. Окисление N10 – боковой цепи.
- CH2-CH 2-CH2-N( CH3 )2 → CH2-CH2-CH2-NH2 → дезаминирование.
2. Сульфоокисление.
3. Ароматическое гидроксилирование в 3 и 6 положениях с последующим коньюгированием с глюкуроновой кислотой.
Объекты для исследования:
1. Промывные воды желудка (если токсикант был принят внутрь, то промывные воды будут содержать его следы);
2. Желудок с содержимым, кишечник с содержимым (обнаруживаются остатки токсиканта, не успевшие всосаться в кровь);
3. Части печени, почек (аминазин метаболизируется в печени, частично выводится почками).
Аминазин относится к группе веществ, изолируемых подкисленным спиртом или подкисленной водой. Изолирование аминазина и его метаболитов рекомендуется производить спиртом, подкисленным до рН 2,0 - 3,0 10% раствором щавелевой кислоты, с последующей экстракцией основания эфиром при рН 13,0 и реэкстракцией вещества в 0,5 н раствор серной кислоты (изолирование по Е.М. Саломатину). Аминазин является соединением со слабыми основными свойствами, так как содержит в структуре третичный атом азота и при подкислении переходит в хорошо растворимую в воде и спирте ионизированную форму:
- при последующем повышении pH до 13,0 солевая форма переходит обратно в неионизированную форму, которая легко экстрагируется в эфир.
- при последующей реэкстракции раствором серной кислоты снова образуется протонированная форма аминазина.
Таким образом, за счет многократной реэкстракции происходит выделение анализируемого вещества и очистка от примесей.
Аналогично протекает извлечение из биологического материала основного метаболита аминазина – его сульфоксидного производного:
Также изолирование производных фенотиазина можно проводить путем экстракции из биологического материала подкисленной водой с последующей экстракцией органическим растворителем (диэтиловый эфир, хлороформ) из этого раствора, подщелоченного с помощью 25% раствора аммиака.
Предварительные испытания. В качестве предварительных испытаний на аминазин могут быть рекомендованы качественные реакции:
• С растворами йодида висмута в йодиде калия и фосфорно-молибденовой кислоты производные фенотиазина дают аморфные осадки
• С концентрированной серной кислотой возникает устойчивое пурпурно-красное окрашивание
• С формалином и серной кислотой производные фенотиазина дают пурпурно-красное окрашивание, усиливающееся при стоянии
• С концентрированной азотной кислотой возникает пурпурно-красное окрашивание (образование сульфоксида), которое быстро исчезает (образование сульфона).
• С 5% раствором золотохлористо-водородной кислоты аминазин (после 3-4 кратной обработки основания 0,1 М. раствором HCl) выделяется темно-красный аморфный осадок, переходящий через 20-50 мин. в характерный кристаллический осадок. Кристаллы в виде палочек и сростков из них, напоминают снопы и сфероиды. Кристаллы оптически активны (погасание косое, угол погасания 20-300, удлинение кристаллов положительное).
• С реактивами Марки и Фреде окраска производных фенотиазина — от красной до фиолетовой.
• С реактивом Манделина тизерцин дает красно-фиолетовую окраску; дипразин дает зеленую, переходящую в пурпурную окраску. Окраска у других производных фенотиазина — от красной до фиолетовой.
ТСХ-обнаружение
Для этого на хроматографическую пластинку стеклянным капилляром наносят каплю исследуемого раствора. Нанесенное пятно подсушивают на воздухе. Рядом наносят растворы известных препаратов, производных фенотиазина («свидетели») и вновь подсушивают пластинку. Затем пластинку вносят в камеру для хроматографии, насыщенную парами растворителя (смесь 25% раствора аммиака и этилового спирта в соотношении 1:1, либо 25% раствора аммиака, этилацетата и ацетона 4:90:45). После хроматографирования в указанных системах растворителей пластинку проявляют 50% раствором серной кислоты в этиловом спирте. Затем пластинку помещают на 3-5 мин в сушильный шкаф, нагретый до 1000С. Измеряют значение Rf проявившихся пятен, сравнивают их с Rf пятен «свидетелей» или со справочными значениями Rf. Аминазину соответствует значение Rf 0,35 во второй из приведенных выше систем растворителей.