
- •Токсикологическая химия
- •1. Основы токсикологической химии. Организация и основы судебно-медицинской экспертизы в Российской Федерации
- •2. Биохимическая токсикология
- •2.1. Токсикокинетика чужеродных соединений. Общие закономерности распределения веществ в организме
- •2.2. Метаболизм чужеродных соединений.
- •3. Выделение чужеродных соединений.
- •3. Группа веществ, изолируемых минерализацией («металлические яды»
- •3.1. Общая характеристика группы
- •3.2. Токсидинамика и токсикокинетика металлических ядов
- •3.3.Методы минерализации
- •3.3.1.Методы мокрой минерализации
- •Метод минерализации смесью концентрированных серной, азотной кислот и воды (1:1:1)
- •3.4. Дробный метод анализа «металлических ядов»
- •3.4.1.Маскировка ионов в дробном анализе
- •3.4.2.Применение органических реагентов в дробном анализе "металлических ядов"
- •3.4.3.Применение диэтилдитиокарбаминовой кислоты и её солей
- •3.4.4.Применение дитизона
- •3.6.1.Свинец
- •3.6.2.Барий
- •3.6.3.Марганец
- •3.6.4.Хром
- •3.6.5.Серебро
- •3.6.6.Цинк
- •3.6.7.Медь
- •3.6.10.Ртуть
- •1. Сборка прибора и вытеснение из него воздуха водородом
- •2. Проверка прибора и реактивов на отсутствие мышьяка
- •Современные методы анализа металлов, используеме в аналитической и токсикологической химии (краткий обзор)
- •Группа веществ, изолируемых дистилляцией («летучие яды»)
- •4.1. Общая характеристика группы
- •4.2. Современные методы изолирования «летучих ядов»
- •4.3. Токсикологическое значение некоторых летучих ядов
- •4.3.1.Синильная кислота (цианистый водород, нитрил муравьиной кислоты)
- •4.3.2. Алкилгалогениды
- •4.4.Спирты
- •4.4.2. Химические свойства спиртов. Методы анализа в судебно-химической экспертизе отравлений и экспертизе алкогольного опьянения
- •5. Группа веществ, изолируемых из биологического материала экстракцией и сорбцией (лекарственные и наркотические вещества)
- •5.1.Общая характеристика группы. Номенклатура и классификация веществ
- •5.2. Методы изолирования веществ и их теоретические основы
- •5.2.1.Общие и частные методы изолирования
- •5.3. Аналитический скрининг лекарственных веществ, имеющих токсикологическое значение
- •5.4.1. Барбитураты и методы их исследования
- •1. Коматозное состояние и другие неврологические расстройства (оглушённость, сон, отсутствие рефлексов).
- •5.4.2. Кислота салициловая
- •5.4.3. Антипирин
- •5.4.4. Амидопирин
- •5.4.5. Кофеин
- •5.4.6. Теобромин
- •5.4.7. Теофиллин
- •5.5. Алкалоиды
- •5.5.1. Атропин
- •5.5.2. Скополамин
- •5.5.3. Кокаин
- •5.5.4. Новокаин
- •5.5.5. Дикаин
- •5.5.6. Платифиллин
- •5.5.7. Хинин
- •5.5.8. Резерпин
- •5.5.9. Стрихнин
- •Алкалоиды, производные изохинолина
- •5.5.10.Морфин
- •5.5.11. Кодеин
- •5.5.12. Этилморфин
- •5.5.13. Апоморфин
- •5.5.14. Промедол
- •5.5.15. Папаверин
- •5.5.17. Наркотин
- •5.5.18. Кониин
- •5.5.19. Ареколин
- •5.5.20. Никотин
- •5.5.21. Анабазин
- •5.5.22. Вератрин
- •5.5.23. Эфедрин
- •5.5.24. Производные фенотиазина
- •5.5.25. Производные 1.4-бензодиазепина
- •I этап Гидролиз 1,4-бенз-диазепина
- •II этап Гидролизат
- •III этап Экстракция 1,4-бенздиазепинов из гидролизата
- •IV этап
- •5.6. Аналитическая диагностика острых отравлений, наркотического опьянения. Анализ отдельных групп наркотических средств
- •5.6.1. Понятие о веществах, вызывающих одурманивание
- •5.6.2. Классификация наркотических и одурманивающих веществ
- •5.6.3. Особенности химико-токсикологического анализа на содержание одурманивающих средств
- •5.6.4. Требования, предъявляемые к работе лабораторий, занимающихся анализом наркотических и других одурманивающих веществ
- •5.6.5. Особенности интерпретации результатов при анализе биологических объектов на содержание веществ, вызывающих одурманивание
- •5.6.6. Правила отбора проб на обнаружение наркотических средств, психотропных и других токсических веществ
- •5.6.8. Характеристика биологических объектов. Пробоподготовка
- •5.6.9. Особенности исследования мочи на присутствие наркотиков
- •5.6.10. Экстракция как метод изолирования наркотических и одурманивающих средств. Основные понятия экстракции
- •5.7. Ненаправленный анализ наркотических и одурманивающих веществ
- •5.8. Химико-токсикологический анализ отдельных групп наркотических и одурманивающих веществ (направленный анализ)
- •5.8.1. Производные барбитуровой кислоты
- •5.8.2.Алкалоиды группы опия
- •5.8.3. Производные 1,4-бензодиазепина
- •5.8.4. Производные фенотиазина
- •5.8.5. Каннабиноиды
- •5.8.6. Кокаин
- •5.8.7. Амитриптилин
- •5.8.8. Димедрол (дифенгидрамин)
- •5.8.9. Промедол
- •5.8.10. Эфедрин, эфедрон
- •6. Группа веществ, изолируемых экстракцией и сорбцией. Пестициды
- •6.1. Пестициды как химические загрязнители
- •7. «Химико - токсикологический анализ веществ, изолируемых из объекта настаиванием с водой, с последующим диализом а также требующих или нетребующих особых методов изолирования»
5.2.1.Общие и частные методы изолирования
В зависимости от поставленной перед экспертом–химиком задачи, судебно–химическое исследование может носить общий или частный характер, т.е. анализ может быть ненаправленным (общим) или направленным (частным).
Частное исследование предусматривает проведение анализа на какое–то определенное вещество или группу веществ. Например, на производные барбитуровой кислоты, на алкалоиды или даже на одно конкретное вещество. При частном исследовании метод изолирования подбирается с учётом физико–химических свойств того соединения (или группы соединений), на которое производится анализ.
Общий анализ включает исследование на несколько групп веществ (3 группы), подлежащих обязательному судебно–химическому исследованию, в том числе и на группу «нелетучих» ядов. В этом случае используются общие для всей группы веществ (универсальные) методы изолирования.
Общими методами изолирования «нелетучих» ядов являются:
1. Изолирование подкисленным этанолом.
2. Изолирование водой, подкисленной щавелевой кислотой.
Первые два метода вначале были разработаны для алкалоидов, а затем применены и к другим веществам.
3. Изолирование нейтральным ацетоном.
5.2.1.1. Изолирование подкисленным этанолом
Самый первый метод изолирования подкисленным спиртом, названный по имени авторов метода Стаса – Отто, применялся только для алкалоидов. В дальнейшем это метод претерпел серьёзные изменения и стал использоваться не только для алкалоидов, но и для многих других ядовитых и сильнодействующих веществ, имеющих токсикологическое значение.
Современная модификация метода состоит из этапов:
• Настаивание измельчённого объекта с этиловым спиртом, подкисленным щавелевой кислотой до рН 2 – 3, в течение суток. Спирт берётся в количестве, необходимом для покрытия объекта до «зеркала». Спиртовое извлечение сливается и вся операция повторяется трехкратно.
• Упаривание объединённых спиртовых извлечений при температуре 40 – 50 0С до густого остатка, в который по каплям добавляют абсолютный этанол для коагуляции белков. Осадок отфильтровывают и всю операцию осаждения повторяют по мере необходимости до полного удаления белковых соединений.
• Упаривание фильтрата при той же температуре до густого остатка и разбавление горячей водой для удаления смолистых веществ, жиров и пигментов. Осадок отфильтровывают.
• Экстрагирование веществ кислого, нейтрального и слабоосновного характера из водного фильтрата хлороформом при рН = 2 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием (фракция А, «кислое» извлечение).
• Подщелачивание оставшегося после разделения фаз водного слоя до рН 9 – 10, экстрагирование веществ сильноосновного характера (трёхкратная экстракция) хлороформом, отделение органической фазы и концентрирование упариванием (фракция Б, «щелочное» извлечение).
• Изолирование «нелетучих» ядов из биологического материала подкисленным спиртом (метод Стаса-Отто) проводится по следующей схеме:
Рисунок 1. Схема проведения анализа методом «Стаса-Отто»

Достоинства метода заключаются в следующем:
1. Метод универсален, т.к. этанол является хорошим растворителем для многих веществ этой группы (как ионизированных, так и молекулярных форм).
2. Метод предусматривает очистку извлечения от балластных веществ, в результате чего получаются чистые хлороформные извлечения, не дающие эмульсий при экстрагировании веществ из водной фазы хлороформом. Метод даёт возможность изолировать до 30 % барбитуратов и 20 – 25 % алкалоидов.
К недостаткам метода следует отнести:
1. Длительность (8 – 10 рабочих дней) и многостадийность. Большое количество операций, связанных с осаждением белков и фильтрованием, ведёт к значительным потерям искомых веществ (алкалоиды теряются на 25 – 50 %).
2. Сравнительная дороговизна метода (на 1 исследование тратится до 500 мл этанола).
Все это приводит к тому, что классический метод Стаса – Отто теряет своё былое значение и постепенно заменяется более быстрыми, эффективными и экономными методами извлечения подкисленной водой.
В настоящее время метод применяется, главным образом, для исследования гнилостно изменённого биологического материала.
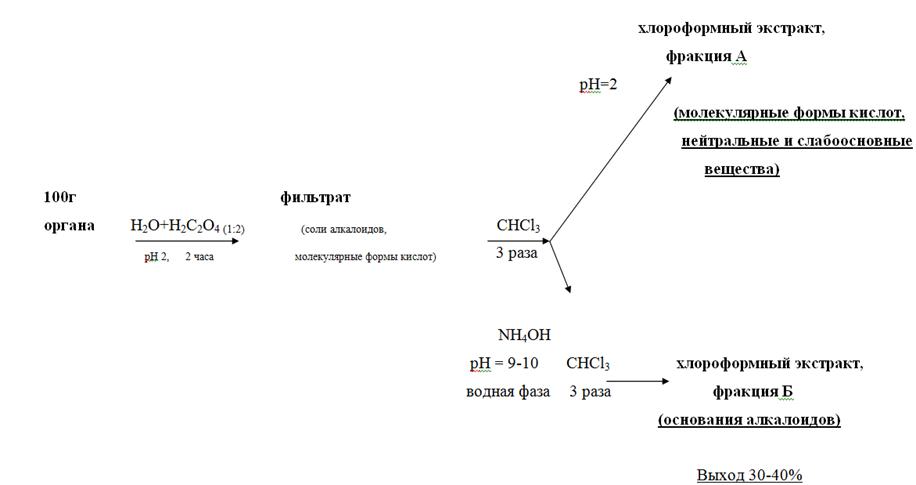
5.2.1.2. Изолирование водой, подкисленной щавелевой кислотой
Идея изолирования подкисленной водой высказывалась разными исследователями. Так, ещё в 1856 году С. Макадам предложил для подкисления воды использовать щавелевую кислоту, в 1861 г. Усляр и Эрдман – соляную, а в 1865 г. Г. Драгендорф – серную. Вплоть до 1941 г. водный метод не получал широкого распространения. В 1942 – 1943 г.г. Степановым А.В. и Швайковой М.Д. был предложен метод изолирования алкалоидов из объектов растительного происхождения водой, подкисленной щавелевой кислотой (ускоренный метод). В 1947 – 49 г.г. этот метод был применён А.А. Васильевой к трупному материалу, после чего он вошёл в практику судебно–химического анализа в отечественных лабораториях.
Схема изолирования по методу Васильевой заключается в следующем:
• Настаивание измельчённого объекта с водой, подкисленной щавелевой кислотой до рН = 2 – 3, в течение двух часов. Вода берётся в количестве 1 : 2 по отношению к навеске объекта. Водное извлечение фильтруется.
• Экстрагирование веществ кислого, нейтрального и слабоосновного характера из водного фильтрата хлороформом при рН = 2 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием (фракция А, «кислое» извлечение).
Подщелачивание оставшегося после разделения фаз водного слоя раствором аммиака до рН 9 – 10, экстрагирование веществ основного характера трёхкратной экстракцией хлороформом, отделение органической фазы и концентрирование упариванием (фракция Б, «щелочное» извлечение).
По сравнению с изолированием подкисленным спиртом извлечение водой, подкисленной щавелевой кислотой, обладает рядом преимуществ:
1. Быстрота (анализ можно провести в течение одного рабочего дня).
2. Меньшее количество операций, меньшие потери искомых веществ (алкалоиды извлекаются на 30 – 40 %).
3. Экономичность и дешевизна, т.к. дорогой спирт заменён водой.
Недостатком метода является образование стойких эмульсий при экстрагировании веществ из водной фазы хлороформом, особенно при исследовании гнилостного биоматериала, т.к. метод не предусматривает очистки извлечений
Рисунок 2. Схема проведения анализа методом Васильевой
5.2.1.3. Изолирование нейтральным ацетоном
Метод предложен проф. Карташовым В.А. (г. Барнаул) в 1990 году.
Измельченную навеску биологического материала массой 5 г экстрагируют 10 мл ацетона в течение 10 минут, центрифугируют. Полученное извлечение сливают, операцию экстрагирования ацетоном повторяют ещё 2 раза по 5 мл. Извлечения объединяют.
К объединенному извлечению добавляют 20 мл 0,5 М. раствора хлористоводородной кислоты, перемешивают и экстрагируют гексаном дважды. Гексановые извлечения, содержащие примеси, отбрасывают.
Из очищенного водно-ацетонового извлечения (рН=1) эфиром экстрагируют вещества кислотного характера. Далее водно-ацетоновую фазу подщелачивают аммония гидроксидом до рН=9, добавляют 5 г натрия хлорида (высаливающий агент) и экстрагируют вещества основного характера эфиром.
Преимущество метода:
1. Высокий выход ядовитых веществ (до 60-70%). Это достигается за счет использования в качестве экстрагента нейтрального ацетона, который извлекает вещества кислотного и основного характера как в ионизированной, так и в молекулярной формах. Высокий выход веществ позволяет уменьшить массу навески до 5 граммов, что упрощает операции и снижает расход реактивов и времени пробоподготовки.
Недостатки метода:
Ацетон, извлекает из биоматериала большое количество примесей, что требует дополнительной очистки извлечения. К недостаткам метода относится и его многостадийность.
5.2.1.4. Твердофазная экстракция
Лекарственные и наркотические средства, поступающие на исследование, крайне редко являются индивидуальными соединениями. Нередко объектами исследования являются поступающие из незаконного оборота синтетические наркотические средства, которые производятся в подпольных лабораториях. В подавляющем большинстве случаев они имеют в своем составе различные наполнители и добавки (сахар, соли жирных кислот, крахмал, сода, тальк и др.), либо содержат загрязнения или промежуточные и побочные продукты синтеза, содержание же наркотически активного компонента в таких препаратах очень низкое.
При этом разделение, выделение, концентрирование и очистка целевых компонентов традиционными методами (например, жидкостной экстракцией) неэффективны, а иногда просто невозможны. Решение такого рода проблем возможно при применении на стадии пробоподготовки метода твердофазной экстракции, позволяющего осуществлять одновременное разделение, выделение и концентрирование целевых компонентов из биологических жидкостей и их экстрактов, лекарственных и нативных наркотических средств. Такой подход дает возможность получения веществ в чистом виде, что в дальнейшем позволяет проводить идентификацию методами ИК -, УФ – спектроскопии, ТСХ, ГЖХ, ВЭЖХ, методом хромато-масс-спектрометрии.
В основе метода твердофазной экстракции лежит принцип колоночной хроматографии, который основан на специфическом взаимодействии выделяемого из биоматериала компонента с сорбентом, находящимся в небольшом патроне. Патрон – картридж имеет полиэтиленовую оболочку, внутри которой находится сорбент, упакованный между двумя пористыми фильтрами. Патроны могут соединяться друг с другом, представляя более широкие возможности для их использования. Чаще всего для заполнения патронов применяют сорбенты на основе силикагеля и химически модифицированного силикагеля. Для модификации силикагеля используются вещества, содержащие различные функциональные группы (нитрильные, диольные, амино-, карбокси - и сульфогруппы), а также алифатические (С1 – С18) и ароматические (фенильные) группы. Выбор соответствующего типа патрона связан со свойствами определяемого вещества и осуществляется по типу подобия.
Часто в практике ХТА используются отечественные патроны фирмы “Диапак”, заполненные немодифицированным силикагелем (Диапак Силикагель) и силикагелем, модифицированным гексадецильными группами С16 (Диапак С16).
При использовании патронов Диапак для большинства веществ проводят следующие операции.
1. Активация – приведение патрона в рабочее состояние путем промывки этиловым или метиловым спиртом (2-10 мл). Скорость пропускания 2,5 мл/мин.
2. Кондиционирование – пропускание буферного раствора (ацетатного или аммиачного) в зависимости от исследуемых веществ. Объем буферного раствора – 10 мл. Скорость пропускания 2,5 мл/мин .
3. Сорбция – пропускание исследуемого раствора через патрон. Объем пробы обычно 100 мл. Скорость пропускания 2,5 мл/мин.
4. Десорбция – удаление исследуемого вещества с сорбента с помощью воздуха шприцем или вакуумным насосом.
5. Элюирование образца осуществляется реагентом, который применялся на стадии активации. Объем элюента – 50-100 мл.
Высокая эффективность выпускаемых патронов позволяет использовать их для пробоподготовки широкого круга объектов – от лекарственных препаратов сложного состава до “уличных наркотиков” и биологических жидкостей (моча, кровь, сыворотка и т. д.), а также экстрактов биологических жидкостей.
Частные методы изолирования веществ кислотного характера
• изолирование барбитуратов подщёлоченной водой (метод П. Валова);
• метод Е. Грусц-Харди.
5.2.1.5. Изолирование барбитуратов подщелоченной водой (метод П. Валова)
Изолирование барбитуратов подщелоченной водой схематично можно представить следующим образом:
• Настаивание измельчённого объекта с водой, подщелоченной 20% раствором натрия гидроксида до рН = 12 и более в течение 30 мин.
• Очистка водного извлечения путём насыщения натрия вольфраматом, фильтрование раствора.
• В кислой среде (серной кислотой до рН=2), экстрагирование эфиром, концентрирование эфирного извлечения упариванием.
Выход 50% и более
Выход составляет 50% и даже до 90%, в зависимости от вида барбитурата. Метод даёт достаточно чистые извлечения, т.к. включает стадию очистки (осаждение белков натрия вольфраматом), что повышает качество последующего анализа.
Недостатком метода является соосаждение барбитуратов с белками при обработке натрия вольфраматом. В последней модификации метода серная кислота заменена на натрия гидросульфат, что увеличивает выход искомых веществ.
Рисунок 3. Схема проведения анализа методом П. Валова

Измельченный биологический материал растирают с сульфатом аммония, подкисляют раствором хлористоводородной кислоты до рН=2, экстрагируют смесью этилового спирта и хлороформа (1:1). Экстракт отделяют, выпаривают, сухой остаток растворяют в горячей воде и фильтруют. Из фильтрата экстрагируют вещества кислотного характера эфиром.
Частные методы изолирования веществ основного характера
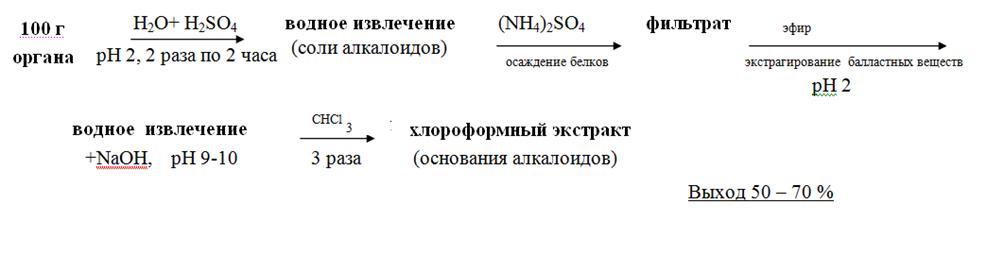
5.2.1.7. Частный метод изолирования алкалоидов водой, подкисленной серной кислотой (по В.Ф. Крамаренко)
Метод был разработан Львовской школой судебных химиков под руководством заведующего кафедрой аналитической и токсикологической химии Львовского медицинского института проф. В.Ф. Крамаренко. В 1956 – 62 г.г. целый ряд работ химиков этой школы был посвящён влиянию рН среды, природы экстрагента и присутствия в водной фазе электролита на эффективность изолирования алкалоидов из биоматериала.
Схематично метод можно представить из следующих этапов:
• Настаивание измельчённого объекта с водой, подкисленной 20% раствором кислоты серной до рН =2– 3, в течение двух часов. Вода берётся в количестве 1 : 2 по отношению к навеске объекта. Водное извлечение фильтруется. Операция повторяется двукратно.
• Очистка водного извлечения от белковых соединений путём насыщения его аммония сульфатом, настаивания в течение часа и фильтрования образовавшегося осадка.
• Очистка фильтрата от жиров, смол, пигментов путём экстракции эфиром. Эфирное извлечение отбрасывают.
• Подщелачивание водного извлечения 20% раствором натрия гидроксида и экстрагирование веществ основного характера хлороформом при рН =9–10 (трёхкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием.
Разработанный вначале для алкалоидов, метод применим и для изолирования других азотсодержащих веществ основного характера (синтетических лекарственных средств).
Метод достаточно быстрый. Преимуществом является хорошая очистка извлечений от соэкстрактивных веществ.
Рисунок 4. Схема проведения анализа методом В.Ф.Краморенко
Кроме указанных выше методов изолирования, для отдельных алкалоидов, таких, как жидкие алкалоиды – анабазин, никотин, кониин рекомендуется перегонка алкалоидов с водяным паром с последующим экстрагированием из дистиллята органическим растворителем. Для стрихнина и пахикарпина предложены такие методы, как электрофорез и электродиализ.
5.2.1.8. Исследование биологических жидкостей
1. При исследовании биожидкостей, таких как кровь, моча, плазма, слюна, сыворотка, промывные воды желудка, для изолирования «нелетучих» ядов используют прямую дробную жидкость – жидкостную экстракцию (ЖЖЭ).
Биожидкость подкисляют кислотой хлористоводородной до рН 2-3 и экстрагируют эфиром (фракция А), а затем подщелачивают до рН 9-10 и экстрагируют хлороформом (фракция Б). Во фракции А присутствуют вещества кислого, нейтрального и слабоосновного характера, во фракции Б – вещества основного характера.
ЖЖЭ соответствует второй стадии изолирования ядов из биоматериала в рассмотренных ранее общих методах, поэтому все факторы, определяющие эффективность изолирования на этой стадии, имеют место здесь.
Для некоторых веществ основного характера (морфин) при изолировании его из биожидкостей предварительно проводят кислотный гидролиз, чтобы разрушить его комплекс с глюкуроновой кислотой, в виде которого он находится в жидкостях. При прямой ЖЖЭ совместно с ядом из биожидкостей могут экстрагироваться сопутствующие вещества, что заставляет в дальнейшем прибегать к различным методам очистки.
В последнее время для изолирования ядов из биожидкостей применяется сорбция их на синтетических смолах, модифицированных силикагелях и активированном угле. Вещества сорбируются на твердом носителе, а потом элюируются из него органическим растворителем (по фракциям). Метод позволяет не проводить дополнительную обработку пробы и изолирование, дает возможность одновременно сконцентрировать вещество и провести очистку. Это приводит к повышению чувствительности метода. Однако, при неизвестном яде сорбция не всегда может быть использована ввиду опасности его потери из-за недостаточной сорбции.
