
Курс лекций Ашуйко
.pdf
ва.
Масса вещества, приходящаяся на 1000 г растворителя, составляет 100 г. Молярную массу растворенного вещества можно определить из соотношения М = К m∆TА . Криоскопическая константа бензола − 5,12 град моль–1 кг. М =
5,12 1001,2 =426 г/моль.
Осмотическое давление разбавленных растворов
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться явление самопроизвольного перехода растворителя через мембрану из менее концентрированного раствора в более концентрированный – осмос. Осмотические свойства раствора количественно характеризуются величиной осмотического давления. Давление, которое необходимо приложить к раствору, чтобы предотвратить перемещение растворителя в раствор через мембрану, разделяющую раствор и чистый растворитель, есть осмотическое давление π. Осмотическое давление идеальных растворов линейно зависит от температуры и молярной концентрации раствора С и может быть рассчитано по уравнению (7):
(7)
Уравнение (7) есть т.н. принцип Вант-Гоффа:
осмотическое давление идеального раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало бы тот же объем, который занимает раствор.
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Вещества, распадающиеся в растворах или расплавах на положительно и отрицательно заряженные ионы, называются электролитами. Кислоты, основания и соли являются электролитами. Распад растворенного вещества на ионы под действием молекул растворителя называется электролитической диссо-
циацией.
Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Эти ионы, находящиеся в непрерывном движении, и обуславливают электропроводность растворов.
Так как при электролитической диссоциации из одной молекулы образуется два и более ионов, то общее число частиц в растворе увеличивается, поэтому понижение температуры затвердевания и повышение температуры кипения раствора электролита оказываются большими, чем у растворов неэлектролитов такой же концентрации.

Для применения законов Рауля к растворам электролитов, в уравнения, выражающие зависимость свойств раствора от его концентрации, вводится поправочный множитель, который называется изотоническим коэффициентом Вант-Гоффа и обозначается i.
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Для объяснения особенностей свойств растворов электролитов С. Арре-
ниус предложил теорию электролитической диссоциации, основываю-
щуюся на следующих постулатах:
1.Электролиты в растворах распадаются на ионы – диссоциируют;
2.Диссоциация является обратимым равновесным процессом;
3.Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность.
Степень диссоциации, константа диссоциации – количественные характеристики процессов диссоциации.
Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N:
α = Nдис. = Сдис. ,
Nобщ. С0.
где Сдис – концентрация частиц, образовавшихся в результате диссоциации (моль/л); С0 – начальная концентрация электролита (моль/л). Степень диссоциации α может быть выражена в долях единицы или процентах.
Величина степени диссоциации зависит:
1.от природы растворителя и растворенного вещества;
2.концентрации раствора;
3.температуры.
Электролиты, у которых α →1, считаются сильными, если α →0, – слабыми.
Для объяснения многообразия факторов, влияющих на свойства сильных электролитов, пользуются понятием активности иона. Активность иона – это (доля ионов) концентрация вещества, которая проявляет себя в действии.
Для сильных электролитов, полностью диссоциирующих на ионы, даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами достаточно велика, и пренебречь этим взаимодействием нельзя. Взаимодействие противоположно и одноименно заряженных ионов (соответственно притяжение и отталкивание) приводит к тому, что вблизи
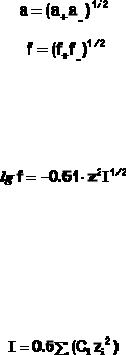
каждого иона находятся преимущественно ионы с противоположным зарядом, образующие т.н. ионную атмосферу. Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются; кроме того, каждый ион окружен дипольными молекулами растворителя – сольватной оболочкой. Т.о., в растворе сильного электролита возникает подобие пространственной структуры, что ограничивает свободу перемещения ионов и приводит к изменению свойств раствора в том же направлении, как действовало бы уменьшение степени диссоциации. Поэтому, определяя степень диссоциации раствора сильного электролита, получают т.н. кажущуюся степень диссоциации, т.е. величину α с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Количественные расчеты характеристик растворов сильных электролитов осуществляют с помощью понятий активности электролита аэ и активностей катионов и анионов а+ и а- соответственно, которые равны произведению коэффициента активности на концентрацию:
Для бинарного электролита средняя активность электролита связана с активностями ионов; как и средний коэффициент активности с ионными:
Дебаем и Хюккелем был разработан метод расчета среднего коэффициента активности сильного электролита. Для бинарного электролита уравнение имеет следующий вид:
Здесь z – заряд иона, для которого рассчитывается коэффициент активности, I – т.н. ионная сила раствора: некоторый параметр, который одновременно учитывает молярную концентрацию и заряд всех имеющихся в растворе ионов. Ионная сила раствора равна полусумме концентраций всех ионов, умноженных на квадрат их заряда:
Теория Дебая – Хюккеля применима только при концентрациях, не превышающих 0.05 моль/л. Для более концентрированных растворов сильных электролитов количественной теории не существует.
Активность иона а(моль/л) определяется выражением
а = f С,
где f – коэффициент активности, С – начальная концентрация электролита; f – отражает взаимодействие силовых полей ионов, имеющих место в данной системе.
В сильноразбавленных растворах f = 1, поэтому в расчетах, связанных с незначительными концентрациями, активность можно считать равной концентрации.
При определении концентраций ионов в растворе слабого электролита следует помнить, что их значения определяются равновесием электролитической диссоциации, которое подчиняется закону действующих масс.
Для расчета нужно знать Кс и начальную концентрацию электролита (моль/л).
Врастворах сильных электролитов истинную степень диссоциации
принимаем равной 1, α = 1; Сиона =С 0 n, где n – число одноименных ионов, образующихся при диссоциации одной молекулы.
Для определения концентрации ионов надо знать схему электролитической диссоциации и С0 – начальную концентрацию электролита (моль/л).
Вобщем случае концентрация иона в растворе может быть определена по формуле
Сиона = С0 α n,
где n– число ионов данного вида, образующихся при диссоциации одной молекулы.
Используя эту формулу, можно рассчитать концентрацию ионов в растворах и слабых и сильных электролитов. В растворах сильных электролитов α = 1, а в растворах слабых электролитов α требует определения, если она не задана в условии.
Диссоциация кислот в водных растворах происходит с образованием катиона водорода.
Упрощенные схемы диссоциации сильных и слабых кислот:
Сильные
HNO3 = H+ + NO −3 H2SO4 = 2H+ + SO −42
Слабые
H2CO3 H+ + HСO3-
HСO3- H+ + СO32-
Диссоциация оснований в водных растворах происходит с образованием анионов только одного вида – гидроксид-ионов.
Упрощенные схемы электролитической диссоциации сильных и слабых оснований:
Сильные |
Слабые |
KOH = K+ + OH– |
Cu(OH)2 CuOH+ + OH– |
Sr(OH)2 = Sr2+ + 2OH– |
CuOH+ Сu2+ + OH– |
Диссоциация средних солей происходит с образованием катиона металла и аниона кислотного остатка.
Упрощенная модель диссоциации средних солей предполагает диссо-
циацию их в одну стадию и может быть представлена схемами: KCN = K+ + CN-
Cr2(SO4)3 = 2Cr3+ + 3SO 24− CuCl2 = Cu2+ + 2Cl–
Следует отметить, что данная модель является лишь первым очень грубым приближением, особенно для солей с небольшой долей ионности связи.
Диссоциация кислых солей происходит сначала с образованием катиона и гидроаниона, затем возможно отщепление Н+ от гидроаниона:
KНСO3 = K+ + HСO −3
HСO 23− H+ + СO 23−
Диссоциация основных солей происходит сначала с образованием гидроксокатиона и аниона, далее возможно отщепление гидроксид-иона от гидроксокатиона:
(FeOH)2SO4 = 2FeOH+ + SO 24− FeOH+ Cu2+ + OH–
Процессы диссоциации слабых электролитов равновесны и подчиняются закону действующих масс.
Константу равновесия электролитической диссоциации приято обо-
значать Кдис., Кс.
Константа равновесия электролитической диссоциации слабого электролита – количественная характеристика глубины протекания процесса.
Величина константы диссоциации зависит:
1.от природы растворителя и растворенного вещества;
2.температуры;
Величина константы диссоциации не зависит от концентрации раствора.
Для сравнения силы слабых электролитов необходимо использовать справочные таблицы, в которых приведены значения Кдис..
HCN H+ + CN– |
|
Kдис. = |
СH + |
CCN - |
=6,02 10–10 |
|||
|
|
|
|
|||||
|
|
|
|
CHCN |
|
|||
+ |
– |
|
СClO- CH + |
|
|
|
–8 |
|
HClO H + ClO |
|
Кдис. = |
|
|
|
= 3 10 |
|
|
|
CHClO |
|
|
|||||
|
|
|
|
|
|
|
||
Из сопоставления Кдис перечисленных электролитов следует, что хлорноватистая кислота (Кдис = 3·10–8) сильнее синильной (Кдис = 6,02·10–10).
Для слабых многоосновных кислот и многокислотных оснований, диссоциирующих ступенчато, каждой ступени диссоциации соответствует определенная величина Кдис., например,

H3PO4 H+ + H2PO −4 H2PO −4 H+ + HPO 24− HPO 24− H+ + PO −43
К1дис = 7,6 10–3 К2дис = 6,2 10–8 К3дис = 4,2 10–13
К сильным электролитам относятся:
1.почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2);
2.многие неорганические кислоты(HCl, HBr, HI, HClO4, H2SO4,
HNO3, HClO3, H2SeO4)
3. щелочи (гидроксиды щелочных и щелочноземельных метал-
лов LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2);
К слабым электролитам относятся:
1.почти все органические кислоты;
2.некоторые минеральные кислоты (H2S, HCN, H2CO3 HNO2, HClO, H3BO3 и др.);
3.гидроксиды почти всех металлов (за исключением щелочных и щелочноземельных металлов), а также гидроксид аммония;
4.вода;
Протекание реакций обмена в растворах электролитов обусловливается присутствующими в растворе ионами электролитов. Поэтому такие реакции выражают не только обычными молекулярными уравнениями, но и ионномолекулярными уравнениями реакций. Реакция обмена в растворе между двумя электролитами протекает только при выполнении следующих усло-
вий:
1)образование малорастворимого соединения (осадка);
2)образование малодиссоциирующего соединения (слабого электроли-
та);
3) выделение газа.
При записи ионно-молекулярных уравнений реакций следует соблюдать следующие правила:
–сильные электролиты записывать в виде ионов;
–слабые электролиты (малодиссоциирующие соединения), а также малорастворимые электролиты и газы записывать в молекулярном виде.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ РН
Процесс электролитической диссоциации воды в соответствии со схе-
мой:
Н2О Н+ + ОН– количественно характеризуется константой равновесия:
Кдис. = СН+ СОН- = 1,8 10–16 (при 220С).
СН2 О
Процесс протекает очень неглубоко, можно считать, что равновесная

концентрация недиссоциированных молекул воды равна общей (начальной) концентрации молекул воды; то есть СН 2 О = 100018 = 55,5 моль/л.
Тогда Кдис. СН 2 О = CH + COH − = Кw;
Kw = 1,8 10–16 55,55 = 10–14 (при 220С).
Кw – постоянная величина (при определенной температуре), которую называют ионным произведением воды.
В чистой воде ионы Н+ и ОН– появляются только за счет электролитической диссоциации воды: Н2О = Н+ + ОН– СН + СОН − = 10–14, их концен-
трации одинаковы: СН + = СОН − |
= 10−14 |
= 10–7 моль/л. |
Раствор, в котором СН + |
= СОН − , |
принято называть нейтральным. |
При добавлении в воду кислоты или основания равновесие диссоциации воды в соответствии с принципом Ле Шателье смещается влево, нарушается соотношение СН + = СОН − , но Kw остается неизменной.
Раствор, в котором СН + > СОН − или СН + > 10–7 моль/л, принято назы-
вать кислым.
Раствор, в котором СН + < СОН − или СН + < 10–7 моль/л, принято назы-
вать щелочным.
Концентрация ионов водорода в водном растворе – важная характеристика раствора:
СН + = СОН − = 10–7 моль/л – нейтральная среда;
СН + > СОН − , СН + > 10–7 моль/л – кислая среда; СН + < СОН − , СН + < 10–7 моль/л – щелочная среда.
Более удобна количественная характеристика среды раствора − водородный показатель, который вычисляется как отрицательный десятичный логарифм концентрации ионов водорода: рН = –lgCH + .
В соответствии со значением CН +
lgCH + = –lg10–7 рН = 7 − нейтральная среда; рН < 7 − кислая среда; рН > 7 − щелочная среда.
ЗАКОН РАЗБАВЛЕНИЯ ОСТВАЛЬДА ДЛЯ СЛАБЫХ ЭЛЕКТРОЛИТОВ
В растворе слабого электролита устанавливается равновесие между ионами и непродиссоциировавшими молекулами, например
НСlO H+ + ClO–,
которое подчиняется закону действующих масс и количественно характеризуется константой равновесия:
Кдис. = СН+ ССlO- ,
CHClO
где СН + , СClO − , CHClO – равновесные концентрации ионов и молекул. Из

уравнения процесса следует, что сколько молей кислоты распалось на ионы, столько и получилось катионов и анионов соответственно.
Концентрации СН + , СClO − , CHClO могут быть выражены через начальную концентрацию электролита Сo(НСlO) и степень диссоциации:
α = |
Сдис. |
;) |
|
С |
|||
|
|
||
|
0 HClO |
|
Сдис. = С0 НСlO α,
где Сдис. – концентрация продиссоциировавших молекул. Равновесная концентрация кислоты:
СНСlO = C0 HClO – α C0 HClO
Равновесная концентрация образующихся ионов:
Сдис. = СН + |
= СНClO |
|
|
|
|||
Тогда: |
|
|
|
|
|
|
|
Кдис. = |
С0 НСlO α C0 HClO α |
||||||
C |
|
|
- С |
|
|
α |
|
|
0 HClO |
0 НСlO |
|
||||
|
|
|
С |
|
α2 |
|
|
или Кдис. = |
|
0 НСlO |
|
. |
|
||
|
(1 − α) |
|
|||||
Это соотношение в общем виде справедливо для процесса электролитической диссоциации любого слабого электролита при условии
равенства Скат.= Саниона. Для равновесия:
АВ А+ + В– математическое выражение закона разведения Оствальда имеет вид
Кдис. = С0АВ α2 ,
1 − α
где С0АВ – начальная концентрация слабого основания или кислоты (моль/л); α – степень диссоциации в долях единицы.
Для слабых электролитов, имеющих незначительные величины степени диссоциации, величиной α в знаменателе можно пренебречь и считать, что
1–α = 1. |
Кдис. = САВ α2 |
|
|
Тогда: |
|
||
Из данных соотношений следует: |
|
|
|
|
α = |
Кдис. |
, |
|
С |
||
|
|
|
|
|
|
0АВ |
|
что степень диссоциации слабого электролита увеличивается при разбавлении, то есть уменьшении начальной концентрации.

Пример 1. Вычислите концентрацию ионов H+, OH- и pH в растворе: а) 0,1 М HNO2; б) 0,1 н. H2SO4; в) NaOH плотностью 1 г/мл с массовой долей
NaOH 0,04 %.
а) Дано: |
|
Решение. Записываем уравнение диссоциации ки- |
|||||||||||
C0 = 0,1 моль/л |
слоты: |
|
|
HNO2 →H++NO2–. |
|
||||||||
C |
H |
+ , C |
− , pH – ? |
|
|
|
|
|
|
||||
|
OH |
|
кислота слабая степень диссоциации находим по формуле |
||||||||||
|
|
Поскольку |
|||||||||||
|
|
|
α = |
|
K |
= |
4 10−4 |
= |
40 10 |
−4 |
= 6,32 10 |
−2 |
. |
|
|
|
|
C |
0,1 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
При диссоциации кислоты образуются ионы H+. Их концентрацию определяем по формуле
CH+ = α C0 = 6,32 10−2 0,1 = 6,32 10−3 моль/л.
Концентрацию ионов OH– рассчитываем из выражения для ионного произведения воды:
|
|
|
|
|
K |
|
|
|
|
10−14 |
|
|
|
|
|
|
−10 |
|
|
C |
− |
= |
|
W |
|
= |
|
|
|
|
|
=1,58 |
10 |
|
моль/л. |
||||
CH+ |
|
6,32 10 |
−3 |
|
|
||||||||||||||
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Находим pH: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
= −lg(6,32 10−3 )=3 −lg(6,32)=3 −0,80 = 2,20 . |
||||||||||||||||||
pH = −lgCH+ |
|
||||||||||||||||||
б) Дано: |
|
|
Решение. H2SO4 – сильная кислота: |
||||||||||||||||
|
|
||||||||||||||||||
C (1z H2SO4 )= 0,5 моль/л |
|
|
|
|
|
|
|
|
|
H2SO4 = 2H+ +SO42− . |
|||||||||
|
|
|
Для сильных электролитов α =1. |
||||||||||||||||
CH+ , COH− , pH – ? |
|
|
|||||||||||||||||
|
|
Концентрация |
|
|
ионов |
|
H+ |
будет равна |
|||||||||||
|
|
|
CH+ = α n C0 =1 2 C0 = 2C0 |
|
|||||||||||||||
|
|
( |
в реакции образуется 2 иона H+). |
||||||||||||||||
Найдем C0 (молярную концентрацию H2SO4): |
|
|
|
|
|||||||||||||||
C0 =C (H2SO4 )= 1z C (1z H2SO4 )= 12 0,1 = 0,05 моль/л. |
|||||||||||||||||||
Тогда |
|
|
|
|
CH+ = 2 0,05 = 0,1 моль/л; |
|
|||||||||||||
|
|
|
|
|
|
||||||||||||||
|
C |
|
|
|
|
K |
|
|
10−14 |
|
|
−13 |
|
|
|
||||
|
|
− = |
|
|
W |
= |
|
|
=1 10 |
|
|
моль/л; |
|||||||
|
|
CH+ |
0,1 |
|
|
||||||||||||||
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
в) Дано: |
|
|
|
|
pH = −lgCH+ = −lg(0,1)=1. |
|
|||||||||||||
|
|
|
|
|
|
|
Решение. NaOH – сильный электро- |
||||||||||||
ω |
|
|
|
|
|
|
|
лит: |
|
|
|
|
|
|
|
|
|
||
(NaOH) = 0,04% или 0,0004 |
|
|
|
|
|
NaOH = Na+ +OH− (α =1), |
|||||||||||||
ρр-ра = 1 г/мл |
|
|
|
|
|
|
|
|
|
|
|||||||||
CH+ , COH− , pH – ? |
|
|
|
COH |
|
|
|
образует ионы OH–. Тогда |
|||||||||||
|
|
|
|
− = α n C0 =1 1 C0 =C0 . |
|||||||||||||||
Находим C0 (молярную концентрацию NaOH): |
|
|
|
||||||||||||||||
|
|
|
|
|
пусть Vр-ра = 1 л = 1000 мл, |
|
|||||||||||||

mр-ра =ρр-ра Vр-ра =1 1000 =1000 г,
m(NaOH)= ω mр-ра = 0,0004 1000 = 0,4 г,
C =C (NaOH)= |
|
|
m(NaOH) |
= |
0,4 |
= 0,01 моль/л. |
|||||||
|
|
|
|
|
|||||||||
0 |
|
M (NaOH) Vр-ра |
|
40 1 |
|
|
|||||||
|
|
|
|
|
|||||||||
Тогда: |
|
|
|
|
COH− |
= 0,01 моль/л, |
|
||||||
|
|
|
|
|
|
||||||||
|
C |
|
|
K |
10−14 |
|
|
|
−12 |
|
|||
|
H |
+ = |
W |
= |
|
|
=1 10 |
|
моль/л, |
||||
|
|
|
|
|
|||||||||
|
|
|
|
COH− |
0,01 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||
pH = −lgCH+ = −lg(1 10−12 )=12 .
Пример 2. Определите степень диссоциации угольной кислоты в 0,01 М растворе, учитывая только первую ступень диссоциации, если pH этого рас-
твора равен 4,17. |
|
|
|
Решение. Уравнение диссоциации кислоты |
|||||
Дано: |
|
|
|
|
|
||||
C(H2CO3) = 0,01 моль/л |
по первой ступени имеет вид: |
||||||||
pH = 4,17 |
|
|
|
|
H2CO3→ H++HCO3– (Iступень) |
||||
α– ? |
|
|
|
|
|
Вычисляем концентрацию ионов H+: |
|||
|
|
|
C |
H |
+ =10−pH =10−4,17 = 6,76 10−5 моль/л. |
||||
|
|
|
|
|
|
|
|
|
|
Степень диссоциации находим так |
|
||||||||
C |
H |
+ = α C |
, |
|
α = |
CH+ |
= 6,76 10−5 |
= 6,76 10−3 моль/л. |
|
|
|
||||||||
|
0 |
|
|
|
|
C0 |
0,01 |
|
|
|
|
|
|
|
|
|
|
||
ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ
Единой теории кислот и оснований не существует. Наиболее широко используются четыре теории кислот и оснований: Аррениуса, протонная,
электронная и теория сольвосистем.
Теория электролитической диссоциации Аррениуса
Согласно теории Аррениуса, кислоты - это вещества, при электролитической диссоциации в водном растворе образующие катионы одного вида, только катионы водорода Н+. Основания — это вещества, в водном растворе подвергающиеся электролитической диссоциации с образованием анионов одного вида, анионов гидроксида ОН–.
Протонная теория Брёнстеда-Лоури
Согласно протонной теории, кислота — это соединение, способное отдавать основанию катионы водорода Н+ (является донором Н+). Основания — это соединения, способные принимать у кислоты катионы водорода Н+ (является акцептором Н+). Таким образом, в этой теории одно и то же вещество в
