- •1.4. Спектрлердi зерттеу құралдары
- •1.2-Сурет. Айнымалы ток доғасы генераторының электрлiк схемасы:
- •1.3-Сурет
- •1.5-Сурет
- •1.5. Жұмыстың орындалу тәртiбi.
- •1.8-Сурет
- •1.9-Сурет
- •1.7. Бақылау сұрақтары
- •2. Атомдық спектрлерді заттың химиялық құрамын анықтау үшін қолдану
- •2.1. Жұмыстың мақсаты мен мазмұны
- •2.2. Аппаратура
- •2.4. Жұмыстың орындалу ретi
- •3. Сутегі атомы спектрін зерттеу, ридберг тұрақтысын және электрон массасын анықтау
- •3.1. Жұмыстың мақсаты мен мазмұны
- •3.3. Қысқаша теориялық мәлiметтер
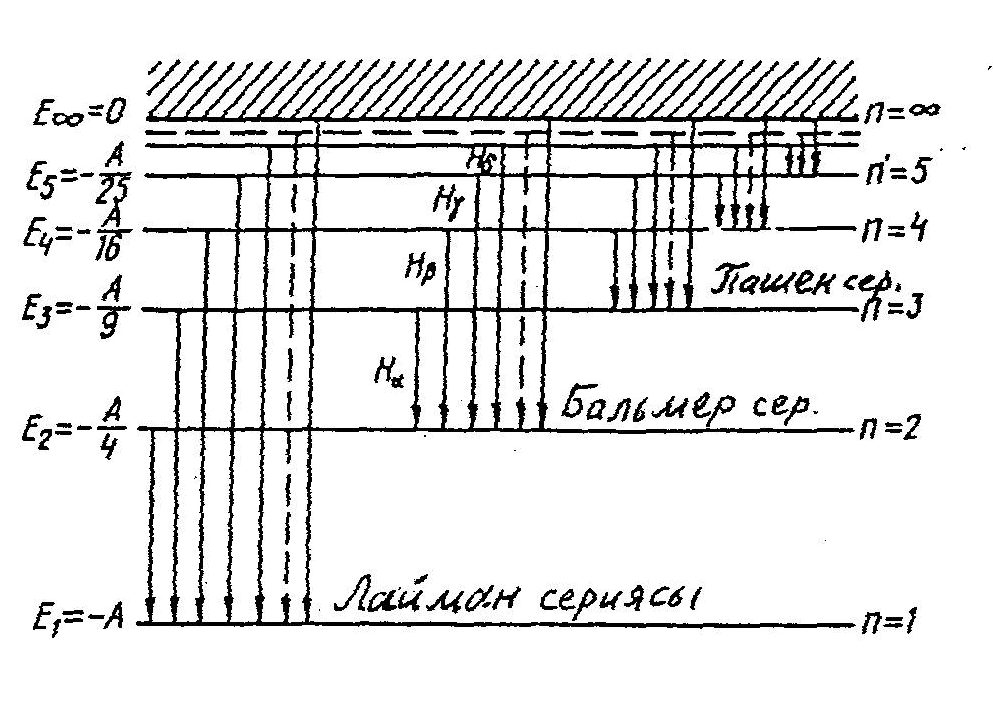
- •3.1-Сурет. Суретте бiрнеше ауысулардың жиiлiктерi келтiрiлген.
- •3 38.2-Сурет
- •3.4. Тәжiрибе жасауға арналған қондырғы
- •3.3-Сурет
- •4. Сілтілік металдар спектрлеріндегі сериялық заңдылықтарды зерттеу
- •4.1. Жұмыстың мақсаты мен мазмұны
- •4.2. Жұмыс орындалатын тәжiрибелiк қондырғы
- •4.6-Сурет
- •4 52.7-Сурет
- •4.4. Жұмыстың орындалу ретi
- •4.5. Бақылау сұрақтары
- •5. Натрий спектрлік сызықтарының нәзік түзілісін зерттеу
- •5.1.Жұмыстың мақсаты мен мазмұны
- •5.2. Аппаратура
- •5.3. Теориялық кiрiспе
- •5.4. Тәжiрибелiк қондырғы
- •5.5. Жұмыстың орындалу ретi
- •5. Бақылау сұрақтары
- •Екі валентті электроны бар атомдар спектрінің құрылымын зерттеу
- •6.1-Сурет
- •6.4. Жұмыстың орындалуы
- •6.5. Бақылау сұрақтары
- •7. Спекрлік сызықтардың аса нәзік түзілісін зерттеу. Талий ядро спинін анықтау
- •7.1. Жұмыстың мақсаты мен мазмұны
- •7.2. Аппаратура
- •7.3. Теориялық кiрiспе
- •7.4. Спектрлiк сызықтардың аса нәзiк түзілiсi (ант).
- •7.1-Сурет
- •7.4. Тәжiрибе жүргізуге арналған қондырғы
- •7.5. Жұмыстың орындалу ретi
- •7.5-Сурет. TlI 535,046 нм сызықтың аса нәзiк және изотоптық түзілiсi
- •7 85.6-Сурет. Фабри-Перо интерферометрi мен исп-30 (исп-28) спектрографы қосақталған қондырғы
- •7.6. Бақылау сұрақтары
- •8. Гелий, неон атомдары және гелий-неон лазері шығаратын электромагниттік сәуле спектрін зерттеу. Лазердің жұмыс істеу принципі
- •8.2. Аппаратура
- •8.3. Қысқаша теория
- •8.7-Сурет
- •8.8-Сурет
- •8.5. Бақылау сұрақтары
- •9. Молекулаллық спектрдің құрылымын зерттеу және cn молекуласының атомаралық қашықтығын анықтау
- •9.3-Сурет
- •9 113.4-Сурет
- •9.5-Сурет
- •9.6. Бақылау сұрақтары
- •Мазмұны
3.1-Сурет. Суретте бiрнеше ауысулардың жиiлiктерi келтiрiлген.
Ең аз энергия Е1 сәйкес келетiн негiзгi күйде атом мейлiнше ұзақ тұрады. Ал қалған барлық күйлер қоздырылған болады. Атомды осындай күйге ауыстыру процесi қоздыру деп аталады. Қозған күйде атом салыстырмалы қысқа уақытқа, әдетте 10-8 с кiдiредi. Бiрақ бұл уақыт атомдық масштабта ұзақ уақытқа саналады. өйткенi жарық сәулесiнiң жиiлiгi 1014 с-1, ал осы жарық =10-8 с уақыт iшiнде 106 тербелiс жасайды.
Қ
36
Атом
энергиясының санақ басы әдетте оның
байланысқан күйлерiне сәйкес келетiн
барлық Е1,
Е2,
Е3,...
дискреттiк мәндерi терiс таңбалы (Е<0)
болатындай таңдалып алынады. Оң мәндер
(Е>0)
жағдайында атом күйлерi байланыспаған-атом
оң ионға және электронға ыдырайды.
Электронды атомнан бөлiп алу процесi
иондау
деп аталады. Иондалған күйлерде ион
және электронның қозғалыстары бiр-бiрiнен
тәуелсiз болатындықтан бұлардың қосынды
Е
энергиясы кез-келген мән қабылдай алады,
яғни квантталмайды. Еi
иондану энергиясы деп негiзгi күйде
тұрған атомға оны иондау үшін берiлуге
тиiс ең аз энергияны айтады. Диаграммадан
иондану энергиясы атомның негiзгi күйi
энергиясының абсолюттiк шамасына тең
болатындығы көрiнедi:
![]()
Иондану энергиясын әдетте эВ-пен өрнектейдi. Бұған осы жағдайда иондану потенциалы терминi қолданылады.
Әр түрлi стационарлық күйлердегi атомның құрылымы да әр тұрлi болады. Сонымен, атом бiр стационарлық күйден екiншiсiне ауысқанда оның құрылымы да өзгерiске ұшырайды. Ең елеулi өзгерiс иондану кезiнде, атом электроннан айырылғанда, болады.
Атом, hv
энергиясы Ei
иондалу
энергиясынан басым келетiн,
яғни
![]() ,
фотонды жұту нәтижесiнде
атомның иондануы мүмкін. Бұл процесс
фотоиондану
деп аталады. Атомнан жұлынып шығарылған
электронның кинетикалық энергиясы
,
фотонды жұту нәтижесiнде
атомның иондануы мүмкін. Бұл процесс
фотоиондану
деп аталады. Атомнан жұлынып шығарылған
электронның кинетикалық энергиясы
![]() болады. Фотоиондануға керi
процесс радиациялық
рекомбинация
деп аталады. Осы процесс нәтижесiнде
ион мен электрон байланысып стационарлық
күйлердiң
бiрiндегi
атом пайда болады, ал босатылған энергия
бiр
немесе бiрнеше
фотон түрінде шығарылады.
болады. Фотоиондануға керi
процесс радиациялық
рекомбинация
деп аталады. Осы процесс нәтижесiнде
ион мен электрон байланысып стационарлық
күйлердiң
бiрiндегi
атом пайда болады, ал босатылған энергия
бiр
немесе бiрнеше
фотон түрінде шығарылады.
Атомды қоздыру немесе иондауға қажеттi энергия, оны белгiлi жиiлiктегi жарықпен жарықтандырғанда ғана емес, кинетикалық энергиясы қайсыбiр табалдырық шамадан артық басқа бөлшектермен серпiмсiз соқтығысқанда да атомға берiлуi мүмкін.
Мәселен газды қыздырғанда әрқашан атомдардың басқа жеткiлiктi дәрежедегi жылдам атомдармен (және де иондану нәтижесiнде газда пайда болатын электрондармен) серпiмсiз соқтығысқан жағдайда қоздырылуы (иондануы) қабат жүредi. Мұны температуралық қоздыру (иондау) дейдi. Т температураны өсiргенде қоздырылған күйлердiң әрқайсысындағы атом саны тез артады. Энергиясы Еn қоздырылған күйдiң қоныстануы Больцман үлестiрiлуiмен анықталады:
37![]()
мұндағы Nn
-қоздырылған
күйдегi атом саны;
N1
негiзгi
күйдегi
атом саны;
k-Больцман
тұрақтысы. Бөлмелiк
температура жағдайында
![]() эВ,
ал
эВ,
ал
![]() қатынасы
елеусiз
аз болады.
қатынасы
елеусiз
аз болады.
Сондықтан суық
газ, егер оның атомдары басқаша жолмен
қоздырылмаған болса, онда жарық
шығармайды. Суық газдың жұтылу спектрiнде
негiзгi
күйден ауысуларға сәйкес келетiн
жиiлiктерi
v21,
v31,
v41
және т.б. сызықтардың ғана болатындығы
![]() қатынасының аздығымен түсіндiрiледi.
қатынасының аздығымен түсіндiрiледi.
3.3.5. Сутегi атомының энергия деңгейлерi және спектрi. Еn энергия деңгейлерiнiң орналасу заңдылығы сутегi атомында ең қарапайым.
Сутегi атомының термi (3.5) формуласымен өрнектеледi. Демек, энергия мәндерiнiң дискреттi жиыны, яғни сутегi атомының энергетикалық спектрi мына формуламен анықталады:
![]() (3.10)
(3.10)
мұндағы A=hcR энергетикалық тұрақты; 1, 2, 3,... мәндерiн қабылдайтын n саны бас кванттық сан деп аталады. Ол сутегi атомының энергия деңгейлерiн анықтайды. Энергияның терiс таңбалы болуы атомдағы электронның байланысқан күйде тұрғандығын көрсететiндiгi жайында айтылған болатын.
Сутегi атомындағы электрон энергиясының ең аз мәнiне (байланыс энергиясының ең үлкен шамасына) n=1 саны сәйкес келедi. n болғанда энергия Еn0 болады. Бұл электронның шексiздiктегi тыныштық күйiне сәйкес келедi. n саны өскенде көршi энергия деңгейлерiнiң ара қашықтығы кемидi және нөлге асимптотикалық ұмтылатын болады. Бұл n кванттық санының мәндерi үлкен болған жағдайда энергияның үздіксiз дерлiк өзгеретiндiгiн, ал n кiшi болған жағдайда энергия мәндерi секiрмелi түрде өзгеретiндiгiн көрсетедi.