
- •1.4. Спектрлердi зерттеу құралдары
- •1.2-Сурет. Айнымалы ток доғасы генераторының электрлiк схемасы:
- •1.3-Сурет
- •1.5-Сурет
- •1.5. Жұмыстың орындалу тәртiбi.
- •1.8-Сурет
- •1.9-Сурет
- •1.7. Бақылау сұрақтары
- •2. Атомдық спектрлерді заттың химиялық құрамын анықтау үшін қолдану
- •2.1. Жұмыстың мақсаты мен мазмұны
- •2.2. Аппаратура
- •2.4. Жұмыстың орындалу ретi
- •3. Сутегі атомы спектрін зерттеу, ридберг тұрақтысын және электрон массасын анықтау
- •3.1. Жұмыстың мақсаты мен мазмұны
- •3.3. Қысқаша теориялық мәлiметтер
- •3.1-Сурет. Суретте бiрнеше ауысулардың жиiлiктерi келтiрiлген.
- •3 38.2-Сурет
- •3.4. Тәжiрибе жасауға арналған қондырғы
- •3.3-Сурет
- •4. Сілтілік металдар спектрлеріндегі сериялық заңдылықтарды зерттеу
- •4.1. Жұмыстың мақсаты мен мазмұны
- •4.2. Жұмыс орындалатын тәжiрибелiк қондырғы
- •4.6-Сурет
- •4 52.7-Сурет
- •4.4. Жұмыстың орындалу ретi
- •4.5. Бақылау сұрақтары
- •5. Натрий спектрлік сызықтарының нәзік түзілісін зерттеу
- •5.1.Жұмыстың мақсаты мен мазмұны
- •5.2. Аппаратура
- •5.3. Теориялық кiрiспе
- •5.4. Тәжiрибелiк қондырғы
- •5.5. Жұмыстың орындалу ретi
- •5. Бақылау сұрақтары
- •Екі валентті электроны бар атомдар спектрінің құрылымын зерттеу
- •6.1-Сурет
- •6.4. Жұмыстың орындалуы
- •6.5. Бақылау сұрақтары
- •7. Спекрлік сызықтардың аса нәзік түзілісін зерттеу. Талий ядро спинін анықтау
- •7.1. Жұмыстың мақсаты мен мазмұны
- •7.2. Аппаратура
- •7.3. Теориялық кiрiспе
- •7.4. Спектрлiк сызықтардың аса нәзiк түзілiсi (ант).
- •7.1-Сурет
- •7.4. Тәжiрибе жүргізуге арналған қондырғы
- •7.5. Жұмыстың орындалу ретi
- •7.5-Сурет. TlI 535,046 нм сызықтың аса нәзiк және изотоптық түзілiсi
- •7 85.6-Сурет. Фабри-Перо интерферометрi мен исп-30 (исп-28) спектрографы қосақталған қондырғы
- •7.6. Бақылау сұрақтары
- •8. Гелий, неон атомдары және гелий-неон лазері шығаратын электромагниттік сәуле спектрін зерттеу. Лазердің жұмыс істеу принципі
- •8.2. Аппаратура
- •8.3. Қысқаша теория
- •8.7-Сурет
- •8.8-Сурет
- •8.5. Бақылау сұрақтары
- •9. Молекулаллық спектрдің құрылымын зерттеу және cn молекуласының атомаралық қашықтығын анықтау
- •9.3-Сурет
- •9 113.4-Сурет
- •9.5-Сурет
- •9.6. Бақылау сұрақтары
- •Мазмұны
6.1-Сурет
(
70
Деңгейшелер саны мультиплеттiк деп аталады. Екi электроннан тұратын жүйеде s=0 және s=1, демек, мультиплеттiк 1 және 3-ке тең бола алады, дара деңгейлер (синглеттер) және триплеттiк деңгейлер түзіледi. Энергия деңгейлерiнiң мультиплеттiгiнен атомның шығару спектрiндегi сызықтардың өзара орналасуында өзiне тән заңдылықтар пайда болады. Спектрлердi талдау ең алғаш атомдардың энергетикалық деңгейлерiнiң салыстырмалы орналасуы, және атомдардың электрондық құрылымы жөнiнде деректер алуға, және де энергетикалық деңгейлердiң мультиплеттiк түзілiсiн электронның өзiне тән, өзгеше және елеулi қасиетi-спиндiк импульс моментiмен байланыстыруға мүмкіндiк бердi.
Жұмыста Cd,
Hg,
Zn
атомдары буларының сәуле шығару спектрi
зерттеледi. Cd,
Hg,
Zn
атомдарының сыртқы электрондық
қабықшасында екi электрон болады, iшкi
қабықшалардың қорытқы
![]() және
және
![]() импульс
моменттерi нөлге тең.
импульс
моменттерi нөлге тең.
6.2-суретте сынап атомының энергетикалық деңгейлер схемасы және бұлардың арасында мүмкін болатын ауысулар келтiрiлген. Қалыпты (негiзгi) күйде сыртқы электронның екеуi де 6s-электрондар болып табылады, өйткенi бұлардың бас кванттық сандары n=6, ал орбиталық кванттық сандары 0. Электрондардың бiреуi әрқашан қозбаған 6s-күйде қалып қояды, ал екiншiсi кванттық сандары өзгерiп, қоздырылады. 10 күйiнде қалатындықтан, қорытқы L саны 2-мен дәл келедi. Қорытқы спиндiк импульс моментi, жоғарыда айтылғандай, s=0 және s=1 болады.
Көп электронды
атомдардағы спектрлiк
сызықтардың пайда болуына жауапты
электрондардың энергетикалық деңгейлерiн
(күйлерiн)
![]() термдермен сипаттайды, мұндағы LS,
P,
D,...
(L=0,
1, 2,...cандары
үшін).
Терм белгiсiндегi
жоғарғы сол жақтағы индекс деңгейдiң
мультиплеттiгiн,
төменгi
оң жақтағы индекс-J
санын
анықтайды.
термдермен сипаттайды, мұндағы LS,
P,
D,...
(L=0,
1, 2,...cандары
үшін).
Терм белгiсiндегi
жоғарғы сол жақтағы индекс деңгейдiң
мультиплеттiгiн,
төменгi
оң жақтағы индекс-J
санын
анықтайды.
6.1-кесте
|
1-элек трон |
2-элек трон |
L |
S=0
|
S=1
| ||
|
|
|
|
J |
терм |
J |
терм |
|
6s |
6s |
0 |
0 |
1S0 |
1 |
3S1 |
|
6s |
6p |
1 |
1 |
1P1 |
0,1,2 |
3P0; 3P1; 3P2 |
|
6s |
7s |
0 |
0 |
1S0 |
1 |
3S1 |
|
6s |
7p |
1 |
1 |
1P1 |
0,1,2 |
3P0; 3P1; 3P2 |
|
6s |
6d |
2 |
2 |
1D2 |
1,2,3 |
3D1; 3D2; 3D3 |
71
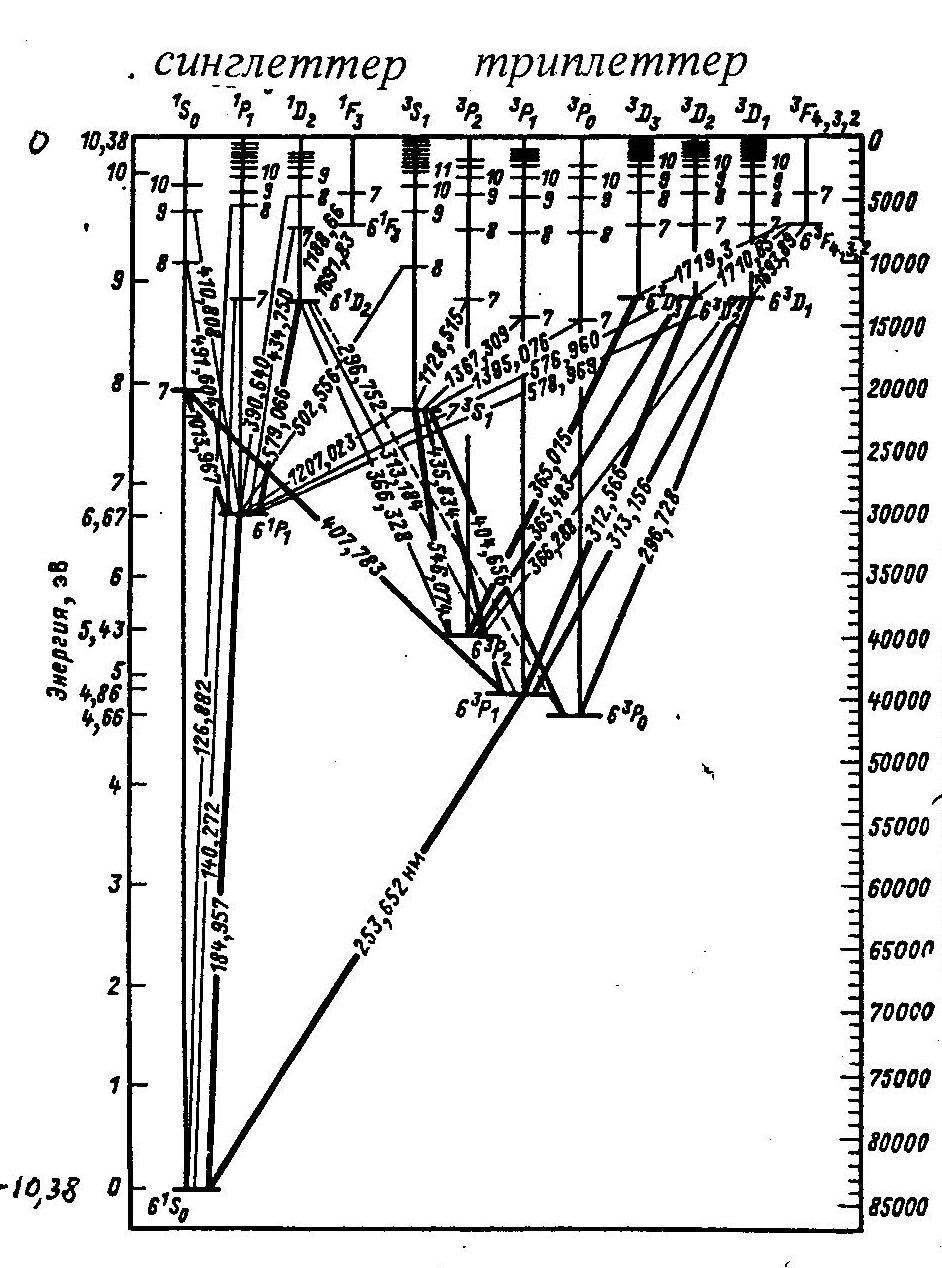
6.2-сурет
Сынап атомының мүмкін күйлерi 6.1-кестеде келтiрiлген.
6.2-суретте тiк бағытта атомның толық энергиясы салынған. Атом энергиясының нөлдiк мәнiне атомнан бiр электронды бөлiп алуға сәйкес энергия алынған, сондықтан атом энергиясы терiс болады. 6, 7, 8... сандары валенттiк электронның n=1,2,3,4,5 қабықшаларда сынап атомының 78 iшкi электроны орналасқан. Бұл электрондар оптикалық спектрдiң шығарылуына қатыспайды. Сынап атомының қалыпты (негiзгi) күйiне сәйкес энергия деңгейi (61S0) 10,43 эВ тереңде жатыр; бұл сынап атомының иондану жұмысы 10,43 эВ болады деген мағына бiлдiредi. 6.2-суретте деңгейлер арасындағы мүмкін кванттық ауысулар да кескiнделген (ауысулар кезiнде L=1, J=0,1 кванттық-механикалық сұрыптау ережелерi орындалады).
Сынап атомының сипаттаушы спектрлiк сызықтары мына кванттық ауысуларға сәйкес келедi:
6 3Р1 61S0 -=253,7 нм; 7 3S1 6 3Р1 -2=435,8нм;
7 3S1 6 3Р0 -1=546,1нм; 7 3S 6 3Р2 -3=404,7нм;
М
72
