
Вольдман - фхтс часть 1 (2007)
.pdfПри переходе ионов из объема на поверхность или с поверхности в объем дефекты имеют одинаковое название, но относятся к разным подрешеткам (т.е.
включают названия обоих ионов):
–эквивалентные количества вакансий катионов и анионов (эти дефекты называют дефектами по Шоттки, а механизм их образования – «Шоттки»);
–эквивалентные количества катионов и анионов в междоузлиях (эти дефекты называют антидефектами по Шоттки, а механизм их образования – «анти-Шоттки»).
2.3. ВОЗНИКНОВЕНИЕ ТЕПЛОВЫХ ЭЛЕКТРОННЫХ ДЕФЕКТОВ
Кроме нарушения идеального расположения ионов, тепловая энергия может
расходоваться на перемещение электронов, приводящее к возникновению в кристалле электронных дефектов (электронной разупорядоченности).
При образовании ионного кристалла атомы металла отдают электроны с внешней s-оболочки и превращаются в катионы с устойчивой электронной структурой предшествующего инертного газа (с заполненной внешней p-оболочкой).
Атомы металлоида присоединяют электроны и достраивают свою внешнюю электронную оболочку, превращаясь в анионы с устойчивой электронной структурой ближайшего следующего инертного газа. При таком размещении электронов энергия кристалла минимальна – разрешенные зоны с низкой энергией заполнены целиком,
а в разрешенных зонах с более высокой энергией электроны отсутствуют; все
электроны локализованы у своих ядер и не могут перемещаться по кристаллу.
Перемещение электронов от узла к узлу становится возможным, если они
переходят в ближайшую свободную разрешенную зону; для этого электроны должны обладать энергией, достаточной для преодоления запрещенной зоны, или энергетической щели – промежутка между разрешенными зонами. Эту энергию
(ширину запрещенной зоны) обозначают Eg (индекс – первая буква английского слова gap – промежуток, зазор).
Если электрон, находящийся в заполненной зоне с наибольшей энергией (в
валентной зоне) получает энергию, равную Eg, он переходит в ближайшую свободную разрешенную зону (зону проводимости) и получает возможность
перемещаться от узла к узлу. В электрическом поле такие электроны будут
перемещаться направленно от «+» к «-» – т. е. будут переносить заряд – и
соответственно обеспечат электрическую проводимость кристалла. Поэтому такие
электроны называют электронами проводимости; в дальнейшем они обозначаются
21
www.mitht.ru/e-library
e . После ухода электрона в валентной зоне возникает дефицит электрона –
«электронная вакансия». При этом узел с электронной вакансией приобретает по
сравнению с таким же узлом без электронной вакансии избыточный положительный заряд, равный по величине заряду электрона. Таким образом, вакансия электрона имеет заряд +1. Общепринятое название электронной вакансии – «дырка», а
обозначается она e .
Электроны от узлов с заполненными уровнями могут переходить к соседнему узлу с электронной вакансией, при этом им не нужно преодолевать энергетический барьер благодаря квантовомеханическому туннельному эффекту. Скачок электрона в вакансию электрона соседнего узла соответствует перемещению дырки в
обратном направлении; очевидно, в электрическом поле дырки перемещаются от «-»
к «+».
Процесс образования пары электронных дефектов – электрона проводимости
и дырки – можно описать следующим образом:
электрон в валентной зоне электрон в зоне проводимости + + дырка в валентной зоне
(процесс обратим, поскольку электрон может вернуться из зоны проводимости в валентную зону),
или, с учетом того, что нахождение электрона в валентной зоне – это его нормальное состояние,
ее е + е , |
(13) |
0 е + е . |
(14) |
2.4. КОНСТАНТЫ РАВНОВЕСИЯ ПРОЦЕССОВ ОБРАЗОВАНИЯ
ТЕПЛОВЫХ ДЕФЕКТОВ
2.4.1. Константа равновесия образования дефектов по
Френкелю в катионной подрешетке
В уравнении (1)
MeMez z Meiz + VMez
на самом деле отсутствует еще один «нормальный» элемент структуры – свободное междоузлие (в дальнейшем обозначаем I), в которое переходит катион. Поэтому
22
www.mitht.ru/e-library
полное уравнение имеет вид
Mez z |
+ I Mez + Vz |
(15) |
|
Me |
i |
Me |
|
или, для z = 2,
Me2 |
2 |
+ I Me2 + V2 . |
(16) |
|
Me |
|
i |
Me |
|
Число образующихся в единицу времени в единице объема межузельных
катионов NMe2i и равное ему число вакансий катиона NVMe2 прямо пропорциональны
числу катионов, |
способных |
|
перейти |
в междоузлия, |
NMe2 |
2 и числу свободных |
|||||
|
|
|
|
|
|
|
|
|
|
Me |
|
междоузлий NI, т. е. |
|
|
|
|
|
|
|
|
|||
dN |
2 |
|
dN 2 |
|
|
|
|
|
|||
|
|
Mei |
|
|
VMe |
|
|
fакт N |
2 NI, |
(17) |
|
|
|
|
|
||||||||
|
dτ |
|
|
dτ |
|
|
MeMe2 |
|
|
||
|
обр |
|
обр |
|
|
|
|||||
где fакт – частота (т. е. число в единицу времени) активных колебаний 1 катиона,
приводящих к «внутреннему испарению», зависящая от свойств кристаллической решетки и температуры.
Если вместо чисел дефектов структуры в единице объема кристаллической
решетки использовать концентрации, уравнение приобретает форму,
соответствующую уравнениям скорости химических реакций:
dC |
2 |
dC |
2 |
|
|
|
||||
|
|
Mei |
|
|
VMe |
|
kобр C |
2 СI; |
(18) |
|
|
|
|
||||||||
|
dτ |
|
|
dτ |
|
|
|
MeMe2 |
|
|
|
обр |
|
|
обр |
|
|
|
|||
здесь kобр соответствует константе скорости прямой реакции: kобр k .
Втеории разупорядоченности концентрацию выражают величиной,
аналогичной атомной или мольной доле: долей узлов от их общего числа в обеих
подрешетках или междоузлий, занятых данным элементом структуры или дефектом.
Таким образом, число вакансий и катионов, находящихся в нормальном положении, при определении их концентраций нужно относить к общему числу узлов, а число межузельных катионов и свободных междоузлий – к общему числу междоузлий:
C |
|
NV2- вед.объема |
|
|
NV2- |
|
|
|
NV2- |
|
|||||||||
2- |
|
|
Me |
|
|
|
|
|
|
|
Me |
|
|
|
|
Me |
, |
(19) |
|
N узлов |
|
|
|
|
|
2 NX02 |
|
|
|
||||||||||
VMe |
в ед.объема NMe0 |
|
|
|
N0 |
|
|||||||||||||
|
|
|
N |
2 |
|
|
0 |
|
|
|
0 |
|
|
|
|
|
|
|
|
C |
2 |
|
|
MeMe2 |
|
NMe2 NVMe2- |
|
|
NMe2 |
C |
2- |
, |
|
(20) |
|||||
|
0 |
|
0 |
|
|
0 |
|
||||||||||||
Me |
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|||||
|
Me2 |
|
|
N |
|
|
N |
|
|
N |
|
Me |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
23
www.mitht.ru/e-library

|
|
|
N |
2 |
|
|||
CMei2 |
|
Mei |
|
, |
|
(21) |
||
|
0 |
|
||||||
|
|
|
NI |
|
|
|
|
|
|
|
NI0 N |
|
2 |
|
|||
CI |
|
|
|
Mei |
. |
(22) |
||
|
|
|
||||||
|
|
|
NI0 |
|
|
|
|
|
С помощью схемы, показанной на рис. 12, определим соотношение между N0
и NI0 .
Х2- Ме2+ Х2- Ме2+ Х2-
I I I I
Ме2+ Х2- Ме2+ Х2- Ме2+
I I I I
Х2- Ме2+ Х2- Ме2+ Х2-
I I I I
Ме2+ Х2- Ме2+ Х2- Ме2+
Рис. 12. Схема к определению соотношения между числом узлов и междоузлий
Вокруг каждого узла расположены 4 междоузлия, а вокруг каждого междоузлия
– 4 узла, следовательно, NI0 = N0 и
|
N |
2 |
|
|
CMei2 |
|
Mei |
, |
(23) |
|
0 |
|||
|
N |
|
||
|
|
|
NI0 N |
2 |
|
|
|
C |
I |
|
|
Mei |
1 C |
2 . |
(24) |
0 |
|
||||||
|
|
|
Mei |
|
|||
|
|
|
N |
|
|
|
|
Электроны проводимости и дырки локализованы в узлах, поэтому
C |
- |
|
Ne- |
, |
(25) |
|
|
N0 |
|||||
e |
|
|
|
|
|
|
C |
|
|
Ne |
. |
(26) |
|
|
|
|||||
e |
|
|
N0 |
|
|
|
Подставив концентрации в выражение скорости образования дефектов (18),
получим:
dC |
2 |
dC 2 |
|
|
|
0 |
|
|
|
|
||||
|
Mei |
|
|
VMe |
|
|
k |
|
NMe2 |
C |
2- 1 C 2 . |
(27) |
||
dτ |
|
dτ |
N0 |
|||||||||||
|
|
|
|
|
|
|
|
VMe |
Mei |
|
||||
|
|
|
обр |
|
|
обр |
|
|
|
|
|
|
|
|
Скорость обратного процесса – исчезновения дефектов пропорциональна
24
www.mitht.ru/e-library

произведению их концентраций: |
|
|
|||||||||
dC |
2 |
|
dC |
2 |
|
|
|
||||
|
Mei |
|
|
|
VMe |
kCMei2 CVMe2- |
, |
(28) |
|||
|
dτ |
|
|
|
dτ |
|
|
||||
|
|
|
исч |
|
|
|
|
исч |
|
|
|
здесь k kисч.
Суммарная скорость изменения концентрации дефектов равна разности
скоростей их образования и исчезновения:
dC |
2 |
dC 2 |
|
0 |
|
|
|
|
|
Mei |
|
VMe |
k |
NMe2 |
C 2- 1 C 2 –kC |
2 C 2- . (29) |
|||
dτ |
|
dτ |
N0 |
||||||
|
|
|
VMe |
Mei |
Mei |
VMe |
|||
|
|
|
|
|
|
|
|
|
|
Проанализируем с помощью уравнения (29), как будет изменяться во времени концентрация дефектов, если кристалл с температурой, равной 0 К, т.е. с полным отсутствием тепловых точечных структурных дефектов, мгновенно нагреть до T >
0 К. Вначале, пока концентрации дефектов очень малы, преобладает процесс их образования, но по мере увеличения концентрации скорость образования дефектов уменьшается и одновременно растет скорость их исчезновения. В конце концов,
скорости образования и исчезновения дефектов становятся одинаковыми и их
концентрации перестают изменяться – устанавливается динамическое равновесие.
Из условия равновесия
dC 2 |
|
|
dC 2 |
|
|
|
|
|
|
||||||||
|
|
|
Mei |
|
|
|
|
|
VMe |
|
|
0 |
|
|
|
|
|
|
|
dτ |
|
dτ |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
равн |
|
|
|
равн |
|
|
|
|
|
||||
следует: |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
0 |
|
|
|
|
|
|
1 C |
2 |
=k C 2 C 2- . |
|
||||
k |
|
NMe |
2 |
C |
2- |
|
(30) |
||||||||||
N 0 |
|||||||||||||||||
|
|
|
|
VMe |
|
|
Me i равн |
Mei |
VMe равн |
|
|||||||
|
|
|
|
|
|
|
|
равн |
|
|
|
|
|
|
|||
Для равновесных концентраций используется специальное обозначение – |
|||||||||||||||||
круглые скобки. Соответственно |
|
|
|
|
|||||||||||||
C |
2- |
|
VMe2- , |
|
|
|
|
|
|
|
|
||||||
|
VMe равн |
|
|
|
|
|
|
|
|
|
|
|
|
||||
C |
|
2 |
Mei2 , |
|
|
|
|
|
|
||||||||
|
|
Mei равн |
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ce- равн e- ,
Ce равн e .
Используя эти обозначения и преобразовав уравнение (30), получаем:
|
|
|
|
0 |
|
|
|
|
|
Me2 V2- |
= |
k |
|
NMe2 |
V2- |
1 Me2 . |
(31) |
||
N0 |
|||||||||
i Me |
|
k |
Me |
|
i |
|
|||
|
|
|
|
|
|
|
|
|
|
25
www.mitht.ru/e-library
Равновесные концентрации тепловых точечных дефектов даже вблизи температуры плавления не превышают 10–5 – 10–4, т.е. всегда
2- |
|
NMe0 2 |
|
|
|
2 |
|
|||
VMe |
<< |
|
|
|
|
и Mei |
|
<< 1, |
||
|
N0 |
|
|
|
||||||
поэтому |
|
|
|
|
|
|
|
|
||
2 |
2- |
|
k |
|
N0 2 |
|
|
|||
|
|
|
Me |
|
|
|||||
Mei |
VMe |
= |
|
|
|
|
= const |
|||
k |
|
N0 |
|
|||||||
– это константа равновесия образования тепловых дефектов по механизму |
||||||||||
«Френкель»: |
|
|
|
|
|
|
|
|
||
KФ = Mei2 VMe2- . |
|
(32) |
||||||||
2.4.2. Константы равновесия образования других
тепловых дефектов
Образование тепловых точечных структурных дефектов по
механизму «анти-Френкель»:
уравнение образования антидефекта Френкеля для двухзарядного аниона
0 Xi2 + VX2 , |
|
константа равновесия процесса |
|
KаФ = Xi2 VX2 . |
(33) |
Образование эквивалентных количеств вакансий катионов и анионов
(механизм образования «Шоттки») на примере соединения Ме2Х3, состоящего из
трехзарядных катионов и двухзарядных анионов:
0 2VMe3 + 3VX2 , |
|
константа равновесия процесса |
|
KШ = VMe3 2 VX2 3 . |
(34) |
Образование эквивалентных количеств межузельных катионов и
анионов (механизм образования «анти-Шоттки»), также на примере
соединения Ме2Х3:
26
www.mitht.ru/e-library

0 2Mei3 + 3Xi2 , |
|
константа равновесия процесса |
|
KаШ = Mei3 2 Xi2 3 . |
(35) |
Образование электронных дефектов: |
|
0 е + е , |
|
константа равновесия процесса (константа ионизации) |
|
Kи = (е )(е ). |
(36) |
Выражения констант равновесия (32) – (36) полностью отвечают уравнениям соответствующих обратимых процессов: так как исходные вещества в левой части
уравнений отсутствуют, в выражениях констант равновесия нет знаменателей. На самом деле, как обсуждалось применительно к уравнению (15), в процессах
участвуют MeMe2 2 , X2X2 и I, но их концентрации при этом практически не изменяются,
а постоянные концентрации или активности включаются в константу равновесия.
Аналогичные выражения получаются при описании равновесий
малорастворимая соль – раствор. Так, например, уравнение обратимой реакции
растворения хлорида серебра имеет вид
AgClтв Ag+р-р + Cl–р-р,
и ему соответствует константа равновесия
|
a |
Ag |
a |
Cl |
|
||||
|
|
|
|
|
|||||
Keq = |
|
|
|
|
|
|
|
|
. |
|
|
a |
|
|
|
|
|||
|
|
|
AgCl |
|
|
||||
|
|
|
|
|
равн |
||||
Но поскольку aAgCl = 1 (активность индивидуального твердого вещества),
Keq = {aAg aCl }равн .
Концентрации
AgClтв, очень малы,
от единицы; при Ag
ионов Ag+ и Cl– в растворе, равновесном по отношению к
икоэффициенты активности ионов практически не отличаются
Cl 1 равновесные активности ионов равны их равновесным
концентрациям, выраженным в моль/л, и справедливо известное уравнение
[Ag+][Cl–] = Keq = ПРAgCl, |
(37) |
в котором ПРAgCl – произведение растворимости хлорида серебра.
Для более сложного вещества – ортофосфата кальция Са3(РО4)2 равновесие с раствором описывается уравнением
Са3(РО4)2 тв 3Са2+р-р + 2РО43–р-р,
27
www.mitht.ru/e-library
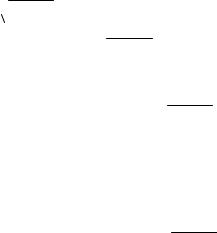
и условие равновесия имеет вид |
|
[Ca2+]3[PO43-]2 = ПРCa3 (PO4 )2 . |
(38) |
Вследствие сходства выражений (32) – (36) |
с (37) и (38) уравнения, |
описывающие равновесия тепловой разупорядоченности, называют уравнениями типа произведений растворимости.
Следует отметить очень важное свойство равновесий тепловой разупорядоченности, также аналогичное свойству произведений растворимости.
При растворении AgCl в воде [Ag+] = [Cl–], и из уравнения (37) следует [Ag+] =
[Cl–] = 
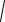 ПРAgCl . Добавление в раствор NaCl приведет к увеличению концентрации
ПРAgCl . Добавление в раствор NaCl приведет к увеличению концентрации
ионов Cl–: [Cl–] > 
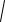 ПРAgCl , но условие равновесия (37) остается в силе, и
ПРAgCl , но условие равновесия (37) остается в силе, и
концентрация ионов серебра уменьшится:
[Ag+] = ПРAgCl /[Cl–] < 
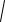 ПРAgCl ,
ПРAgCl ,
т. е. некоторое количество Ag+ выделится из раствора в виде AgClтв.
Аналогично при добавлении в раствор AgNO3 увеличение концентрации ионов
Ag+ приведет к уменьшению концентрации ионов Cl– [Cl–] = ПРAgCl /[ Ag+] < 
 ПРAgCl ,
ПРAgCl ,
вследствие выделения из раствора AgClтв.
Точно так же всегда выполняются условия равновесия процессов тепловой
разупорядоченности (32) – (36): если по какой-то причине концентрация одного из дефектов увеличивается, это приводит к уменьшению концентрации дефекта,
сопряженного с ним в соответствующем уравнении равновесия тепловой
разупорядоченности.
2.4.3.Расчет равновесной концентрации тепловых
дефектов
В каждом из процессов образования тепловых дефектов одновременно образуются два вида дефектов, т. е. определять нужно 2 концентрации, и
соответственно необходимы 2 уравнения. Первое из этих уравнений – выражение константы равновесия обратимого процесса образования данных дефектов, а
второе – соотношение между концентрациями образующихся дефектов, отвечающее стехиометрическим коэффициентам уравнения их образования.
28
www.mitht.ru/e-library

Рассмотрим методику расчета на примере ионного кристалла Ме2Х3
2Ме3+·3Х2-.
Концентрации катионов в междоузлиях и вакансий катионов (механизм образования тепловых дефектов «Френкель»):
0 Me3i + VMe3
Система уравнений:
Me3i VMe3- = KФ;
Me3i = VMe3- .
Заменив в первом уравнении концентрацию одного из дефектов на равную ей концентрацию другого, получим:
Me3i = VMe3- = KФ1/2 .
Концентрации анионов в междоузлиях и вакансий анионов (механизм образования дефектов «анти-Френкель»):
0 X2i + VX2
Система уравнений:
Xi2 VX2 = KаФ;Xi2 = VX2 .
Заменив в первом уравнении концентрацию одного из дефектов на равную ей
концентрацию другого, получим:
Xi2 = VX2 =KаФ1/2 .
Концентрации вакансий катионов и анионов (механизм образования
«Шоттки»):
0 2VMe3 + 3VX2 .
Система уравнений:
VMe3 2 VX2 3 = KШ;
VMe3 : VX2 = 2:3.
Выразив из второго уравнения концентрацию вакансий катиона через концентрацию вакансий аниона
VMe3 =23 VX2
и подставив в первое уравнение, получим
23 VX2 2 VX2 3 = KШ,
29
www.mitht.ru/e-library

откуда
VX2 5 = (3/2)2KШ,
и концентрация вакансий аниона
VX2 = [(3/2)2KШ]1/5.
Теперь определим концентрацию вакансий катиона:
VMe3 =23 VX2 =(2/3)[(3/2)2KШ]1/5 =(2/3)5/5(3/2)2/5KШ1/5=[(2/3)3KШ]1/5.
Очевидно, этот же результат можно было получить, подставив в первое
уравнение VX2 =32 VMe3 .
Концентрации катионов и анионов в междоузлиях (механизм
образования «анти-Шоттки»):
0 2Me3i + 3Xi2 .
Система уравнений:
Me3i 2 Xi2 3 = KаШ;
Me3i : Xi2 = 2:3.
Ход решения такой же, как в предыдущем случае:
Me3i =23 X2i ,
32 Xi2 2 Xi2 3 = KаШ,
Xi2 5 = (3/2)2KШ,
Xi2 = [(3/2)2KаШ]1/5,
Me3i = [(2/3)3KаШ]1/5.
Концентрации электронных дефектов: уравнение образования
0 е + е ,
система уравнений
(е )(е ) = Kи; (е ) = (е ),
и соответственно
(е ) = (е ) = Kи1/2 .
30
www.mitht.ru/e-library
