
Вольдман - фхтс часть 1 (2007)
.pdf
I |
Ie |
II |
Ме0(тв |
МеX(тв |
Х2 (газ) |
|
|
Ii |
x |
|
dx |
|
|
|
|
|
δ |
Рис. 21. Электрическая схема процесса образования твердого продукта dx – толщина элементарного слоя продукта, параллельного поверхностям
раздела фаз; x – расстояние от границы I до элементарного слоя;
δ – полная толщина слоя продукта (расстояние между границами I и II)
Границы (поверхности раздела фаз) I и II можно сравнить с 2 пластинами,
между которыми протекает в одном направлении электронный ток (по проводнику 1-
го рода – металлическому) и в противоположном направлении ионный ток (по
проводнику 2-го рода – электролиту), причем эти токи имеют одинаковую силу. Это
сразу же приводит к выводу, что электрической моделью процесса может служить
гальванический элемент (рис. 22).
|
Ie |
3 |
4 |
|
|
|
Направление движения |
|
Направление движения |
2 |
1 |
|
|
|
Направление движения анионов |
|
Ii |
Рис. 22. Электрическая модель процесса образования твердого продукта
1, 2 – металлические пластины; 3 – электролит; 4 – внешняя цепь
91
www.mitht.ru/e-library

Следовательно, для определения силы тока, протекающего в нашей системе,
можно использовать соотношения, известные для гальванического элемента:
I E ; re ri
здесь Е – электродвижущая сила (э.д.с.); re – сопротивление внешней (external) цепи,
по которой идет электронный (electron) ток; ri – сопротивление внутренней (internal)
цепи, по которой идет ионный (ion) ток.
6.3.СООТНОШЕНИЯ, ОПРЕДЕЛЯЮЩИЕ СИЛУ ТОКА
Внашей системе Е – разность потенциалов между границами I и II, а re и ri –
сопротивление слоя продукта прохождению соответственно электронного и ионного
токов.
Для элементарного слоя твердого продукта толщиной dx, расположенного на расстоянии х от границы I (см. рис. 21), через который проходят те же токи,
получаем:
I |
dE |
. |
(81) |
|
dre dri
Значения dre и dri определяются известными выражениями:
dre = ρe |
|
dx |
= |
1 |
|
|
dx |
, |
||||
|
|
|
|
e |
|
|
||||||
|
|
S |
|
|
S |
|||||||
dri = ρi |
dx |
= |
1 |
|
dx |
, |
||||||
|
|
|
|
|||||||||
|
S |
i |
S |
|||||||||
где S – площадь поверхностей контакта Ме/МеХ и МеХ/Х2;
ρe и κe , ρi и κi – соответственно удельные электрические сопротивления и
электрические проводимости МеХ по отношению к электронному и ионному токам.
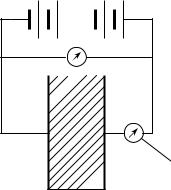
Простейшая измерительная схема для определения электрических проводимостей κe и κi показана на рис. 23.
92
www.mitht.ru/e-library
…...  4
4
3
2
5
1
Рис. 23. Принципиальная измерительная схема для
определения электрических проводимостей
1– образец для измерений (площадь боковых поверхностей S, толщина L);
2– токоподводящие обкладки; 3 – вольтметр; 4 – источник напряжения;
5 – амперметр
Если ток в пластине переносится и электронами, и ионами, то сила общего
(суммарного) тока
I0 = Iе + Ii.
Долю общего тока, переносимую каждым из носителей (т. е. каждым из видов перемещающихся заряженных частиц) называют числом переноса данного носителя; очевидно, сумма чисел переноса всех носителей равна 1. При переносе
тока электронами и ионами
ne = Iе/I0, ni = Ii/I0, ne + ni = 1.
Определив Iе и Ii, можно рассчитать ne, ni, κe, κi и полную (общую)
электрическую проводимость κ0. Используемые соотношения следуют из закона
Ома:
I0 |
= |
U |
|
|
U |
0 |
|
US |
; |
|
|
|
||||
|
|
(1/ |
|
)(L/ S) |
|
|
|
|
|
|||||||
|
|
R |
0 |
|
|
L |
|
|
|
|||||||
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Iе |
= |
U |
|
|
U |
|
e |
US |
= ne I0 = ne |
|
US |
, |
||||
|
(1/ e)(L/ S) |
|
||||||||||||||
|
|
|
|
|||||||||||||
|
|
Re |
|
|
L |
0 L |
||||||||||
откуда
κe = neκ0;
93
www.mitht.ru/e-library
Ii = |
U |
|
U |
i |
US |
= niI0 = ni |
|
US |
, |
|
(1/ i )(L/S) |
|
|||||||
|
|
|
|||||||
|
Ri |
|
L |
0 L |
|||||
откуда
κi = niκ0.
Выразим dre и dri в уравнении (70) с использованием κ0 и чисел переноса:
dre = |
|
|
1 |
|
|
|
dx |
= |
1 |
|
|
|
|
|
dx |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
e |
|
|
|
|
S |
|
|
0 |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
dri = |
|
1 |
|
|
|
dx |
= |
1 |
|
|
|
|
|
dx |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
i |
|
|
|
|
S |
|
0 |
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
I |
|
|
|
|
|
|
|
|
|
|
|
|
dE |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dE |
|
|
|
|
|
|
dE |
|
|
, |
||||||||||
|
|
|
|
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
n n |
|
|
dx |
|
1 |
|
|||||||||||||||||||||||
|
|
dx |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
dx |
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
i e |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
n |
|
|
|
|
|
|
|
S |
n n |
|
|
|
S |
|
|
|||||||||||||||||||
|
|
0 |
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
n n |
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
e |
|
|
i |
|
|
|
0 |
|
|
e i |
|
|
|
|
|
e i |
||||||||||||||||||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
I = dE |
|
|
|
|
S |
κ0neni. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(82) |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
dx |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Рассмотрим, |
|
чем обусловлен |
перепад |
электрического потенциала dE на |
||||||||||||||||||||||||||||||||||||||||||||
элементарном слое dx и от чего зависит его величина.
Разность электрических потенциалов на слое МеХ в целом связана с тем, что на границе I образуются катионы Ме2+, а на границе II – анионы Х2–, соответственно
концентрация и активность катионов Ме2+ выше на границе I, чем на границе II:
aMeI 2 aMeII 2 ,
а для анионов Х2– соотношение обратное:
aIX2 aIIX2 ;
по толщине слоя активности катионов и анионов непрерывно изменяются от границы к границе.
Разность активностей ионов является источником э.д.с. Это легко показать,
применив уравнение Нернста к концентрационному гальваническому элементу,
схема которого показана на рис. 24.
94
www.mitht.ru/e-library

I |
II |
4
2 |
1 |
|
|
|
3 |
aI |
2 |
aII |
2 |
Me |
|
Me |
|
Рис. 24. Схема концентрационного гальванического элемента
1, 2 – металлические пластины; 3 – электролит; 4 – электролитический ключ (солевой мостик)
Уравнение Нернста для потенциала металла в растворе его соли:
Mez /Me0 = Mez /Me0 RT lnaMez ;
zF aMe0
aМеz+ и aМе0 – соответственно активности катионов металла в растворе и металла;
если металл чистый, aМе0 = 1.
Э.д.с. элемента – это разность потенциалов составляющих его электродов:
E = φ |
II |
– φ |
I |
= |
RT |
ln |
aII z |
– |
RT |
ln |
aI |
z |
= |
RT |
(lnaII |
z lnaI |
z ). |
|
|
|
Me |
|
Me |
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
zF aMe0 zF aMe0 |
|
zF |
Me |
Me |
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
Активность ионов в растворе определяет величину их химического |
|||||||||||||||||
потенциала: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
μj = 0j |
+ RTlnaj, |
|
|
|
|
|
|
|
|
|
|
|
|
||||
и, следовательно, э.д.с. можно выразить через разность химических потенциалов катионов на границах:
|
1 |
(RT ln a |
II |
z |
RT ln a |
I |
z ) |
1 |
|
II |
z |
I |
|
, |
|
E = zF |
Me |
Me |
|
|
|
|
z |
||||||||
|
|
|
|
||||||||||||
|
|
|
|
= zF |
Me |
|
Me |
|
|||||||
1
E = zF Mez .
95
www.mitht.ru/e-library

В общем случае: если э.д.с. вызвана различием концентраций (активностей)
иона «j», то
E = j , zjF
откуда
dE = d j . zjF
В рассматриваемой системе «j» – это MezMe+ или XzX- и соответственно zj – это zMe или zХ; очевидно, рассчитывать э.д.с. можно по химическому потенциалу любого из ионов, так как разность потенциалов одна и от способа расчета зависеть не
может.
Подставив dE в уравнение (82), получим:
I = |
d j |
κ0neni |
S |
. |
(83) |
|
zjF |
dx |
|||||
|
|
|
|
Выражение (83) – это дифференциальное уравнение с 2 переменными (μj и x); после разделения переменных получим
I |
dx = |
1 |
κ0neni dμj . |
(84) |
|
|
|||
S |
zjF |
|
||
Переменная x в левой части уравнения (расстояние от границы I, см. рис. 22)
изменяется в пределах слоя продукта от 0 до δ, при этом в правой части уравнения
переменная μj изменяется соответственно от Ij до IIj . Интегрируем, используя эти
пределы:
|
I |
|
1 |
IIj |
|
|
|
0 |
|
dx |
= |
|
I |
0neni d j . |
(85) |
S |
zjF |
||||||
|
|
|
|
|
j |
|
|
Результат интегрирования левой части очевиден:
|
I |
|
I |
|
|
|
dx = |
. |
|||
|
|
||||
0 |
S |
S |
|||
|
|
|
|
||
Для того чтобы проинтегрировать правую часть, необходимо сначала установить связь подынтегральной функции с μj. Способность проводить
электрический ток и соответственно значения всех сомножителей подынтегральной функции определяются концентрациями электронов проводимости или дырок для электронного тока и концентрацией преобладающего точечного структурного
96
www.mitht.ru/e-library
дефекта для ионного тока. Но все эти концентрации зависят от давления металлоида в равновесной газовой фазе, поэтому
κ0neni = Ф(РХ2).
А поскольку под интегралом присутствует функция РХ2, целесообразно и μj
выразить через РХ2; очевидно, это проще всего сделать, если рассматривать
химический потенциал анионов XzX–, а не катионов MezMe+.
Равновесие твердой фазы, содержащей анионы XzX–, химический потенциал
которых равен μXzX–, с газовой фазой, парциальное давление металлоида в которой равно РХ2, определяется известным условием: переход бесконечно малого
количества металлоида из одной фазы в другую, не сопровождающийся изменением
составов фаз, температуры и давления, не должен приводить к изменению энергии Гиббса системы.
Если из твердой фазы в газовую перейдет dNX молей XzX-, энергия Гиббса твердой фазы изменится на величину
dGтв = -dNX· μXzX-;
в газовой фазе при этом образуется dNX/2 молей Х2, и ее энергия Гиббса изменится на величину
dGгаз = (dNX/2) μX2;= (dNX/2) ( X2 + RTlnРХ2).
Из условия равновесия следует:
dGтв + dGгаз = -dNX·μXzX- + (dNX/2) ( X2 + RTlnРХ2) = 0,
откуда
μXzX- = ( X2 + RTlnРХ2)/2,
dμ zX- = |
|
1 |
|
|
|
|
|
|
|
|
|
RT |
|
|
RT |
|
dPX |
|
|
|
||||
|
|
|
d( X |
+ RTlnР ) = |
|
|
dlnР = |
|
|
|
2 |
. |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
X |
|
|
2 |
|
|
|
|
|
2 |
|
Х2 |
2 |
|
Х2 |
2 |
|
PX2 |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Заменив в уравнении (74) zj |
на zX, |
dμj на dμXzX- |
и пределы интегрирования |
|||||||||||||||||||||
соответственно |
|
|
на |
PI |
и PII , а |
|
также подставив |
в левую часть результат |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
X2 |
|
X2 |
|
|
|
|
|
|
|
|
|
|
|
интегрирования, получим: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
I |
|
|
RT |
|
|
PII |
|
|
dPX2 |
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
X2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
= |
|
|
|
Ф PX2 |
|
. |
|
|
|
|
|
|
|
|
|
(86) |
|||||||
|
|
2z |
|
F |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
S |
X |
|
P |
I |
|
|
P |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
X2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
X2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рассмотрим физический смысл PI |
и PII . |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X2 |
X2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
97 |
www.mitht.ru/e-library
PXII – это давление газообразного металлоида, участвующего в реакции с
2
металлом; так же, как температуру, при которой осуществляется процесс, давление металлоида выбирает тот, кто проводит процесс – технолог или исследователь.
Таким образом, PII Р |
– внешнее давление Х2, величина которого должна быть |
|
|
X2 |
Х2 |
задана. |
|
|
PI |
– давление металлоида на границе Ме/МеХ. При отсутствии трещин в |
|
X2 |
|
|
слое МеХ – а мы рассматриваем образование плотного слоя продукта – молекулы Х2
не могут пройти сквозь него к поверхности металла. Для того чтобы понять, откуда же в этом случае берется газообразный металлоид на границе Ме/МеХ, представим
себе такой эксперимент: в замкнутый объем поместили какое-то количество металла и количество газообразного металлоида, недостаточное для того, чтобы весь
металл перешел в МеХ. Можно ли считать, что в этом случае взаимодействие металла и металлоида закончится после того, как будет израсходован весь
металлоид, т. е. давление металлоида станет равным нулю? Очевидно, нет: реакция
Ме(тв) + 1/2 Х2 (газ) MеХ(тв)
обратима, константа равновесия образования МеХ имеет вид
KМеХ = 1/(PX1/2 )равн,
2
и, следовательно, равновесие установится и образование МеХ закончится после
понижения давления металлоида не до нуля, а до РХ2 = 1/(KМеХ)2.
А что произойдет, если после установления равновесия откачать из объема
оставшийся газообразный металлоид? Тоже очевидно: поскольку давление станет ниже равновесного, пойдет обратная реакция – МеХ будет диссоциировать на Ме и Х2 до тех пор, пока не восстановится равновесное давление металлоида, равное
1/(KМеХ)2.
Таким образом, на границе Ме/МеХ всегда будет сохраняться постоянное (при
Т = const) давление металлоида:
PXI |
2 = (РХ2)равн МеХ = 1/(KМеХ)2; |
|
|
|
||
в дальнейшем это давление будем обозначать РХ2 (МеХ). |
|
|
|
|||
Значение РХ2 (МеХ) |
можно рассчитать, если известна величина |
~ |
~ |
– |
||
GMeX |
( GMeX |
|||||
это G° реакции, уравнение которой составлено в расчете на 1 атом Х, т. е. на 1/2 |
||||||
молекулы Х2): |
|
|
|
|
|
|
|
|
G~ |
|
|
|
|
KМеХ = exp |
MeX |
, |
|
|
|
|
|
|
|
|
|||
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
98 |
www.mitht.ru/e-library
и соответственно
|
|
|
|
2 G~ |
|
Р |
(МеХ) |
= 1/(KМеХ)2 |
= exp |
MeX |
. |
|
|||||
Х2 |
|
|
RT |
|
|
|
|
|
|
|
Уравнения реакций между Ме и Х2 целесообразно составлять на 1 атом Х
всегда – независимо от состава образующегося соединения. В этом легко убедиться,
сравнив выражения констант равновесия и формулы для расчета равновесного давления металлоида при обычной форме записи уравнения реакции (на целое число молей) и при составлении уравнений в расчете на 1 атом Х (на 1/2 молекулы Х2). В качестве примера рассмотрим уравнения реакций образования Ме2Х3 и МеХ2.
Обычная форма записи:
4 Ме(тв) + 3 Х2 (газ) 2 Mе2Х3 (тв)
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
= 1/ P |
3 |
|
P |
|
|
|
GMe2X3 |
|
|
||||
К |
, |
= 1/K1/3 |
= exp |
|
|
; |
||||||||
|
|
|
||||||||||||
Ме2Х3 |
X2 равн |
X2 равн |
Me2X3 |
|
3RT |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ме(тв) + Х2 (газ) MеХ2 (тв) |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||||
К |
= 1/ P |
|
, |
P |
|
= 1/K |
= exp |
GMe2X3 |
|
|
|
|||
|
|
|||||||||||||
МеХ2 |
X2 |
равн |
|
X2 |
равн |
|
Me2X3 |
|
RT |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
– каждому составу образующегося соединения отвечает свое выражение константы
равновесия и своя формула для расчета равновесного давления через G° реакции.
Запись на 1 атом Х (на 1/2 молекулы Х2):
2/3 Ме(тв) + 1/2 Х2 (газ) 1/3 Mе2Х3 (тв)
|
|
|
|
|
|
|
|
|
~ |
|
|
|
= 1/ P |
1/2 , |
P |
|
|
|
2 G |
||
К |
Х3 |
= 1/K2 |
2X3 |
= exp |
Me2X3 |
; |
||||
|
||||||||||
Ме2 |
X2 |
равн |
X2 |
равн |
Me |
|
RT |
|
||
|
|
|
|
|
|
|
|
|
|
|
1/2 Ме(тв) + 1/2 Х2 (газ) 1/2 MеХ2 (тв)
|
= 1/ P |
1/2 , |
P |
|
|
|
|
2 G~ |
|
К |
= 1/K2 |
|
= exp |
MeX2 |
|
||||
|
|
||||||||
МеХ2 |
X2 |
равн |
X2 |
равн |
MeX |
2 |
|
RT |
|
|
|
|
|
|
|
|
|
|
|
– выражения константы равновесия и формулы для расчета равновесного давления через G° реакции одинаковы для любого состава образующегося соединения, что,
конечно, очень удобно.
В связи с этим в дальнейшем всегда используем только форму записи уравнения реакции на 1 атом Х (на 1/2 молекулы Х2).
И в заключение рассмотрим, какой порядок имеют значения PXI2 РХ2 (МеХ).
Равновесное давление Х2 над стабильными сложными веществами (т. е. давление
диссоциации) ничтожно мало:
99
www.mitht.ru/e-library
PX2 равн = 10–n·10 атм.,
где n – единицы или даже десятки;
например, PO2 равн над твердым оксидом цинка ZnO при температуре 377°С
составляет ~10–46 атм.
Насколько мало это давление, можно проиллюстрировать с помощью несложного расчета. При нормальных условиях (температура 0°С и давление 1 атм.)
1 моль идеального газа (6,02·1023 молекул) занимает объем 22,4 л, т. е. в 1 л
содержится 2,7·1022 молекул. При той же температуре и давлении 10–46 атм. объем,
занимаемый 1 молем, составляет 22,4/10–46 = = 2,24·1047 л, и число молекул в 1
литре равно 2,7·10–24. Это значит, что на 1 молекулу приходится объем 1/(2,7·10–24) ≈ 4·1023 л, или ~4·1011 км3.
Естественно, что при подобных давлениях никакой газовой прослойки на
границе Ме/МеХ нет, PXI2 – это чисто расчетная величина.
6.4. УРАВНЕНИЯ СКОРОСТИ ОБРАЗОВАНИЯ ТВЕРДОГО ПРОДУКТА
Перейдем от силы тока к скорости образования твердого продукта. Для этого в
левой части уравнения (86) с помощью соотношения (80) заменим силу тока числом
молей продукта, образующегося в единицу времени:
dm |
|
RT |
|
PII |
Ф PX2 |
dPX2 |
|
|
|||
|
|
X2 |
|
|
|||||||
= |
|
|
. |
(87) |
|||||||
|
2(z |
|
F) |
2 |
|
||||||
Sd |
X |
|
P |
I |
|
P |
|
||||
|
|
|
|
|
|
|
X2 |
|
|||
|
|
|
|
|
|
X2 |
|
|
|
|
|
В левой части уравнения (87) dm/(Sd ) – удельная скорость (поток) реакции,
т. е. число молей продукта, образующегося в единицу времени на единице площади
поверхности раздела фаз. Правая часть уравнения при постоянных значениях температуры и давления металлоида не зависит от времени и определяет скорость
образования продукта, поэтому она представляет собой константу скорости процесса. Обозначив ее К, получим:
|
|
|
RT |
|
PII |
Ф PX2 |
dPX2 |
|
|
|||
К |
|
X2 |
|
|
||||||||
|
|
, |
(88) |
|||||||||
|
2 |
|
||||||||||
|
|
|
2(z |
X |
F) |
|
P |
I |
|
P |
|
|
|
|
|
|
|
|
|
|
X2 |
|
|||
|
|
|
|
|
|
|
X2 |
|
|
|
|
|
|
dm |
= К. |
|
|
|
|
|
|
(89) |
|||
|
|
|
|
|
|
|
|
|||||
|
Sd |
|
|
|
|
|
|
|
|
|
||
Кроме dm/(Sd ), в левой части уравнения присутствует – толщина слоя продукта, пропорциональная количеству продукта. Очевидно, характеризовать
100
www.mitht.ru/e-library
