
Вольдман - фхтс часть 1 (2007)
.pdf6.6. АНАЛИЗ ОЖИДАЕМЫХ ЗАКОНОМЕРНОСТЕЙ ПРОЦЕССА С
ПОМОЩЬЮ ТЕОРИИ ВАГНЕРА
Анализ ожидаемых закономерностей охватывает три основные стороны
процесса:
1)направление роста слоя твердого продукта реакции;
2)характер влияния давления металлоида на скорость образования продукта;
3)характер влияния неизовалентных катионных примесей замещения на скорость процесса.
Для анализа необходима следующая информация об образующемся твердом
продукте:
- состав по отношению к стехиометрии (т. е. имеет ли образующаяся твердая
фаза стехиометрический состав либо обогащена металлом или металлоидом);
-тип разупорядоченности;
-преобладающая проводимость (электронная или ионная).
Рассмотрим анализ ожидаемых закономерностей на примере окисления Zn до
ZnO – эта реакция хорошо изучена, и предсказываемые закономерности можно сравнить с известными результатами экспериментов.
Характеристика образующегося продукта
Образующийся оксид цинка – фаза с избытком металла: даже при давлении кислорода 40 атм. максимальное содержание кислорода (граница области гомогенности со стороны кислорода) составляет 49,98% (атомн.).
Оксид цинка относится к типу разупорядоченности «Френкель».
Преобладающая проводимость оксида цинка – электронная.
Направление роста ZnO
Направление роста определяется тем, какой из ионов перемещается в
решетке продукта (см. рис. 2). Если перемещаются катионы, новые плоскости образуются на границе II, со стороны металлоида. Самая первая кристаллографическая плоскость продукта образуется на поверхности металла,
следующая – поверх нее и т. д., то есть каждая новая плоскость образуется поверх
предыдущей – слой растет наружу. Если же перемещаются анионы, то новые плоскости образуются на границе I, со стороны металла. После образования на
поверхности металла первой кристаллографической плоскости продукта следующая
плоскость образуется под ней и т. д., то есть каждая новая плоскость образуется под
111
www.mitht.ru/e-library
предыдущей – слой растет внутрь.
То, какой из ионов перемещается в слое продукта, определяется преобладающим точечным структурным дефектом, а то, какой точечный
структурный дефект преобладает – типом разупорядоченности кристалла и отклонением от стехиометрии (в сторону металла или металлоида).
Образующийся оксид цинка относится к типу разупорядоченности «Френкель»,
т. е. характерные для него точечные структурные дефекты – катионы в междоузлиях
и вакансии катионов. А поскольку образующаяся фаза содержит избыток цинка, из этих дефектов преобладают катионы в междоузлиях. Преобладающий точечный структурный дефект обеспечивает возможность направленного перемещения катионов, следовательно, слой будет расти наружу – новые плоскости будут
возникать поверх образовавшихся ранее. Следует отметить, что при типе
разупорядоченности «Френкель» то же самое было бы и при недостатке металла – в
этом случае преобладающим дефектом были бы вакансии катиона, а этот дефект
также обеспечивает возможность направленного перемещения катионов.
Экспериментально направление роста слоя ZnO определяли следующим образом. На поверхность металла перед началом окисления напыляли метку – тонкий слой SiO2, не препятствующий диффузии ионов и легко обнаруживаемый на поперечном срезе с помощью микроанализатора. После окисления метка была обнаружена под слоем ZnO на границе Zn/ZnO (метка «заросла»). Это соответствует образованию новых плоскостей поверх образовавшихся ранее, т. е. росту наружу, в
полном соответствии с тем, что ожидалось.
Влияние давления кислорода на скорость реакции (на величину
константы скорости)
При образовании продукта нестехиометрического состава с преобладающей электронной проводимостью константа скорости определяется выражением (98); с
учетом того, что перемещающийся ион – Zn2+ , металлоид – кислород и анионы – О2–
, т. е. i Zn2 и zХ = 2, получаем:
К= |
1 |
|
RT 2 |
a |
|
a |
|
|
1 |
|
RT |
2 |
a |
a |
|
|
|
|
|
|
||
|
|
Zn |
[PO |
|
|
PO |
(ZnO) |
]= |
|
|
Zn |
|
[PO |
|
PO |
(ZnO) |
]. |
(105) |
|
|
|
|
|
2(2F)2 |
|
|
8F2 |
|
|
|
|
|
|||||||||||||
|
a |
|
2 |
|
2 |
|
|
a |
|
|
2 |
2 |
|
|
|
|
|
|
||||
Найдем величину |
«a» |
– |
показателя степени |
в |
выражении |
|
a |
; |
||||||||||||||
Zn2 = Zn2 |
PO2 |
|||||||||||||||||||||
поскольку Zn2 ~(Zni2 ), «a» – это не что иное, как показатель степени в выражении
(Zni2 ) ~ POa2 .
112
www.mitht.ru/e-library
Избыток Zn в фазе ZnO возникает в результате протекания процесса
Zn2 2 |
|
O2 2 |
|
|
|
1 |
O20 ↑ + 2e– + Zni2 , |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
Zn |
|
|
O |
пов |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
0 |
1 |
O20 ↑ + 2e– + Zni2 , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
(Zn2 |
)(e–)2 = KФ(Zn) |
P |
1/ 2 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
i |
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Поскольку ZnO – фаза с избытком металла, |
P |
|
<P |
, (Zn2 |
)=(Zn2 )нс = (e–)/2, |
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
2 |
O |
|
i |
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
(e–)3/2 = KФ(Zn) P 1/ 2 |
и (Zn2 |
)~(e–)~P |
1/ 6 , т. е. a = -1/6. |
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
O2 |
|
|
|
i |
|
|
O2 |
|
|
|
|
|
|
|
|
|
||||
Теперь оценим величину РО2 (ZnO): |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
~ |
|
|
|
|
|
|
|
|
|
||||
РО2 (ZnO) = 1/KZnO |
= ехр[2 GZnO /(RT)]. |
|
|
|
|
|
|
|
||||||||||||||||||
Зададим температуру процесса 650 К (т. е. 377°С, что на 42° ниже |
||||||||||||||||||||||||||
температуры плавления цинка, равной 419°С). |
|
|
|
|
|
|
|
|||||||||||||||||||
Из справочных данных |
~ |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
GZnO(650K) = -285 кДж/г-ат О; получаем: |
||||||||||||||||||||||||||
Р |
|
|
|
|
|
≈ 1·10-46 атм. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
О2 (ZnO) 650К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Интегрируем выражение (105) при a = -1/6: |
|
|
|
|
|
|
|
|||||||||||||||||||
К= 6 |
RT Zn2 |
|
[PO1/6 |
PO1/(ZnO)6 |
]= |
3RT Zn2 |
|
[P 1/6 |
P 1/6 ]; |
|
|
|
||||||||||||||
8F2 |
|
|
4F2 |
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
O2 (ZnO) |
|
O2 |
|
|
|
|
|
|||
P 1/ 6 |
|
= (1·10-46)-1/6 = 4,64·107; |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
O2(ZnO) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
при 10-6 ≤ Р |
|
, атм. ≤ 106 |
10 |
≥ P 1/ 6 |
≥ 0,1, т. е. P 1/ 6 |
|
>>P 1/ 6 ; очевидно, это |
|||||||||||||||||||
|
|
|
|
|
О2 |
|
|
|
|
|
|
|
|
|
|
O2 |
|
|
|
|
|
O2(ZnO) |
O2 |
|||
соотношение останется справедливым и при других температурах. |
|
|||||||||||||||||||||||||
Следовательно, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
К = |
3RT Zn2 |
P 1/6 |
|
|
= const(Р |
), |
|
|
|
|
|
(106) |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
4F2 |
O2 (ZnO) |
|
|
|
|
О2 |
|
|
|
|
|
|
|
|
|
|||||||
т. е. константа скорости процесса не должна зависеть от давления кислорода
(нулевой порядок по кислороду).
Сопоставим этот вывод с экспериментальными данными: было установлено,
что значение произведения 2КМ в уравнении (92), выраженное в г2см-4час-1, при
390°С равно 0,72·10-10 при давлении кислорода 1 атм. и 0,75·10-10 – при давлении кислорода 0,022 атм. Таким образом, скорость окисления действительно практически не зависит от давления кислорода (полученное различие находится в пределах погрешности эксперимента).
Задав температуру процесса, рассчитав для этой температуры РО2(ZnO),
113
www.mitht.ru/e-library
экспериментально определив 2 и подставив полученные значения, а также R и F
Zn
в формулу (106), получим численное значение константы скорости – и после этого сможем, не выполняя эксперимента, с помощью формул (91), (93) или (95) найти
количество оксида цинка, которое должно образоваться при любой заданной продолжительности окисления.
Влияние примесей на скорость реакции
(на величину константы скорости)
Поскольку лимитирующей стадией при окислении цинка является переход катионов Zn2+ от границы Zn/ZnО к границе ZnО/О2, а скорость направленного движения катионов пропорциональна концентрации Zni2 , влияние примесей
обусловлено изменением в их присутствии концентрации этого дефекта.
В соответствии с уравнением (69), в присутствии примесных катионов замещения с зарядом, превышающим заряд катиона цинка (например, катионов
’Ме3+), должна увеличиваться концентрация вакансий катионов:
0 = 2'Me3Zn2 + VZn2 ,
а поскольку (VZn2 )(Zni2 ) = KФ и (Zni2 ) = KФ/(VZn2 ), это должно привести к уменьшению концентрации Zni2 и понижению скорости окисления.
Присутствие примесных катионов замещения с зарядом меньшим, чем заряд
катиона цинка (катионов ’Ме +), напротив, должно привести к увеличению
концентрации Zni2 [см. уравнение (76)]:
0= 2'MeZn2 + Zni2 ,
врезультате скорость окисления должна увеличиться.
Следует отметить, что изменение концентрации Zni2 по сравнению с чистым
кристаллом и соответственно изменение скорости окисления можно оценить количественно для любого заданного содержания донорной или акцепторной примеси с помощью методики, использовавшейся при построении диаграмм рис. 18 – 20.
Экспериментальное исследование влияния примесей на скорость окисления цинка дало следующие результаты: при окислении чистого цинка значение произведения 2КМ в уравнении (92) оказалось равным 8·10-10 г2см-4час-1; при
окислении сплава цинка с алюминием, содержавшего 1% (атомн.) последнего,
величина этого произведения по расчету должна была составить 0,4·10-11, а
114
www.mitht.ru/e-library
экспериментально получено 2КМ < 1·10-11 г2см-4час-1; при окислении сплава цинка,
содержащего 0,4% (атомн.) лития, расчетное и найденное экспериментально
значения 2КМ , г2см-4час-1, составили соответственно 1·10-7 и
2·10-7. Эти данные, во-первых, подтверждают ожидаемый характер влияния
неизовалентных катионных примесей замещения на скорость окисления цинка, а во-
вторых, показывают, что результаты расчетов хорошо согласуются с экспериментальными данными.
Таким образом, правильность анализа ожидаемых закономерностей
окисления Zn до ZnO, выполненного с использованием теории Вагнера, полностью подтверждена результатами экспериментальных исследований.
6.7. ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ РЕАКЦИЙ С УЧАСТИЕМ МЕТАЛЛА, ИМЕЮЩЕГО НЕСКОЛЬКО УСТОЙЧИВЫХ СТЕПЕНЕЙ ОКИСЛЕНИЯ
6.7.1. Характер образующейся оболочки
Многие переходные металлы имеют несколько устойчивых степеней окисления и способны образовывать соединения с различным соотношением металл : металлоид. На диаграммах плавкости соответствующих систем присутствует несколько твердых фаз, например, в системе железо – кислород фазы
FeO, Fe3O4, Fe2O3, в системе ниобий – кислород фазы NbO, NbO2, Nb2O5 и т. д.
Рассмотрим закономерности взаимодействия подобных металлов с металлоидом на примере условной системы, в которой имеются фазы β, и ,
отвечающие степеням окисления металла +1, +2 и +4 при степени окисления
металлоида -2 (рис. 27).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
β + |
|
|
|
+ |
|
|
|
|
Me+β |
|
β |
|
|
|
|
|
+X2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
00 |
|
|
% (атомн.) Х |
|
100 |
Me |
Me2Х |
|
MeХ2 |
X |
||
MeХ |
||||||
Рис. 27. Фазы условной системы Ме – Х при температуре ниже
температуры солидуса
115
www.mitht.ru/e-library
Анализ диаграммы, показанной на рис. 27, показывает, что при взаимодействии металла с металлоидом в подобных системах не может образовываться только одна из фаз. В самом деле: в равновесии с металлом может
находиться только фаза β, в равновесии с газообразным металлоидом – только
фаза , а фазы β и могут находиться в равновесии с фазой , но не друг с другом.
Следовательно, при взаимодействии Ме с Х2 должна образовываться многослойная оболочка твердых продуктов, причем слоев должно быть столько же, сколько
имеется устойчивых фаз в условиях взаимодействия. Это соответствует сформулированному академиком А.А.Байковым положению о том, что процессы протекают через все устойчивые в данных условиях промежуточные продукты.
По мере взаимодействия Ме с Х2 при постоянном восполнении расхода металлоида (т. е. при поддержании постоянного давления последнего) содержание
Х в системе непрерывно возрастает и соответственно меняется фазовый состав.
Вначале уменьшается количество свободного Ме0 и растет количество продуктов
реакции; после исчезновения свободного Ме0 начинает уменьшаться количество низшего соединения – фазы β; затем, после исчезновения этой фазы, количество фазы растет за счет фазы , и в конце концов в системе остается один твердый продукт – фаза , способная сосуществовать с Х2.
6.7.2. Закономерности образования многослойной
оболочки
Рассмотрим закономерности образования многослойной оболочки в системе,
показанной на рис. 27.
Процессы, протекающие на границах (рис. 28): I: Ме0 → Ме+ + е– или Ме0 + е+ → Ме+;
II: Ме+ → Ме2+ + е– или Ме+ + е+ → Ме2+;
III: Ме2+ → Ме4+ + 2е– или Ме2+ + 2е+ → Ме4+;
IV: 1/2 Х20 + 2е– → Х2– или 1/2 Х20 → Х2–+ 2е+.
В каждом слое от границы к границе передаются электроны или дырки и
катионы или анионы, т. е. протекают те же процессы, что при реакции с
образованием единственного продукта. Соответственно зависимость толщины
каждого слоя от продолжительности процесса так же, как при росте единственного слоя, должна описываться уравнением (95):
116
www.mitht.ru/e-library
1 =
 K1 , 2 =
K1 , 2 =
 K2 , 3 =
K2 , 3 =
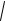 K3 ,
K3 ,
где Ki – приведенная константа скорости роста толщины i-того слоя, равная
произведению 2KiV0i для соответствующего слоя.
|
I |
II |
III |
IV |
|||
|
e– |
|
e– |
|
e– |
|
|
|
e+ |
|
e+ |
|
e+ |
|
|
Me0 |
Me2X |
|
MeX |
|
MeX2 |
|
Х2 (газ) |
|
Me+ |
|
Me2+ |
|
Me4+ |
|
|
|
X2– |
|
X2– |
|
X2– |
|
|
|
1 |
2 |
3 |
|
|
||
Рис. 28. Процессы, протекающие при образовании многослойной оболочки
И точно так же константы скорости образования каждого слоя должны описываться выражениями, аналогичными уравнению (96) для единственного слоя
(принято, что все слои имеют преобладающую электронную проводимость):
|
|
RT |
|
PII |
|
|
||
К1 |
|
|
X2 |
|
|
|||
= |
|
|
i(1) |
|
PXa21 1dPX2 |
, |
||
2(z |
|
2 |
||||||
|
|
X |
F) |
|
I |
|
|
|
|
|
|
|
|
PX2 |
|
|
|
|
|
|
|
|
|
PIII |
|
|
|
|
|
|
|
X2 |
|
|
|
К2 |
= |
RT i(2) |
|
PXa22 1dPX2 |
, |
|||
2 |
|
|||||||
|
|
2(z |
X |
F) |
|
II |
|
|
|
|
|
|
|
PX2 |
|
|
|
|
|
RT |
|
PIV |
|
|
||
К3 |
|
|
X2 |
|
|
|||
= |
|
|
i(3) |
|
PXa23 1dPX2 . |
|||
2(z |
|
2 |
|
|||||
|
|
X |
F) |
|
III |
|
|
|
|
|
|
|
|
PX2 |
|
|
|
В этих выражениях: |
|
|||||||
PI |
– равновесное давление реакции 2Ме0 + 1/2 Х20 Ме2Х, |
|||||||
X2 |
|
|
|
|
|
|
|
|
PII |
– равновесное давление реакции Ме2Х + 1/2 Х20 2МеХ, |
|||||||
X2 |
|
|
|
|
|
|
|
|
PIII |
– равновесное давление реакции МеХ + 1/2 Х20 МеХ2, |
|||||||
X2 |
|
|
|
|
|
|
|
|
PVI |
– внешнее давление металлоида, P . |
|||||||
X2 |
|
|
|
|
|
|
|
X2 |
Давления PI – |
PIII |
при каждой температуре имеют строго определенные |
||||||
|
|
|
|
|
|
X2 |
X2 |
|
значения, изменять можно только внешнее давление. Поэтому внешнее давление металлоида может влиять только на скорость образования слоя, граничащего с
117
www.mitht.ru/e-library

газообразным металлоидом (в нашем случае это фаза на основе МеХ2), причем
только в том случае, если не образуется продукт с избытком металла, в противном
случае a < 0, и процесс имеет нулевой порядок по металлоиду. У всех остальных слоев давления металлоида и на внутренних, и на внешних границах фиксированные, и значения констант скорости зависят только от температуры.
6.7.3. Соотношения между толщиной слоев
Из формулы i =
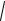 Ki следует:
Ki следует:
1 : 2 : 3 : … = 
 K1 :
K1 :
 K2 :
K2 :
 K3 : …
K3 : …
Константы скорости, как правило, различаются на несколько порядков,
поэтому толщина слоев различается также на порядки. В результате толщина одного из слоев в десятки, сотни и более раз больше, чем других, и на поперечном срезе, если не используется прецизионная аппаратура, удается обнаружить только один этот слой. Отсюда проистекают встречающиеся в литературе вплоть до последнего времени ошибочные утверждения, подобные утверждению о том, что при окислении меди кислородом высший оксид CuO не образуется до тех пор, пока вся медь не перейдет в Cu2O. На самом деле Cu2O не может сосуществовать с
кислородом, просто до исчезновения металла толщина слоя Cu2O в ~100 раз
больше, чем толщина слоя CuO.
118
www.mitht.ru/e-library
