
- •5. Клітини, органи та тканини імунної системи
- •5.1. Лімфоїдно-макрофагальна система організму
- •5.2. Cтовбурні ембріональні клітини
- •Уніпотентні ск, спеціалізовані для утворення певних органів
- •Імуноглобуліни
- •5.3. Характеристика клітин імунної системи
- •5.3.1. А-клітини
- •5.3.2. Гранулоцити
- •5.3.3. Лімфоцити. Лімфопоез та імуногенез лімфоїдних клітин
- •Лімфопоез
- •5.3.4. В-лімфоцити
- •Ig lg β lg β lg α lg α
- •5.3.5. Т-лімфоцити
- •5.3.6. Нульові клітини
- •Ембріональна печінка
- •5.4.2. Кістковий мозок
- •5.4.3. Тимус
- •5.4.4. Сумка Фабриціуса
- •5.5.1. Лімфатичні вузли
- •5.5.2. Селезінка
- •5.5.3. Пейєрові бляшки кишечника
- •5.5.4. Аденоїди, тонзили, апендикс
- •5.5.5. Імунні підсистеми слизових оболонок
- •Питання для контролю засвоєння матеріалу
- •Відповіді на тести
5.3.5. Т-лімфоцити
Т-лімфоцити – найбільш різнорідна група імуноцитів, як за структурою поверхневих антигенів, так і за функціями. Вони не тільки беруть участь у розпізнаванні антигенів за допомогою особливих TКР-рецепторів, але й регулюють певні механізми імунітету. Диференціація Т-клітин з перетворенням їх у дозрілі Т-лімфоцити відбувається поступово в декілька стадій. У результаті на поверхні клітин послідовно з’являються різноманітні рецептори, в тому числі головний антигенрозпізнавальний рецептор TКР, рецептори для сприйняття хімічних сигналів (цитокінів) від інших клітин, здійснюється синтез власних цитокінів, а також експресується велика кількість допоміжних молекул, що беруть участь у розпізнаванні і знищенні антигенів.
Основними рецепторами Т-лімфоцитів, які беруть участь у розпізнаванні антигенів є ТКР – Т-клітинні рецептори (або TCR – від англ. Т-cell receptor). За допомогою моноклональних антитіл було встановлено, що на одному Т-лімфоциті може бути експресовано близько 30 тис. ТКР. Схематично структуру ТКР подано на рис. 5.6.
ТКР – це складний комплекс білків, який складається з 8 трансмембранних поліпептидів, які фіксуються у мембрані Т-лімфоцитів і мають цитоплазматичні ділянки для проведення сигналу всередину клітини.
ζ
S S
ζ
Рис. 5.6. Будова рецептора Т-лімфоцитів для антигену (TКРαβ)
Пояснення: рецептор складається з 8 поліпептидних ланцюгів. Антигензв’язуюча ділянка рецептора формується ланцюгами α і β; ланцюги δ, γ і ε (разом їх називають комплексом СD3) необхідні для експресії ланцюгів α і β, їх стабілізації і, напевно, проведення сигналу всередину клітини; ζ-ланцюги найбільш ”внутрішньоклітинні”, вони забезпечують проведення сигналу всередину клітини.
Основною антигенрозпізнавальною ділянкою ТКР є димер з двох поліпептидів – α та β. Вони належать до родини імуноглобулінів і контролюються комплексом генних сегментів V, D, J і C, але гени, що їх кодують, утворюють окрему групу. Димер з α та β-ланцюгів є аналогом Fab-фрагмента імуноглобуліну. Кожен з ланцюгів має один варіабельний (V) та один константний (C) домени. Варіабельні домени мають не меньш 7 гіперваріабельних ділянок (у антитіл – 3-4). Між гіперваріабельними ділянками α- та β-ланцюгів ТКР формується «щілина» активного центру, в яку може входити епітоп антигену, наприклад, антигенний пептид з 8-9 залишків амінокислот. Причому активний центр одного ТКР може перехресно взаємодіяти з різними антигенами, подібними за просторовою структурою.
Між α- та β-ланцюгами в мембрану вмонтовані два додаткові поліпептиди – ζ, які з’єднані між собою дисульфідним зв’язком. Вони “допомагають” α- та β-поліпептидам проводити сигнал про контакт з антигеном всередину клітини.
Для формування і функціонування ТКР важливу роль відіграють СD3-рецептори (СD3-комплекс), що є у всіх Т-лімфоцитів. СD3-комплекс складається з чотирьох поліпептидів – γ, δ та двох ε, які двома парами (δε і εγ) оточують α- і β-ланцюги і ніби підтримують їх у мембрані. Поліпептиди γ, δ і ε необхідні для експресії і просторової укладки α- та β-ланцюгів. Мутантні клітини з дефектним СD3-комплексом не здатні сформувати на своїй поверхні антигенрозпізнавальну ділянку. Цитоплазматичні фрагменти поліпептидів γ, δ і ε, як і ζ-ланцюги, містять амінокислотні послідовності ІТАМ (immunoreceptor tyrosine-based activation motifs). ІТАМ зв’язуються з тирозинкіназами цитозолю, які проводять сигнал у клітину.
Диференціація Т-лімфоцитів супроводжується соматичною рекомбінацією - перебудовами ДНК, що забезпечують утворення великої безлічі Т-клітин з різними антигензв’язуючими центрами. Згідно з теоретичними розрахунками кількість варіантів Т-лімфоцитів з унікальними ТКР може досягати 1016 – 1018.
На відміну від Ig-рецепторів В-лімфоцитів та макрофагів, ТКР Т-лімфоцитів розпізнають антигени тільки в комплексі з МНС на поверхні антигенпрезентуючих чи інфікованих клітин, причому на різних клітинах антиген може бути експресований сумісно з молекулами МНС першого чи другого класів (МНС-І чи МНС-ІІ).
2
1
5
7а
7б
3
МНС-II
+ епітоп
TCR

















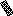






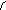




















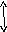



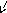






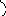
4


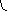

Рис. 5.7. Взаємодія ТКР з комплексом МНС+епітоп на антигенпрезентуючій клітині (Р. М. Хаїтов, Г. О. Ігнатьєва, І. Г. Сидорович, 2000)
1- антигенпрезентуюча клітина (наприклад, дендритна або макрофаг); 2 – Т-лімфоцит СD4; 3 – молекули МНС-ІІ; 4 – епітоп (антигенна детермінанта антигену); 5 – α- та β-ланцюги ТКР; 6 – молекула СD4 ; 7а – δ і ε-ланцюги ТКР; 7б – γ і ε-ланцюги ТКР
На мембранах антигенпрезентуючих клітин – макрофагів, дендритних клітин, В-лімфоцитів – епітопи антигенів виведені на поверхню у комплексі з МНС-ІІ, на інших клітинах організму (пухлинних, інфікованих внутрішньоклітинними паразитами, клітинах трансплантанту, власних клітинах зі зміненими антигенами) утворюються комплекси антигенів з МНС-І.
Т-лімфоцит своїм ТКР вступає у контакт з клітиною, яка несе антиген, причому одна ділянка ТКР зв’язується з МНС клітини, а інша – безпосередньо з епітопом антигену. Цей феномен отримав назву подвійного розпізнавання антигенів.
Диференціація у розпізнаванні антигенів, асоційованих з МНС-І чи з МНС-ІІ, здійснюється завдяки додатковим корецепторним молекулам Т-лімфоцитів. Якщо ТКР асоційований з корецептором СD4 (у Т-хелперів), то чужерідний антиген розпізнається в комплексі з МНС-II. Якщо ж ТКР асоційований з корецептором СD8 (у Т-кілерів), то розпізнаються антигени в комплексі з МНС I. Явище подвійного розпізнавання антигенів в комплексі з МНС було відкрите Р. Цинкернагелем і П. Дохерті більше 20 років тому, у 1996 р. за це відкриття вчені були нагороджені Нобелівською премією.
Як вже відзначалося раніше, у дозріванні Т-лімфоцитів, як і В-лімфоцитів, можна виділити два основних етапи – лімфопоез (антигеннезалежна диференціація) та імуногенез (антигензалежна диференціація). Лімфопоез починається у кістковому мозку з диференціального ділення стовбурної лімфоцитарної клітини на дві самостійні гілки, які дають початок Т- і В-клітинам. У ранніх Т-клітин-попередниць на мембрані з’являється специфічний глікопротеїн (ГП-33), який пізніше асоціюється з β-ланцюгом ТКР. На наступній стадії лімфопоезу остаточно формується сам антигенрозпізнавальний рецептор – ТКР. Т-клітини з ТКР мігрують у тимус (центральний орган), де перетворюються на тимоцити. Диференціація у тимусі відбувається поступово у міру того, як Т-клітини просочуюються з періферійної кори органа у більш глибоко розташовані шари, зокрема у мозкову речовину. Під впливом стромальних клітин мікрооточення і тимічних гормонів відбувається «виучування» Т-клітин - комітування (від англ. commit – ввіряти, доручати) з формуванням окремих ліній клітин. У тимусі відбувається делеція клонів аутореактивних Т-лімфоцитів, здатних відповідати на власні антигени (аутоантигени). Щодо формування окремих субпопуляцій Т-лімфоцитів, то спочатку з’являються тимоцити CD4+CD8+, які мають обидва диференціювальні рецептори – CD4+ і CD8+. Пізніше виникають Т-хелпери (CD4+CD8-, або CD4+-клітини), Т-кілери і Т-супресори. Останні дві субпопуляції мають за даними рецепторами однаковий фенотип – CD4-CD8+. Їх ще називають CD8+-клітинами. Так завершується етап антигеннезалежної диференціації Т-лімфоцитів, після чого вони розселяються у Т-залежних зонах периферичних органів.
Дихотомія (розгалуження) Т-хелперів з утворенням двох гілок – Тh1 i Th2 – відбувається шляхом подальшої диференціації CD4+-клітин у периферичних органах імунної системи в процесі розвитку імунної відповіді. Залежно від природи антигену, його дози, шляхів та кратності потрапляння в організм, супутніх факторів відбувається імунне відхилення у бік утворення тієї чи іншої субпопуляції – Тh1 чи Th2. Хелпери першого і другого типів є регуляторними клітинами і розрізняються спектром синтезованих цитокінів. Залежно від цього розвивається переважно клітинна (під впливом Th1) або гуморальна імунна відповідь (за допомогою Th2). У вторинних (периферичних) лімфоїдних органах здійснюється селекція специфічних до антигену Т-лімфоцитів, що належать до різних субпопуляцій. Активовані таким чином окремі Т-лімфоцити розпочинають активно ділитися і після декількох мітозів дають клони спеціалізованих для даного антигена клітин – Т-хелперів, Т-супресорів, Т-кілерів та ін..
Вміст Т-лімфоцитів серед інших клітин лімфоїдних тканин (у мишей) встановлює: у тимусі – близько 100%, грудній протоці – 80%, лімфатичних вузлах – 70%, периферічній крові – 65%, селезінці – 35%, пейєрових бляшках кишечника – 30%, у кістковому мозку – відсутні.
На сьогодні відомо вже близько 10 субпопуляцій Т-лімфоцитів:
Індуктори Т-хелперів мають специфічний рецептор СD29 і виконують регуляторну функцію, індукуючи утворення Т-хелперів. Цей тип Т-лімфоцитів запускає експресію антигенів МНС ІІ на макрофагах та інших клітинах А-ряду, без чого неможливе розпізнавання Т-хелперами антигенів.
Т-хелпери 0 (Th0) – маловивчена група Т-лімфоцитів. Вважають, що це – попередники Т-хелперів, в яких експресовані ще не всі рецептори. Але в результаті дозрівання і диференціації вони дають дві гілки нащадків Th1 і Th2. Це явище отримало назву дихотомії Т-хелперів.
Т-хелпери І (Th1) мають рецептори СD4, СD44, СD45. Вони впізнають антигени, асоційовані на поверхні різних клітин з антигенами МНС І і сприяють розвитку імунної відповіді за клітинним типом. Th1 забезпечують проліферацію і диференціацію Т-кілерів, які знищують клітини трансплантату, пухлин, а також клітини, інфіковані будь-якими внутришньоклітинними паразитами (вірусами, хламідіями, рикетсіями, мікобактеріями, найпростішими тощо). Th1 здатні активувати Th2, стимулюють вироблення IgA2, сприяють прояву цитотоксичної функції макрофагів, беруть участь у реакціях гіперчутливості повільного типу (РГПТ). Th1 секретують інтерлейкіни (IL-2, IL-3), фактори некрозу пухлин (TNFα, TNFβ), інтерферон–γ (IFγ), фактор, що стимулює ріст гранулоцитів і макрофагів (GM-CSF) та інші цитокіни (медіатори імунної відповіді). Th1 стійкі до радіоактивного випромінення.
Т-хелпери 2 (Th2) мають рецептори СD4 і СD28. Ці клітини відіграють важливу роль у розвитку гуморальної імунної відповіді у відношенні Т-залежних антигенів. На відміну від Т-хелперів першого типу Th2 розпізнають антигени на поверхні антигенпрезентуючих клітин (макрофагів, дендритних клітин) у комплексі з молекулами МНС-ІІ. Основна функція Th2 – стимуліція проліферації та активації В-клітин з подальшим перетворенням останніх в антитілоутворюючі плазмоцити. Тобто синтез антитіл проти Т-залежних антигенів відбувається при безпосередній участі Th2. При цьому Th2 гальмують функцію Th1, що може призводити до перемикання клітинної відповіді на гуморальну.
Th2 діють на В-лімфоцити двома шляхами: завдяки міжклітинним контактам та опосередковано, виробляючи хімічні сигнали – цитокіни. Т-хелпери 2 секретують велику кількість цитокінів: інтерлейкіни IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, а також GM-CSF. IL-4 і IL-5 є факторами росту і диференціації В-лімфоцитів і стимулюють переважно гіморальну імунну відповідь. IL-5 сприяє утворенню IgA, IL-4 значно посилює синтез IgE – 100-1000 разів. На противагу Т-хелперам першого типу Th2 чутливі до радіоактивного випромінення.
Т-хелпери 3 (Th3) – це так звані “наївні” Т-лімфоцити, які розпізнають чужерідні антигени в комплексі з антигенами МНС, після чого стають регуляторними лімфоцитами. У лімфовузлах вони розмножуються і диференціюються, а далі мігрують у вогнище запалення, де зустрічаються з Th1 и Th2. Це стимулює звільнення TGF (трансформуючого фактора росту), який виявляє протизапальну дію. Таким чином, залучення Тh3 до імунної відповіді знижує інтенсивність супутніх запальних реакцій.
Індуктори Т-супресорів мають специфічні рецептори СD45, стимулюють диференціювання попередників Т-супресорів, посилюють секрецію IL-1 макрофагами.
Т-супресори (Тs) експресують на поверхню мембрани рецептори СD11, СD8, Lyt1. Це – гетерогенна популяція клітин, які виявляють пригнічуючу дію у відношенні до різних імуноцитів: В-лімфоцитів, Т-хелперів, ефекторних Т- і В-клітин тощо. Взаємодіючи з Т-хелперами, Тs пригнічують синтез рецепторів к IL-1 і IL-2 і тим самим уповільнюють проліферацію і диференціровку ефекторних Т-лімфоцитів та антитілоутворюючих клітин проти даного антигену. В ембріональному та постнатальному періодах Тs відповідальні за виникнення імунологічної толерантності до власних білків. Функції Т-супресорів блокуються через тиждень після народження особливою популяцією Т-контрсупресорів.
Т-супресори мають важливе значення не тільки при формуванні імунологічної толерантності, але й при нормальній імунній відповіді. В організмі одночасно виявляються Т-хелпери, Т-ефектори і Т-супресори, взаємодія яких чітко збалансована. Порушення функції Т-супресорів може призводити до продукції необмеженої кількості антитіл, зокрема у відношенні власних антигенів, внаслідок чого розвиваються аутоімунні хвороби. Так, при системній червоній вовчанці виявляється суттєве зниження кількості Тs, які в нормі повинні пригнічувати утворення антитіл проти нуклеопротеїдів – комплексів ДНК і РНК з ядерними та цитоплазматичними білками, внаслідок чого виникає аутоагресія проти всіх ядровмісних клітин.
В останні роки деякі вчені висловлюють припущення, що окремої субпопуляції Т-супресорів не існує, а пригнічення імунної відповіді здійснюють інші клітини через продукування спеціальних гуморальних факторів. Є докази, що в деяких випадках супресорну функцію виконують Т-ефектори, які мають той же клітинний маркер CD8, що і Т-супресори. Пригнічення окремих ланок імунітету можуть викликати Th1 i Th2, продукуючи певні цитокіни. Так, якщо Th2 виробляють гама-інтерферон, то гальмується гуморальна відповідь (синтез антитіл), а синтез IL-10 пригнічує клітинну імунну відповідь. Дуже цінним показником нормального функціонування імунної системи є так званий імунорегуляторний індекс, який відображає кількісне співвідношення хелперів і супресорів. У здорової людини цей індекс – CD4/CD8 – дорівнює 2 і більше, у хворих на СНІД внаслідок інфікування і руйнування Т-хелперів вірусом їх кількість знижується, а кількість Т-супресорів може навіть збільшуватись, внаслідок чого CD4/CD8 падає до 0,5 і нижче. Це призводить до “паралічу” імунної системи і розвитку пухлин і цілої низки опортуністичних хвороб.
Т-контрсупресори не мають СD4, СD8, але мають унікальний рецептор до лектину Vicia villosa, пригнічують функції Т-супресорів, продукують особливий лімфокін, який у сполуці з Т-хелперами робить їх стійкими до дії Т-супресорів.
Т-кілери (Тk) належать до Т-ефекторних клітин. Це цитотоксичні лімфоцити (ЦТЛ) із специфічним рецептором СD8, які розпізнають чужерідні антигени, експресовані на поверхні власних клітин організму в комплексі з МНС-І. Попередники Т-кілерів, активовані антигеном і інтерлейкіном-2, що виробляється Th-1, перетворюються у дозрілі кілери. Вони здатні викликати цитоліз (кілинг) клітин-мішеней – клітин трансплантата, пухлин, клітин, інфікованих внутришньоклітинними паразитами (вірусами, хламідіями, рикетсіями, найпростішими тощо). Т-кілери з’являються через декілька днів від моменту первинного розпізнавання антигену. На відміну NK (природних кілерів), які з’являються раніше, дія Т-кілерів специфічна.
Т-клітини пам’яті – це особлива популяція довгоживучих CD4-клітин, які мають додаткові маркери CD2, CD3, CD29. Вони обумовлюють швидке включення клітинної відповіді при повторній появі антигену в організмі. Ці клітини існують у 2 формах: одна з них з маркером CD45PA активується антигеном і проліферує з утворенням необхідних для вторинної імунної відповіді ефекторних клітин, друга – CD45PO – виникає з першої і створює короткочасну фазу гіперактивності.
