
общая и неорганическая химия
.pdf81
– Na – K – Rb – Cs – Fr. Аналогичное увеличение химической активности s- металлов II группы наблюдается в ряду Be – Mg – Ca – – Sr –Ba – Ra.
Атомы s-металлов II группы имеют на внешнем уровне два электрона и сравнительно легко их теряют, превращаясь в двухзарядные катионы, поэтому в отношении химической активности эти элементы лишь немного уступают щелоч- ным металлам.
Общим способом получения щелочных, щелочноземельных металлов, маг- ния и бериллия является электролиз расплавов их солей (обычно хлоридов).
Щелочные металлы характеризуются незначительной твёрдостью, малой плотностью и низкими температурами плавления. S-металлы второй группы име- ют большую, чем щелочные металлы, твёрдость и довольно высокие температуры плавления.
Все щелочные металлы энергично соединяются с кислородом; рубидий и цезий самовоспламеняются на воздухе, калий, натрий и литий загораются при не- большом нагревании. При этом только литий образует оксид:
4 Li + O2 → 2 Li2O .
Натрий, взаимодействуя с кислородом, образует преимущественно пероксид, а ка- лий, рубидий и цезий надпероксиды:
2 Na + O2 → Na2O2 ; K + O2 → KO2 .
Восстановлением пероксидов и надпероксидов избытком щелочного метал-
ла можно получить оксид: |
Na2O2 + 2 Na → 2 Na2O . |
При сжигании щелочноземельных металлов, магния и бериллия образуются |
|
оксиды: |
2 Ca + O2 → 2 CaO; |
|
2 Mg + O2 → 2 MgO. |
Оксиды щелочных и щелочноземельных металлов взаимодействуют с водой с об- разованием гидроксидов: Na2O + H2O → 2 NaOH .
Пероксиды и надпероксиды полностью гидролизуются водой с образовани-
ем щёлочи: Na2O2 + 2 HOH → 2 NaOH + H2O2 ;
2 KO2 + 2 HOH → 2 KOH + O2− + H2O2 .
Пероксиды щелочных и щелочноземельных металлов способны взаимодей- ствовать с углекислым газом с выделением кислорода, что позволяет использовать их в системах регенерации воздуха в помещениях с замкнутым объёмом (напри- мер, на подводных лодках, в космических кораблях):
2 BaO2 + 2 CO2 → 2 BaCO3 + O2 .
Щелочные и щелочноземельные металлы также реагируют с другими неме- таллами: галогенами, серой, азотом, водородом. При этом образуются соответст- венно галогениды, сульфиды, нитриды и гидриды.
Щелочноземельные металлы уже при комнатной температуре медленно взаимодействуют с азотом, образуя нитриды. Из щелочных металлов при комнат- ной температуре нитрид образует литий; нитриды остальных щелочных металлов образуются при нагревании. Водой нитриды полностью гидролизуются с образо-
82
ванием аммиака и соответствующего основания (см. также раздел 5.2.2 «Аммиак и соли аммония. Гидразин. Гидроксиламин» лекции 5).
Легко отдавая в химических реакциях валентные электроны, щелочные ме- таллы являются самыми энергичными восстановителями. Их восстановительная способность настолько велика, что они могут восстанавливать даже атомы водо- рода, превращая их в отрицательно заряженные ионы H– и образуя при нагрева- нии с водородом гидриды: 2 Na + H2 → 2 NaH .
Аналогичным образом можно получить и гидриды щелочноземельных ме- таллов. Гидриды магния и бериллия непосредственно из простых веществ не об- разуются, но их можно получить косвенным путём.
Гидриды полностью разлагаются водой с образованием водорода и гидрок-
сида металла: CaH2 + 2 HOH → Ca(OH)2 + 2 H2− .
В ряду напряжений щелочные, щелочноземельные металлы, магний и бе-
риллий стоят далеко впереди водорода и способны восстанавливать водород из
воды: 2 Na + 2 HOH → 2 NaOH + H2− ; Ca + 2 HOH → Ca(OH)2 + H2− .
Взаимодействие бериллия и магния с водой протекает очень медленно вследствие малой растворимости образующихся гидроксидов магния и бериллия.
Be(OH)2 – единственный в подгруппе амфотерный гидроксид. По своим хи- мическим свойствам бериллий в значительной степени сходен с алюминием. Это сходство, носящее название «диагонального», наблюдается не только у бериллия и алюминия, но и у некоторых других элементов. Например, бор по многим хими- ческим свойствам сходен с кремнием, а литий с магнием.
Нерастворимый в воде гидроксид бериллия легко растворяется в растворах щелочей с образованием гидроксокомплексов, а при сплавлении образует безвод-
ные бериллаты: Be(OH)2 + 2 NaOH → Na2[Be(OH)4] ; Be(OH)2 + 2 NaOH → Na2BeO2 + 2 H2O .
Бериллий способен образовывать и другие комплексные соединения, в ко- торых он имеет координационное число равное 4. Так, при взаимодействии фто- рида бериллия с фторидами щелочных металлов образуются комплексные фторо-
бериллаты: BeF2 + 2 KF → K2[BeF4] .
В водных растворах ион бериллия, по-видимому, находится в виде аквакомплек-
сов [Be(H2O)4]2+ .
Природная вода, которая содержит в растворённом состоянии большое ко- личество солей кальция и магния, называется жёсткой водой в противополож- ность мягкой воде, содержащей мало солей кальция и магния или совсем не со- держащей их. Суммарное содержание ионов Ca2+ и Mg2+ в воде называется общей жёсткостью. Она подразделяется на карбонатную и некарбонатную жёст-
кость. Карбонатная жёсткость обусловлена присутствием в воде гидрокарбонатов кальция и магния, некарбонатная жёсткость – присутствием солей сильных ки- слот: MgCl2, CaCl2, MgSO4 и др. При кипячении воды, обладающей карбонатной жёсткостью, гидрокарбонаты разлагаются с образованием осадка нерастворимых

83
карбонатов (накипь): Сa(HCO3)2 → СaCO3↓ + H2O + CO2−.
Поэтому карбонатную жёсткость называют также временной (или устранимой), а
некарбонатную – постоянной жёсткостью.
Л Е К Ц И Я 9
ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ СОЕДИНЕНИЙ d-ЭЛЕМЕНТОВ
9.1 Введение
D-элементы, входящие в одну и ту же группу, образуют побочную подгруп- пу. Одна из особенностей химии элементов побочных подгрупп, заключается в том, что все d-элементы – металлы.
Как уже было показано в разделе 1.4.6 «Прогнозирование свойств элементов по положению в периодической таблице» лекции 1, при переходе от d-элементов IV периода к d-элементам V периода увеличение радиуса атома меньшее, чем у элементов главных подгрупп. При переходе от d-элементов V периода к d- элементам VI периода радиус атома практически не изменяется или даже умень- шается. Такой характер изменения радиусов атомов в побочных подгруппах при одновременном увеличении заряда ядра приводит к увеличению энергии иониза- ции. Поэтому в побочных подгруппах с увеличением порядкового номера элемен- та уменьшаются металлические свойства, и ослабляются основные свойства окси- дов и их гидратных форм. В отличие от главных подгрупп, в побочных подгруп-
пах с увеличением порядкового номера элемента увеличивается устойчивость высшей степени окисления.
9.2 D-металлы I группы
Электронная кон- фигурация атомов ме- ди, серебра и золота в невозбуждённом со-
стоянии – (n–1)d10ns1,
в возбуждённом –
(n–1)d9ns1np1. Поэтому теоретически возмож-
ны степени окисления
+1, +2 или +3 рас-
сматриваемых эле- ментов в соединениях.
Однако не все эти степени окисления являются устойчивыми.
Самой устойчивой степенью окисления меди является +2. Соединения меди в степени окисления +1 проявляют восстановительные свойства и легко окисля-
84
ются до соединений Cu+2. Соединения трёхвалентной меди неустойчивы.
Для серебра характерна только одна устойчивая степень окисления +1; сте- пени окисления +2 и +3 крайне неустойчивы.
Золото образует соединения, в которых оно одновалентно или трёхвалентно; степень окисления +2 для него нехарактерна. В отличие от меди и серебра, сте- пень окисления +3 для золота наиболее устойчива.
В ряду напряжений медь, серебро и золото стоят после водорода и не вос- станавливают водород из соляной и разбавленной серной кислот. Однако, в при- сутствии кислорода или других окислителей (например, пероксида водорода) медь растворяется в этих кислотах с образованием соответствующих солей двухвалент-
ной меди: 2 Cu + 4 HCl + O2 → 2 CuCl2 + 2 H2O .
Соединения меди (II) проявляют окислительные свойства, восстанавливаясь до соединений меди (I). Так, кипячением раствора соли меди (II) с металлической медью можно получить соединение одновалентной меди:
CuCl2 + Cu → 2 CuCl .
Ион Cu2+ окисляет иодид-ион до свободного йода:
2 CuSO4 + 4 KI → 2 CuI↓ + I2 + 2 K2SO4
(ϕo |
2 + |
|
− |
|
= +0,86 В; ϕo |
|
− |
= +0,55 В). |
|
Сu |
, I |
/ CuI |
I |
2 |
/ 2 I |
|
|||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
Эта реакция применяется для количественного определения ионов Cu2+.
При восстановлении гидроксида меди (II) формальдегидом образуется оксид меди
(I): 4 Cu(OH)2 + HCHO → 2 Cu2O + CO2 + 5 H2O .
Соединения меди (I) легко окисляются до соединений меди (II) или диспро-
порционируют: 4 CuCl + O2 + 4 HCl → 4 CuCl2 + 2 H2O ;
Cu2O + H2SO4 → Cu + CuSO4 + H2O;
2 CuCl → Cu + CuCl2 .
Окислением гидроксида меди (II) в щелочной среде можно получить очень неустойчивые соединения меди (III) – купраты (например, NaCuO2 – купрат нат-
рия): 2 Cu(OH)2 + NaClO + 2 NaOH → 2 NaCuO2 + NaCl + 3 H2O.
Купраты – очень сильные окислители и легко восстанавливаются до соединений меди (II): 2 NaCuO2 + 8 HCl → 2 CuCl2 + Cl2− + 2 NaCl + 4 H2O.
В отличие от соединений меди, соединения трёхвалентного золота более ус- тойчивы. Поэтому соединения золота (I) легко окисляются до соединений золота (III) или диспропорционируют по схеме:
Au+1 → Au0 + Au+3.
Гидроксид золота (III) обладает амфотерными свойствами и легко растворяется в щелочах с образованием гидроксоауратов:
Au(OH)3 + NaOH → Na[Au(OH)4] .
Амфотерность же гидроксида меди (II) выражена крайне слабо, и реакция образования гидроксокупратов протекает в незначительной степени в очень кон- центрированных растворах щелочей: Cu(OH)2 + 2 NaOH Na2[Cu(OH)4] .
85
Большинство солей серебра малорастворимо в воде; хорошо растворим нит- рат серебра.
При действии щелочей на растворы солей серебра образуется не гидроксид серебра, а бурый осадок оксида серебра:
2 AgNO3 + 2 NaOH → Ag2O↓ + 2 NaNO3 + H2O .
Особенностью d-металлов, в том числе меди, серебра и золота, является их способность к образованию комплексных соединений. Для соединений меди и се- ребра характерно образование амминокомплексов. При этом многие малораство- римые в воде соединения серебра и меди, например, AgCl, Ag2O, CuCl, Cu(OH)2 могут быть переведены в растворимое состояние:
Ag2O + 4 NH3 + H2O → 2 [Ag(NH3)2]OH;
AgCl + 2 NH3 → [Ag(NH3)2]Cl;
CuCl + 2 NH4OH → [Cu(NH3)2]Cl + 2 H2O .
Cu(OH)2 + 4 NH4OH → [Cu(NH3)4](OH)2 + 4 H2O .
Из ацидокомплексов для рассматриваемых элементов характерны галоге- нидные и цианидные комплексы. Так, нерастворимые в воде AgCl и CuCl заметно растворяются в концентрированном растворе HCl:
CuCl + HCl H[CuCl2].
При разбавлении раствора комплекс разрушается, и вновь выпадает осадок гало- генида серебра или меди (I).
Концентрированные растворы хлорида меди (II) имеют зелёную окраску, вследствие образования комплексных ионов [CuCl4]2– :
Cu2+ + 4 Cl– [CuCl4]2– .
При разбавлении раствора хлоридный комплекс разрушается, и зелёная окраска меняется на голубую, характерную для аквакомплексов меди (II):
[CuCl4]2– + 4 H2O [Cu(H2O)4]2+ + 4 Cl– .
Для золота также характерно образование хлоридных комплексов. Напри- мер, при растворении золота в «царской водке» также образуется комплексное со- единение золота (III) – H[AuCl4] – тетрахлорозолотая кислота (см. раздел 5.2.6 «Царская водка» лекции 5).
Особенно устойчивыми являются цианидные комплексы d-металлов. Нерас- творимые в воде CuCN, AgCN, AuCN растворяются в избытке раствора цианида калия или натрия с образованием комплексного соединения:
CuCN + KCN → K[Cu(CN)2] .
Цианидные комплексы меди, серебра, и золота характерны для степени окисления +1 этих металлов. Металл в более высокой степени окисления способен окислить цианид-ионы: 2 CuSO4 + 4 KCN → 2 CuCN↓ + (CN)2− + 2 K2SO4 .
Металлические медь, серебро и золото способны в присутствии кислорода растворяться в щелочных растворах цианидов:
4 Au + O2 + 8 KCN + 2 H2O → 4 K[Au(CN)2] + 4 KOH .
Эта реакция используется для растворения самородного золота и отделения его от
86
пустой породы.
Важная в практическом отношении реакция растворения галогенидов сереб- ра вследствие образования тиосульфатного комплекса применяется в фотографии:
AgBr + 2 Na2S2O3 → Na3[Ag(S2O3)2] + NaBr .
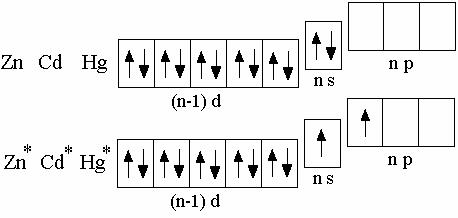
9.3 D-металлы II группы
D-металлы II группы – цинк, кад- мий, ртуть – характе-
ризуются наличием двух электронов в на- ружном слое атома:
электронная конфигу-
рация – (n–1)d10ns2 ,
поэтому в своих со- единениях эти элемен- ты двухвалентны.
Цинк и кадмий имеют постоянную степень окисления +2. Эта же степень окисле- ния характерна и для ртути, однако ртуть может образовывать соединения типа Cl–Hg–Hg–Cl , в которых она двухвалентна, но имеет степень окисления +1. Дис- социация таких соединений в растворе протекает с образованием иона Hg22+:
Hg2(NO3)2 → Hg22+ + 2 NO3– .
Цинк и кадмий – активные металлы, стоящие в ряду напряжений до водоро- да. Цинк и кадмий схожи по своим химическим свойствам, с тем лишь различием, что гидроксид и оксид кадмия не являются амфотерными соединениями. Как и для d-элементов I группы для кадмия и цинка характерны реакции образования амминокомплексов, цианидных комплексов, аквакомплексов, а для цинка ещё и гидроксокомплексов. Цинк как амфотерный металл способен растворяться в рас- творах щелочей, проявляя свойства сильного восстановителя:
Zn + 2 NaOH + 2 H2O → Na2[Zn(OH)4] + H2− .
Порошкообразный цинк восстанавливает нитрат- и нитрит-ионы в щелочном рас- творе до аммиака (см. также раздел 5.2.4 «Азотистая кислота и её соли» лекции 5): 4 Zn + KNO3 + 7 KOH + 6 H2O → NH3− + 4 K2[Zn(OH)4]
3 Zn + KNO2 + 5 KOH + 5 H2O → NH3− + 3 K2[Zn(OH)4].
Ртуть – единственный металл, который при обычных условиях находится в жидком состоянии. Ртуть способна растворять в себе многие металлы, образуя с ними сплавы – амальгамы.
Одна из особенностей химии ртути заключается в том, что при действии щелочей на растворы солей ртути, как и в случае серебра, образуются не гидро- ксиды, а оксиды ртути. Гидроксиды ртути не получены:
Hg22+ + 2 OH– → Hg2O↓ + H2O; Hg2+ + 2 OH– → HgO↓ + H2O .

87
Нитрат ртути (I) Hg2(NO3)2 – одна из немногих растворимых солей ртути в степени окисления +1 – получается действием холодной разбавленной азотной кислоты на избыток ртути:
6 Hg + 8 HNO3 (разб.) → 3 Hg2(NO3)2 + 2 NO− + 4 H2O .
Используя раствор Hg2(NO3)2, можно обменной реакцией получить любую мало- растворимую соль ртути (I), например, каломель Hg2Cl2:
Hg22+ + 2 Cl– → Hg2Cl2↓ .
Нитрат ртути (II) образуется при взаимодействии ртути с избытком горячей
концентрированной HNO3: Hg + 4 HNO3 (конц.) → Hg(NO3)2 + 2 NO2− + 2 H2O .
Хлорид ртути (II), или сулема, образуется при непосредственном взаимо- действии простых веществ или нагреванием сульфата ртути (II) с хлоридом нат- рия; образующаяся сулема сублимируется; от последнего слова она и получила
своё название: |
t° |
|
HgSO4 + 2 NaCl → Na2SO4 + HgCl2−. |
Сулема – одна из немногих солей, которая в водном растворе слабо диссо- |
|
циирована. Сулема, как и все растворимые соли ртути, – сильный яд. |
|
Соединения Hg22+ в зависимости от условий реакции проявляют как окисли- тельные, так и восстановительные свойства:
Hg2Cl2 + Cl2 → 2 HgCl2; Hg2Cl2 + SnCl2 → 2 Hg + SnCl4 .
Соединения ртути в степени окисления +1 склонны к диспропорционированию по
схеме: |
Hg22+ → Hg0 + Hg2+. |
Соединения |
ртути (II) обладают окислительными свойствами, например, |
Hg2Cl2 можно также получить, нагревая металлическую ртуть с сулемой: HgCl2 + Hg → Hg2Cl2 .
Ион ртути Hg2+ является комплексообразователем в реакциях образования ацидокомплексов, из которых наиболее прочными являются цианидные и галоге- нидные комплексы. Например, малорастворимые в воде осадки цианида и иодида ртути (II) способны растворяться в избытке растворов цианида и иодида калия с
образованием комплексных соединений: |
|
Hg(NO3)2 + 2 KCN → Hg(CN)2↓ + 2 KNO3 |
HgCl2 + 2 KI → HgI2↓ + 2 KCl; |
Hg(CN)2 + 2 KCN → K2[Hg(CN)4] |
HgI2 + 2 KI →K2[HgI4] . |
9.4 Хром
Электронная конфигура-
ция невозбуждённого атома хрома – 3d54s1.
Для хрома в соединениях наиболее характерны степени окисления +2, +3 и +6.
Хром – металл, находящийся в ряду напряжений до водорода; поэтому ме- таллический хром восстанавливает водород из разбавленных растворов HCl и

88
H2SO4 . В холодной концентрированной азотной кислоте хром нерастворим и по- сле обработки ею становится пассивным.
Хром образует три оксида: основной CrO, амфотерный Cr2O3, кислотный
CrO3.
Соли двухвалентного хрома образуются при растворении металлического хрома в соляной или разбавленной серной кислотах. При добавлении к раствору соли хрома (II) выпадает жёлтый осадок гидроксида хрома (II), обладающего ос- новными свойствами: Cr2+ + 2 OH– → Cr(OH)2↓ .
Соединения хрома (II) неустойчивы, являются сильными восстановителями, окисляясь до соединений хрома (III), которые окрашены в различные тона зелёно-
го цвета: 4 Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3 .
Соли хрома (II) способны вытеснять водород из кислот (ϕo |
3 + |
|
2 + |
= –0,41 В; |
||
|
|
Cr |
/ Cr |
|
||
|
|
|
|
|
||
ϕo |
+ |
= 0 В), а также постепенно разлагать воду при отсутстствии другого |
||||
2 H |
|
/ H |
|
|
|
|
|
|
2 |
|
|
|
|
окислителя (ϕ2 H2O / H2 , 2 OH− = –0,41 В при pH = 7):
2 CrCl2 + 2 HCl → 2 CrCl3 + H2↑
2 CrCl2 + 2 H2O 2 CrOHCl2 + H2↑ .
Таким образом, хлорид хрома (II), образующийся при растворении металлическо- го хрома в соляной кислоте, можно рассматривать как промежуточное соедине- ние, которое окисляется ионами водорода до хлорида хрома (III):
Cr + 2 HCl → CrCl2 + H2−
2 CrCl2 + 2 HCl → 2 CrCl3 + H2−;
суммарное уравнение:
2 Cr + 6 HCl → 2 CrCl3 + 3 H2− .
Степень окисления хрома +3 является самой устойчивой, поэтому соедине- ния хрома (III) не проявляют ярко выраженных окислительных или восстанови- тельных свойств. Для восстановления соединений хрома (III) в соединения хрома (II) необходим сильный восстановитель, например, атомарный водород в момент выделения, который является промежуточным продуктом взаимодействия цинка с
соляной кислотой: |
HCl |
2 CrCl2 + ZnCl2 . |
|
||
|
2 CrCl3 + Zn · |
Сильные окислители (хлор, бром, пероксид водорода) окисляют в щелочной среде соединения хрома (III) до соединений хрома (VI):
2 Cr(OH)3 + 3 H2O2 + 4 NaOH → 2 Na2CrO4 + 8 H2O .
Оксид и гидроксид хрома (III) – амфотерные соединения, поэтому они взаи- модействуют со щелочами, образуя при сплавлении метахромиты, а в водном рас- творе – гидроксокомплексы: Cr2O3 + 2 NaOH → 2 NaCrO2 + H2O;
Cr(OH)3 + 3 NaOH → Na3[Cr(OH)6] .
89
Важнейшие соединения хрома (VI) – триоксид хрома, или хромовый ангид- рид, и соли соответствующих ему кислот: хромовой H2CrO4 (хроматы) и дихромо- вой H2Cr2O7 (дихроматы). Сами кислоты существуют только в растворе и при по- пытке их выделения распадаются на ангидрид и воду. Хроматы окрашены в жёл- тый цвет, дихроматы – в оранжевый. Хромат-ионы неустойчивы в кислой среде и превращаются при подкислении раствора в дихромат-ионы:
2CrO42– + 2H+ → Cr2O72– + H2O 2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O
При этом жёлтая окраска раствора изменяется на оранжевую. Напротив, дихро- мат-ионы неустойчивы в щелочной среде и при подщелачивании раствора пре- вращаются в хромат-ионы, вследствие чего оранжевый цвет раствора изменяется на жёлтый:
Cr2O72– + 2 OH– → 2 CrO42– + H2O |
K2Cr2O7 + 2 KOH → 2K2CrO4 + H2O |
||||
|
Дихроматы в |
кислой среде проявляют сильные окислительные свойства |
|||
(ϕo |
O2 − ,14H+ / 2 Cr3 + |
, 7 H |
|
= + 1,33 В) и восстанавливаются до солей хрома (III): |
|
Cr |
2 |
O |
|
||
2 |
7 |
|
|
|
|
Cr2O72– + 14 H+ + 6 e– → 2 Cr3+ + 7 H2O;
K2Cr2O7 + 14 HCl (конц.) → 2 CrCl3 + 3 Cl2− + 2 KCl + 7 H2O; K2Cr2O7 + 3 Na2SO3 + 4 H2SO4 → Cr2(SO4)3 + 3 Na2SO4 + K2SO4 + 4 H2O.
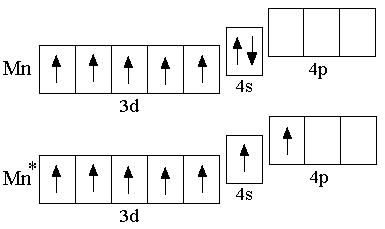
9.5 Марганец
Электронная конфигура-
ция невозбуждённого атома марганца – 3d54s2; возбуждён-
ное состояние выражается
электронной формулой
3d54s14p1.
Для марганца в соедине- ниях наиболее характерны сте- пени окисления +2, +4, +6, +7.
Марганец – серебристо- белый, хрупкий, достаточно ак- тивный металл: в ряду напряжений он находится между алюминием и цинком. На
воздухе марганец покрыт оксидной плёнкой, предохраняющей его от дальнейшего окисления. В мелкораздробленном состоянии марганец окисляется легко.
Оксид марганца (II) MnO и соответствующий ему гидроксид Mn(OH)2 обла- дают основными свойствами – при их взаимодействии с кислотами образуются соли двухвалентного марганца: Mn(OH)2 + 2 H+ → Mn2+ + 2 H2O.
Катионы Mn2+ образуются также при растворении металлического марганца в кислотах. Соединения марганца (II) проявляют восстановительные свойства, на- пример, белый осадок Mn(OH)2 на воздухе быстро темнеет, постепенно окисляясь
90
до MnO2: 2 Mn(OH)2 + O2 ® 2 MnO2 + 2 H2O.
Оксид марганца (IV) MnO2 является наиболее устойчивым соединением марганца; он легко образуется как при окислении соединений марганца в более низкой степени окисления (+2), так и при восстановлении соединений марганца в более высоких степенях окисления (+6, +7):
Mn(OH)2 + H2O2 ® MnO2 + 2 H2O;
2 KMnO4 + 3 Na2SO3 + H2O ® 2 MnO2¯ + 3 Na2SO4 + 2 KOH .
MnO2 – амфотерный оксид, однако и кислотные, и основные свойства у него выражены слабо. Одной из причин того, что MnO2 не проявляет отчётливо выра- женных основных свойств, является его сильная окислительная активность в ки-
слой среде (jo |
|
, 4H+ / Mn2 + , 2 H |
|
= +1,23 В): MnO2 восстанавливается до ионов |
MnO |
2 |
2 |
O |
|
|
|
|
Mn2+, а не образует устойчивых солей четырёхвалентного марганца. Соответст- вующую оксиду марганца (IV) гидратную форму следует рассматривать как гид- ратированный диоксид марганца MnO2×xH2O. Оксиду марганца (IV) как амфотер- ному оксиду формально соответствуют орто- и мета-формы не выделенной в сво- бодном состоянии марганцоватистой кислоты: H4MnO4 – орто-форма и H2MnO3 – мета-форма. Известен оксид марганца Mn3O4, который можно рассматривать как соль двухвалентного марганца орто-формы марганцоватистой кислоты Mn2MnO4 – ортоманганит марганца (II). В литературе имеются сообщения о существовании оксида Mn2O3. Существование этого оксида можно объяснить, рассмотрев его как соль двухвалентного марганца мета-формы марганцоватистой кислоты: MnMnO3 – метаманганит марганца (II).
При сплавлении в щелочной среде диоксида марганца с такими окислителя- ми как хлорат или нитрат калия происходит окисление четырёхвалентного мар- ганца до шестивалентного состояния, и образуется манганат калия – соль очень неустойчивой даже в растворе марганцовистой кислоты H2MnO4, ангидрид кото- рой (MnO3) неизвестен:
MnO2 + KNO3 + 2 KOH ® K2MnO4 + KNO2 + H2O .
Манганаты неустойчивы и склонны к диспропорционированию по обратимой ре-
акции: 3 K2MnO4 + 2 H2O 2 KMnO4 + MnO2¯ + 4 KOH ,
вследствие чего зелёная окраска раствора, обусловленная манганат-ионами
MnO42–, изменяется на фиолетовую окраску, характерную для перманганат-ионов
MnO4–.
Наиболее широко применяемое соединение семивалентного марганца – перманганат калия KMnO4 – соль известной только в растворе марганцовой кис- лоты HMnO4. Перманганат калия можно получить окислением манганатов силь- ными окислителями, например, хлором:
2 K2MnO4 + Cl2 ® 2 KMnO4 + 2 KCl .
Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 – взрывчатая зелёно- бурая жидкость. Mn2O7 может быть получен по реакции:
