
общая и неорганическая химия
.pdf
|
61 |
Для NO характерна окислительно-восстановительная двойственность: |
|
2 NO + O2 → 2 NO2; |
2 NO + 2 H2 → N2 + 2 H2O. |
Оксид азота (IV) NO2 – бурый ядовитый газ с неприятным запахом. Он об- разуется при взаимодействии NO с кислородом воздуха. Оксид азота (IV) легко конденсируется в красную жидкость (t кипения = +21 °C), которая при охлаждении светлеет и при температуре минус 11,2 °С замерзает, образуя белую массу.
Молекулы NO2 способны к димеризации с образованием молекул N2O4 , вследствие чего устанавливается химическое равновесие:
2 NO2 |
охлаждение |
N2O4 . |
|
нагревание |
|||
|
|
Так как N2O4 – бесцветное вещество, а NO2 имеет бурый цвет, за смещением
этого равновесия при нагревании или охлаждении газовой смеси легко судить по изменению её окраски.
NO2 – энергичный окислитель, многие вещества способны гореть в атмо- сфере диоксида азота. Поскольку атом азота в молекуле NO2 находится в проме- жуточной степени окисления, то диоксид азота может проявлять и свойства вос- становителя, а также диспропорционировать:
2 NO2 + H2O → HNO2 + HNO3 .
Азотистая кислота неустойчива и разлагается по схеме:
3 HNO2 → HNO3 + 2 NO + H2O .
Суммарно реакция взаимодействия NO2 с водой описывается уравнением:
3 NO2 + H2O → 2 HNO3 + NO .
В присутствии воздуха образующийся NO окисляется до NO2 и реакция протекает по уравнению: 4 NO2 + O2 + 2 H2O → 4 HNO3 .
Таким образом, следующая последовательность химических превращений
N2 → NH3 → NO → NO2 → HNO3
лежит в основе современного способа получения азотной кислоты.
При взаимодействии NO2 с растворами щелочей образуется смесь солей азотной и азотистой кислот:
2 NO2 + 2 NaOH → NaNO2 + NaNO3 + H2O.
Оксид азота (III) N2O3 (азотистый ангидрид) – тёмно-синяя жидкость, разла- гающаяся даже при низких температурах на NO и NO2:
N2O3 NO + NO2.
Оксид азота (V) N2O5 (азотный ангидрид) – белое кристаллическое вещест- во, уже при комнатной температуре разлагающееся на NO2 и O2. Азотный ангид- рид может быть получен действием водоотнимающих средств (например, P2O5) на
азотную кислоту: 2 HNO3 + P2O5 → 2 HPO3 + N2O5 .
Оксид азота (V) – очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются.
62
5.2.4 Азотистая кислота и её соли
HNO2 – слабая кислота (К = 4×10–4); известна только в разбавленных водных растворах. Атом азота в молекуле HNO2 находится в промежуточной степени окисления +3, поэтому азотистая кислота и её соли – нитриты – проявляют окис- лительно-восстановительную двойственность. Под действием большинства вос- становителей восстановление нитритов обычно протекает до NO:
2KNO2 + 2 KI + 2 H2SO4 ® I2 + 2 NO- + 2 K2SO4 + 2 H2O;
цинк и алюминий в щелочной среде восстанавливают нитрит-ионы до аммиака: KNO2 + 2 Al + KOH + 5 H2O ® NH3- + 2 K[Al(OH)4]
Последняя реакция является качественной реакцией на ионы NO2– (а также NO3–). Под действием окислителей нитрит-ионы окисляются до нитрат-ионов:
2 KMnO4 + 5 KNO2 + 3 H2SO4 ® 2 MnSO4 + 5 KNO3 + K2SO4 + 3 H2O .
При действии на растворы нитритов разбавленной серной кислоты сначала образуется азотистая кислота, которая далее распадается, претерпевая диспропор-
ционирование: H2SO4 + 2 NaNO2 ® Na2SO4 + 2 HNO2
3 HNO2 ® HNO3 + 2 NO- + H2O.
Нитриты щелочных металлов можно получить разложением нитратов (см. следующий раздел данной лекции).
5.2.5 Азотная кислота и её соли
Чистая HNO3 – бесцветная жидкость, постепенно разлагающаяся на свету:
4 HNO3 ® 4 NO2 + O2 + 2 H2O.
Вследствие этого концентрированные растворы азотной кислоты могут иметь бу- рую окраску. HNO3 принадлежит к числу наиболее сильных кислот.
Характерным свойством азотной кислоты является её ярко выраженная окислительная активность. Большинство неметаллов окисляется концентрирован- ной HNO3 до высшей степени окисления; из галогенов азотной кислотой окисля-
ется только йод (до степени окисления |
+5): |
|
|
S ® H2SO4, |
P ® H3PO4, |
C ® CO2, |
I2 ® HIO3 . |
Сама HNO3 восстанавливается при этом до NO и (или) NO2.
Азотная кислота окисляет почти все металлы (исключение Au, Pt, Ta, Rh, Ir), превращая их чаще всего в нитраты. Сама азотная кислота может восстанавли- ваться до NO2, NO, N2O, N2, NH4+ . Чем меньше концентрация кислоты и чем бо- лее активен металл, тем более глубоко протекает её восстановление. При реакциях металлов (особенно малоактивных) с концентрированной кислотой преимущест- венно выделяется NO2:
Cu + 4 HNO3 (конц.) ® Cu(NO3)2 + 2 NO2- + 2 H2O .
При взаимодействии разбавленной HNO3 с малоактивными металлами, на- пример, медью, серебром, свинцом, выделяется NO. В случае более активных ме- таллов (железо, цинк) азотная кислота восстанавливается до NO, N2O или N2:
3 Cu + 8 HNO3 (разб.) ® 3 Cu(NO3)2 + 2 NO- + 4 H2O;
63
4 Zn + 10 HNO3 (разб.) → 4 Zn(NO3)2 + N2O− + 5 H2O .
Сильно разбавленная HNO3 взаимодействует с активными металлами (маг- ний, кальций, порошкообразный цинк) с образованием нитрата аммония:
4 Mg + 10 HNO3 (очень разб.) → 4 Mg(NO3)2 + NH4NO3 + 3 H2O .
При взаимодействии азотной кислоты с металлами выделения водорода чаще все- го не наблюдается.
Концентрированная HNO3 пассивирует некоторые металлы: железо, хром и алюминий не растворяются в холодной азотной кислоте.
Соли азотной кислоты – нитраты – термически неустойчивы и при нагрева- нии разлагаются с отщеплением кислорода. При этом нитраты наиболее активных металлов (щелочных и щелочноземельных) превращаются в нитриты:
2 KNO3 → 2 KNO2 + O2−.
Нитраты большинства остальных металлов (за исключением нитратов благород- ных металлов и ртути) разлагаются на оксид металла, диоксид азота и кислород:
2 Сu(NO3)2 → 2 CuO + 4 NO2− + O2− .
При разложении нитратов наименее активных металлов (серебра, золота, ртути) выделяется свободный металл: 2 AgNO3 → 2 Ag + 2 NO2− + O2− .
Все нитраты хорошо растворимы в воде. Их водные растворы, в отличие от водных растворов нитритов, практически не проявляют окислительных свойств.
Наиболее важное практическое значение имеют нитраты натрия, калия, ам- мония и кальция, которые называют селитрами (например, NaNO3 – натриевая се- литра, Сa(NO3)2 – кальциевая селитра, NH4NO3 – аммиачная селитра); их приме- няют в качестве минеральных удобрений. Азотная кислота и нитраты также ис- пользуются для изготовления взрывчатых средств и пиротехнических изделий.
Основное биологическое значение азота заключается в том, что он, наряду с углеродом, является основой жизни, входя в состав белковых молекул.
5.2.6 «Царская водка» Смесь, состоящая из одного объёма концентрированной азотной кислоты и
трёх объёмов концентрированной соляной кислоты, называется «царской водкой». Она способна растворять металлы, не взаимодействующие с азотной кислотой, в
том числе золото и платину. |
|
|
|
|
|
|
|
|||||
|
|
Металлическое золото не взаимодействует с азотной кислотой, поскольку |
||||||||||
стандартный |
электродный |
потенциал |
восстановительной |
системы |
||||||||
ϕo |
3 + |
= +1,51 В значительно превышает потенциал окислительной системы: |
||||||||||
Au |
/ Au |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
||
ϕo |
|
, 4H+ / NO, 2H |
|
= + 0,96 В |
(или ϕo |
/ NO |
|
, H |
|
= + 0,80 В). |
|
|
NO− |
2 |
O |
NO− , 2 H+ |
2 |
2 |
O |
|
|||||
|
3 |
|
|
|
3 |
|
|
|
|
|||
Однако, золото растворимо в «царской водке» |
|
|
|
|
|
|
||||||
|
|
|
|
Au + HNO3 + 4 HCl → H[AuCl4] + NO− + 2 H2O |
|
|||||||
благодаря тому, |
что в качестве конечного продукта реакции образуется высоко- |
|||||||||||
64
стабильный комплексный ион [AuCl4]–, и величина стандартного электродного по- тенциала восстановительной системы уменьшается:
система восстановительная: Au + 4 Cl– → [AuCl4]– + 3e– ϕo |
|
|
|
] |
− |
/ Au , 4 Cl |
− = +0,99 В, |
|
[AuCl |
4 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
система окислительная: NO3– + 4H+ +3e–→NO + 2H2O ϕo |
− |
, 4H+ |
/ NO, 2H |
|
= +0,96 В. |
|||
NO |
2 |
O |
||||||
|
3 |
|
|
|
|
|
|
|
Величины электродных потенциалов, приведённые выше, относятся к стандарт- ным условиям, в частности, к концентрациям 1 моль/л всех участвующих в реак- ции веществ. Расчёт по уравнению Нернста показывает, что в реальных условиях (смесь концентрированных HNO3 и HCl) потенциал окислительной системы пре- вышает потенциал восстановительной, так что возможность протекания этой ре- акции согласуется с выводами теории электродных потенциалов.
Аналогично рассматривается вопрос о возможности растворения платины в азотной кислоте и «царской водке»:
ϕo |
2 + |
|
= + 1,19 В > ϕo |
− |
|
+ |
|
|
= + 0,96 В, |
Pt |
/ Pt |
NO |
, 4H |
/ NO, 2H |
|
O |
|||
|
3 |
|
2 |
||||||
|
|
|
|
|
|
|
|
поэтому платина не реагирует с азотной кислотой. Образование же устойчивого комплекса [PtCl6]2– уменьшает величину потенциала восстановительной системы:
система восстановительная: Pt + 6 Cl– → [PtCl6]2– + 4e– |
ϕo |
|
|
] |
2 − |
/ Pt , 6 Cl |
− = + 0,73 В; |
||
|
[PtCl |
6 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
система окислительная: NO3– +4H+ +3e–→NO + 2H2O |
ϕo |
, 4H |
+ / NO, 2H |
|
|
= +0,96 В. |
|||
|
NO− |
2 |
O |
||||||
|
3 |
|
|
|
|
|
|
||
Сравнение величин электродных потенциалов окислительной и восстановитель- ной систем позволяет сделать вывод о возможности растворения платины в «цар-
ской водке»: |
3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO− + 8 H2O. |
Таким образом, образование комплексов может привести к существенному |
|
изменению окислительно-восстановительных свойств ионов, что выражается в изменении величины окислительно-восстановительного потенциала. По этой при- чине золото, например, может также растворяться в растворах цианидов, окисля- ясь кислородом воздуха (см. раздел 9.2 «D-металлы I группы» лекции 9).
5.3 Фосфор
5.3.1 Свойства фосфора – простого вещества При обычных условиях фосфор представляет собой твёрдое вещество.
Вследствие лёгкой окисляемости фосфор не встречается в природе в свободном состоянии. Наиболее важным природным соединением фосфора является минерал фосфорит Ca3(PO4)2. Фосфор в свободном состоянии получают прокаливанием фосфорита с песком и углём в электрических печах без доступа воздуха с после- дующей конденсацией паров фосфора:
Ca3(PO4)2 + 3 SiO2 → 3 CaSiO3 + P2O5 P2O5 + 5 C → 2 P− + 5 CO−. Суммарное уравнение реакции: Ca3(PO4)2 + 3SiO2 + 5C → 3CaSiO3 + 2P− + 5CO− .

65
Свободный фосфор непосредственно взаимодействует со многими веществами: с кислородом, галогенами, активными металлами; в последнем случае образуются фосфиды металлов, аналогичные нитридам:
3 Ca + 2 P® Ca3P2 (фосфид кальция).
Для фосфора известны несколько аллотропных модификаций: белый, крас- ный, черный фосфор и другие.
Белый фосфор получают быстрым охлаждением паров фосфора; он пред- ставляет собой белое воскообразное вещество, светящееся в темноте вследствие окисления. Фосфор малорастворим в воде; хорошо растворим в сероуглероде. Белый фосфор чрезвычайно химически активен, самовоспламеняется на воздухе, вследствие чего его хранят под слоем воды. Белый фосфор имеет молекулярную крис- таллическую решётку, в узлах которой находятся непрочные
тетраэдрические молекулы P4; этим и объясняется его высокая химическая активность. Белый фосфор – очень сильный яд, даже малые дозы которого смертельны.
Красный фосфор образуется при нагревании белого фосфора без доступа воздуха. Красный фосфор не ядовит, не светится в темноте, воспламеняется толь- ко при температурах выше 260°C. Красный фосфор имеет полимерную структуру. При нагревании красный фосфор сублимируется, при охлаждении паров получа- ется белый фосфор.
Чёрный фосфор образуется при нагревании белого фосфора без доступа воздуха при очень высоком давлении. Внешне чёрный фосфор похож на графит и обладает полупроводниковыми свойствами.
Биологическая роль фосфора: фосфор, как и азот, необходим для живых су- ществ, поскольку он входит в состав белков крови, мозговой и нервной тканей.
5.3.2 Фосфорный ангидрид. Фосфорная и пирофосфорная кислоты При сгорании фосфора в кислороде или на воз-
духе образуется оксид фосфора (V) – белое твёрдое вещество. Cостав молекул оксида фосфора (V) отве- чает формуле P4O10, а не простейшей брутто-формуле P2O5. Оксид фосфора (V) очень гигроскопичен и по- этому является хорошим водоотнимающим средст- вом. Гидратация оксида фосфора (V) представляет собой сложный процесс, промежуточными продукта- ми которого являются полимерные фосфорные ки- слоты. Конечный продукт гидратации P2O5 – орто- фосфорная кислота H3PO4 . Поэтому P2O5 (P4O10) счи-
тают ангидридом фосфорной кислоты. H3PO4 – слабая трёхосновная кислота: K1 = 7,5×10–3 ; K2 = 6,2×10–8 ; K3 = 1,2×10–13 .

66
Кроме орто-формы для фосфорной кислоты характерна также и мета-форма (HPO3)x. Метафосфорные кислоты (HPO3)x , например, (HPO3)4, имеют циклическое строение. Часто при обсуждении состава метафосфорных кислот запи- сывают простейшую формулу HPO3.
H3PO4 и (HPO3)x – кристаллические вещества.
Из полифосфорных кислот в кристаллическом состоянии выделена только простейшая дифосфорная (пирофосфорная) кислота – H4P2O7; её соли называются дифосфатами или пиро- фосфатами.
Несмотря на высшую степень окисления фосфора, ни са- ма фосфорная кислота, ни её соли – фосфаты – в растворах не
проявляют окислительных свойств, что связано с высокой устойчивостью соеди- нений фосфора в степени окисления +5.
В лабораторных условиях ортофосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой.
Существуют два промышленных способа получения H3PO4: экстракционный и термический. Экстракционный метод заключается в обработке природных фос- фатов серной кислотой с последующим отделением сульфата кальция и концен- трированием фосфорной кислоты:
Ca3(PO4)3 + 3 H2SO4 ® 3 CaSO4 + 2 H3PO4 .
При получении фосфорной кислоты термическим методом проводится вос- становление фосфатов до чистого фосфора (см. раздел 5.3.1 «Свойства фосфора – простого вещества» данной лекции), сжигание фосфора и последующая гидрата- ция фосфорного ангидрида.
Соли фосфорной кислоты применяются в сельском хозяйстве в качестве ми- неральных удобрений.
5.3.3 Фосфористый ангидрид. Фосфористая и фосфорноватистая кислоты При неполном окислении фосфора кислородом (на-
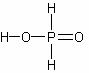
пример, при недостатке кислорода) образуется смесь окси- дов фосфора (III) и фосфора (V). Оксид фосфора (III) состо- ит из молекул P4O6. Формула P2O3 является простейшей. P2O3 (P4O6) – это ангидрид фосфористой кислоты H3PO3.
Фосфористая кислота двухосновна; по силе H3PO3 сравнима с фосфорной кислотой: K1 = 1×10–2 , K2 = 3×10–7 .
Фосфористая кислота и её соли фосфиты проявляют сильные восстанови-
|
|
|
|
|
|
|
67 |
|
тельные свойства (jo |
PO |
|
, 2 H+ |
/ H |
PO |
|
, H |
= – 0,28 В) и окисляются до соединений |
H |
4 |
3 |
O |
|||||
3 |
|
|
3 |
|
2 |
|
||
фосфора в степени окисления +5: |
|
|
|
|
||||
H3PO3 + H2O2 ® H3PO4 + H2O; |
|
|
H3PO3 + I2 + H2O ® H3PO4 + 2 HI . |
|||||
Фосфорноватистая кислота H3PO2 – одноосновная кислота, го- раздо более сильная, чем H3PO4 (KH3PO2 = 9×10–2). Фосфорноватистая кислота и её соли гипофосфиты, также как и соединения фосфора
+3, – сильные восстановители: jo |
= – 0,39 В. Они способны |
H3PO4 , 4 H+ |
/ H3PO2 , 2 H2O |
восстанавливать ионы металлов, например, Ni2+, Hg2+, до свободных металлов, окисляясь при этом до фосфорной кислоты или фосфатов.
2 NiSO4 + H3PO2 + 2 H2O ® 2 Ni + H3PO4 + 2 H2SO4 ;
2 HgCl2 + H3PO2 + 2 H2O ® 2 Hg + H3PO4 + 4 HCl .
Соединения фосфора +1 и +3 при нагревании диспропорционируют: 3 H3PO2 ® 2 H3PO3 + PH3; 4 H3PO3 ® 3 H3PO4 + PH3 .
5.3.4 Соединение фосфора с водородом
С водородом фосфор образует фосфористый водород PH3 (фосфин). Фосфин – очень ядовитый бесцветный газ с чесночным запахом. Получается
в результате гидролиза фосфидов или диспропорционирования белого фосфора в растворе щелочи при кипячении:
Ca3P2+ 6 HOH ® 3 Ca(OH)2 + 2 PH3-;
4 P + 3 NaOH + 3 H2O ® 3 NaH2PO2 + PH3-.
Фосфин обладает сильными восстановительными свойствами и способен само- воспламеняться на воздухе (при температуре выше 150 °C):
2 PH3 + 4 O2 ® P2O5 + 3 H2O .
Основные свойства выражены у фосфина слабее, чем у аммиака: он образу- ет соли фосфония только с наиболее сильными кислотами, например, HI, HClO4. Эти соединения очень непрочны и легко гидролизуются в воде:
PH4I ® PH3 + HI .
5.3.5 Галогениды фосфора Фосфор может быть окислен активными галогенами (фтор, хлор, бром) до
высшей степени окисления +5, йод окисляет фосфор до трёхвалентного состоя-
ния: |
2 P + 5 Cl2 ® 2 PCl5 ; |
2 P + 3 I2 ® 2 PI3 . |
При окислении фосфора недостатком хлора можно получить PCl3. |
||
|
Галогениды фосфора легко гидролизуются водой с образованием соответст- |
|
вующих кислот, поэтому их называют галогенангидридами. |
||
PCl5 – хлорангидрид фосфорной кислоты: |
PCl5 + 4 H2O ® H3PO4 + 5 HCl; |
|
PI3 – йодангидрид фосфористой кислоты: |
PI3 + 3 H2O ® H3PO3 + 3 HI . |
|
68
5.4 Мышьяк
Подобно фосфору, мышьяк существует в нескольких аллотропных модифи- кациях. Наиболее устойчив при обычных условиях металлический (или серый) мышьяк – хрупкое вещество серого цвета с металлическим блеском на изломе, нерастворимое в воде.
При сгорании мышьяка в кислороде образуется мышьяковистый ангидрид As2O3 (высшая степень окисления +5 для мышьяка менее устойчива, чем для фос- фора). Сильные окислители (хлор, азотная кислота) способны окислить мышьяк до пятивалентного состояния:
3 As + 5 HNO3 + 2 H2O ® 3 H3AsO4 + 5 NO- .
As2O3 – амфотерный оксид с преобладанием кислотных свойств. При взаи-
модействии мышьяковистого ангидрида с водой образуется ортомышьяковистая
кислота: As2O3 + 3 H2O ® 2 H3AsO3.
H3AsO3 в свободном состоянии не получена и известна только в водных рас- творах, где устанавливается сильно смещённое вправо равновесие:
H3AsO3 HAsO2 + H2O.
HAsO2 – очень слабая кислота (K = 6×10–10). При действии щелочей на As2O3 обра-
зуются ортоарсениты: As2O3 + 6 NaOH ® 2 Na3AsO3 + 3 H2O,
т.е. мышьяковистая кислота (в отличие от фосфористой) трёхосновна. Соединения мышьяка +3 проявляют восстановительные свойства и при окислении переходят в соединения мышьяка +5.
Мышьяковая кислота H3AsO4 – твёрдое, хорошо растворимое в воде веще- ство; по силе почти равна фосфорной кислоте (K1 = 6×10–3). Её соли – арсенаты – во многом похожи на фосфаты, однако, вследствие того, что высшая степень окисления +5 для мышьяка менее устойчива, чем для фосфора, мышьяковая кис- лота и арсенаты в кислой среде проявляют окислительные свойства, переходя в мышьяковистую кислоту или арсениты:
2 K3AsO4 + 4 KI + 5 H2SO4 ® 2 H3AsO3 + 2 I2 + 5 K2SO4 + 2 H2O
(jo |
|
|
|
, 2 H+ / H |
|
|
|
|
|
= + 0,56 В; |
jo |
= + 0,55 В). |
H |
3 |
AsO |
4 |
3 |
AsO |
3 |
, H |
2 |
O |
I2 / 2 I− |
|
|
|
|
|
|
|
|
|
|
В то же время в щелочной среде арсениты легко окисляются до арсенатов:
|
K3AsO3 + I2 + 2 KOH ® K3AsO4 + 2 KI + H2O |
|||||||
(jo |
− , H |
|
O / AsO3 |
− |
, 2 OH− |
= – 0,71 В; |
jo |
= + 0,55 В). |
AsO3 |
2 |
|
I2 / 2 I− |
|
||||
4 |
|
3 |
|
|
|
|
|
|
При прокаливании мышьяковой кислоты получается оксид мышьяка (V), (мышьяковый ангидрид) в виде белой стеклообразной массы.
При восстановлении соединений мышьяка водородом в момент выделения образуется арсин (AsH3) – бесцветный, очень ядовитый газ с чесночным запахом:
As2O3 + 6 Zn + 6 H2SO4 ® 2 AsH3- + 6 ZnSO4 + 3 H2O .
Арсин при нагревании легко разлагается на мышьяк и водород. Выделяю-
69
щийся мышьяк на холодных стенках стеклянных сосудов образует зеркальный на- лёт («мышьяковое зеркало»); это свойство используется в качественном анализе для обнаружения соединений мышьяка.
Мышьяк при нагревании с наиболее активными металлами образует арсе-
ниды: 2 As + 3 Ca → Ca3As2 .
Разложением арсенидов кислотами также можно получить арсин. Свободный мышьяк и все его соединения – сильные яды.
Области практического применения: сельское хозяйство (инсектициды); ме- дицина (стоматология).
5.5 Сурьма
В свободном состоянии сурьма – серебристо-белое вещество с металличе- ским блеском. Напоминая по внешнему виду металл, сурьма отличается от метал- лов хрупкостью и низкой электропроводностью. Сурьма существует в нескольких аллотропных модификациях.
Соединения сурьмы сходны с соединениями мышьяка. Так, сурьма образует соединения с металлами – антимониды, например, Ca3Sb2 , AlSb. Стибин (SbH3)
– ядовитый газ, образующийся в тех же условиях, что и арсин, но отличающийся
от арсина ещё меньшей устойчивостью. |
|
|
|
|
Оксид сурьмы (III) получается окислением сурьмы кислородом. |
||
|
Оксид и гидроксид сурьмы (III) – амфотерные соединения с преобладанием |
||
основных свойств: |
|
|
|
Sb2O3 |
+ 3 H2SO4 → Sb2(SO4)3 + 3 H2O; |
Sb(OH)3 |
+ 3 HCl → SbCl3 + 3 H2O; |
Sb2O3 |
+ 2 NaOH → 2 NaSbO2 + H2O; |
Sb(OH)3 |
+ NaOH → NaSbO2 + 2H2O. |
Гидроксид сурьмы Sb(OH)3 получается в виде белого осадка при действии щелочей на соли сурьмы (III): SbCl3 + 3 NaOH → Sb(OH)3↓ + 3 NaCl.
Sb(OH)3 можно рассматривать и как орто-форму сурьмянистой кислоты – H3SbO3; мета-форма – HSbO2 . Соли сурьмянистой кислоты называются антимониты.
Соли сурьмы (III) как соли слабого основания в водном растворе подвер- гаются гидролизу по катиону, с той особенностью, что конечным продуктом гид- ролиза является оксокатион:
Sb3+ + HOH SbOH2+ + H+ SbOH2+ + HOH Sb(OH)2+ + H+ Sb(OH)2+ SbO+ + H2O
SbO+ + Cl– SbOCl↓ .
При этом образуются соли, в состав которых входит антимонил-ион SbO+, напри- мер, хлорид антимонила SbOCl.
Оксид сурьмы (V) Sb2O5 обладает кислотными свойствами; ему соответст- вует сурьмяная кислота (соли – антимонаты), которую можно получить окислени- ем сурьмы концентрированной азотной кислотой:
3 Sb + 5 HNO3 → 3 HSbO3↓ + 5 NO− + H2O.
70
Соединения сурьмы (V) проявляют слабые окислительные свойства. Применение сурьмы: в типографских сплавах, полупроводниковой технике.
5.6 Висмут
Висмут в свободном состоянии – розово-белый металл. Металлический висмут не растворяется в разбавленных HCl и H2SO4, но растворяется в разбав- ленной азотной и горячей концентрированной серной кислотах:
Bi + 4 HNO3 → Bi(NO3)3 + NO− + 2 H2O
2 Bi + 6 H2SO4 → Bi2(SO4)3 + 3 SO2− + 6 H2O .
Концентрированной азотной кислотой висмут пассивируется.
Оксид висмута (III) образуется при сгорании висмута в кислороде, а также при разложении нитрата висмута. Гидроксид висмута (III) выпадает в виде белого осадка при действии щелочей на растворы солей висмута:
Bi(NO3)3 + 3 NaOH → Bi(OH)3↓ + 3 NaNO3 .
Bi2O3 и Bi(OH)3 обладают преимущественно основными свойствами и растворя- ются в кислотах с образованием солей трёхвалентного висмута. Соли висмута (III) подвергаются гидролизу по той же схеме, что и соли сурьмы (III); в результате гидролиза образуются соли висмутила, например, при гидролизе Bi(NO3)3 образу- ется BiONO3 – нитрат висмутила.
Висмутин, или гидрид висмута BiH3 очень нестоек и разлагается уже при комнатной температуре.
Действием очень сильных окислителей на соединения висмута (III) в ще- лочной среде можно получить соединения висмута (V) – висмутаты – соли не вы- деленной в свободном состоянии висмутовой кислоты HBiO3:
Bi(OH)3 + Cl2 + 3 KOH → KBiO3 + 2 KCl + 3 H2O.
Висмутаты в кислой среде – сильнейшие окислители (ϕo |
− |
, 6H+ |
/ Bi3 + , 3H |
|
> |
BiO |
2 |
O |
|||
|
3 |
|
|
|
+ 1,8 В); при этом они восстанавливаются до соединений висмута (III):
KBiO3 + 6 HCl → BiCl3 + Cl2− + 3 KCl + 3 H2O .
Область практического применения соединений висмута – медицина и вете- ринария. Металлический висмут используется, главным образом, в ядерной энер- гетике в качестве теплоносителя.
Л Е К Ц И Я 6 P-ЭЛЕМЕНТЫ IV ГРУППЫ.
6.1 Введение
Главную подгруппу IV группы образуют пять элементов: углерод, кремний, германий, олово и свинец.
Атомы рассматриваемых элементов во внешнем электронном слое содержат
