
общая и неорганическая химия
.pdf
71
четыре электрона, что описы-
вается электронной формулой ns2np2.
При переходе от угле-
рода к свинцу с увеличением радиусов атомов усиливаются металлические свойства, ко-
торые проявляются уже у германия, и если углерод и кремний являются неметал- лами, то олово и свинец – ме- таллы.
Элементы рассматри-
ваемой подгруппы могут иметь степени окисления +2 и +4, неметаллы в соединениях с менее электроотрицательными элементами – сте-
пень окисления минус 4. Степень окисления +2 для кремния и германия менее ха- рактерна, чем +4.
6.2 Углерод и его соединения
6.2.1 Свойства углерода – простого вещества
Углерод имеет не-
сколько аллотропных модификаций: алмаз, графит (кристалличе-
ские решётки алмаза и графита показаны на рисунке 6.1); карбин:
(–C≡C–C≡C–C≡C–C≡),
|
поликумулен: |
|
||
|
(=C=C=C=C=C=C=); |
|||
|
фуллерен (полые ша- |
|||
|
рообразные молекулы |
|||
Рисунок 6.1 – Аллотропные модификации уг- |
C60, C70 и др.). |
Угле- |
||
род |
проявляет |
высо- |
||
лерода: а) структура алмаза; б) структура графита. |
||||
кую |
активность |
лишь |
||
|
||||
при высоких темпера- турах и служит хорошим восстановителем, что позволяет использовать его в ме- таллургии для восстановления металлов из руд:
Cu2O + C → 2 Cu + CO; Fe2O3 + 3 C → 2 Fe + 3 CO.
Углерод образует два оксида: CO (угарный газ) и CO2 (углекислый газ).
72
6.2.2 Оксид углерода (IV). Угольная кислота и её соли
Оксид углерода (IV) – легко сжижающийся под давлением бесцветный газ. Твёрдая углекислота при атмосферном давлении и температуре минус 78,5 °C без плавления переходит в газообразное состояние.
CO2 – ангидрид слабой (K1 = 4,5×10–7 , K2 = 4,7×10–11) неустойчивой угольной кислоты H2CO3 (соли – карбонаты). Все карбонаты, кроме карбонатов щелочных металлов, при нагревании разлагаются с выделением диоксида углерода. Это свойство используется для промышленного получения углекислого газа:
CaCO3 ® CaO + CO2- (t > 1000 °C).
Углекислый газ также получается в качестве побочного продукта при горении уг- ля и органических веществ: C + O2 ® CO2 .
В лаборатории CO2 получают, действуя на мрамор соляной кислотой:
СaCO3 + 2 HCl ® CaCl2 + CO2- + H2O .
Карбонаты, за исключением карбонатов щелочных металлов и аммония, малорастворимы в воде, однако способны переходить в растворимые гидрокарбо- наты при поглощении углекислого газа:
СaCO3 + H2O + CO2 ® Сa(HCO3)2 .
Гидрокарбонаты – термически неустойчивые вещества: при нагревании они переходят в карбонаты: Сa(HCO3)2 ® СaCO3¯ + H2O + CO2- .
Одним из главных продуктов химической промышленности является сода (карбонат натрия). В настоящее время её получают аммиачно-хлоридным спосо- бом: концентрированный раствор NaCl насыщают аммиаком, после чего пропус- кают под давлением CO2. При взаимодействии аммиака, углекислого газа и воды образуется гидрокарбонат аммония:
NH3 + CO2 + H2O ® NH4HCO3 .
Образовавшийся гидрокарбонат аммония вступает в обменную реакцию с хлори-
дом натрия: NH4HCO3 + NaCl ® NH4Cl + NaHCO3 .
Гидрокарбонат натрия малорастворим в холодной воде и выделяется в виде осадка; он широко используется в пищевой промышленности под названием пить- евой (пищевой) соды. При прокаливании гидрокарбоната натрия получают
Na2CO3 – кальцинированную соду: 2 NaHCO3 ® Na2CO3 + H2O + CO2- .
Выделяющийся CO2 снова возвращается в производство, как и аммиак, который выделяют из хлорида аммония: 2 NH4Cl + Ca(OH)2 ® СaCl2 + 2 NH3- + 2 H2O . Кристаллическая сода представляет собой кристаллогидрат Na2CO3×10H2O; при прокаливании она обезвоживается.
6.2.3 Оксид углерода (II)
Оксид углерода (II) – несолеобразующий оксид; это бесцветный ядовитый газ, образуется при сгорании угля при недостатке кислорода вследствие протека-
ния реакций: C + O2 ® CO2; CO2 + C 2 CO.
Оксид углерода (II) является восстановителем, способен при высокой тем-
73
пературе восстанавливать металлы из оксидов, что используется в доменном про-
цессе: |
Fe2O3 + 3 CO → 2 Fe + 3 CO2 . |
|
Оксид углерода (II) в смеси с водородом образуется также при восстановле- |
||
нии водяного пара углём при высокой температуре: |
C + H2O → H2 + CO . |
|
При нагревании на воздухе CO сгорает голубым пламенем: 2 CO + O2 → 2 CO2 . В лабораторных условиях CO получают, отщепляя воду от муравьиной кис-
лоты нагретой серной кислотой: HCOOH → CO + H2O .
Оксид углерода (II) иногда ошибочно рассматривают как ангидрид муравьиной кислоты, однако муравьиную кислоту невозможно получить взаимодействием CO и H2O. Хотя соли муравьиной кислоты и образуются при взаимодействии CO и щелочей при 150 – 200 °C, эти реакции не являются реакциями кислотно- основного взаимодействия: NaOH + CO → HCOONa .
При ультрафиолетовом облучении или в присутствии катализатора (активи- рованный уголь) оксид углерода (II) соединяется с хлором, образуя чрезвычайно ядовитый газ фосген: CO + Сl2 → COCl2 .
Фосген относится к боевым отравляющим веществам; он используется также в производстве органических красителей.
Оксид углерода (II) может соединяться со многими металлами с образова- нием карбонилов металлов:
Fe + 5 CO → Fe(CO)5 – пентакарбонил железа; Ni + 4 CO → Ni(CO)4 – тетракарбонил никеля.
Химические связи в карбонилах образованы по донорно-акцепторному механиз- му. Ni(CO)4 – бесцветная жидкость; Fe(CO)5 – летучая жидкость жёлтого цвета. Карбонилы металлов ядовиты. При высокой температуре они разлагаются с выде- лением металла и CO, что используется для получения высокочистых металлов.
6.2.4 Карбиды Бинарные соединения углерода с металлами и другими элементами, менее
электроотрицательными, чем углерод, называются карбидами. Карбиды металлов получают прокаливанием металлов или их оксидов с углём. По отношению к воде и разбавленным кислотам карбиды можно разделить на две большие группы: раз- лагаемые этими веществами и не разлагаемые. Разлагаемые карбиды можно в свою очередь подразделить на метаниды (Al4C3) и ацетилениды (CaC2). Мета- ниды рассматривают как продукт замещения атомов водорода на металл в моле- куле метана, а ацетилениды – как продукт замещения атомов водорода в молекуле ацетилена. При взаимодействии карбидов-метанидов с водой выделяется метан:
Al4C3 + 12 HOH → 4 Al(OH)3 + 3 CH4−;
при взаимодействии воды и ацетиленидов выделяется ацетилен:
CaC2 + 2 HOH → Ca(OH)2 + C2H2− .
Существуют также карбиды, например, Mn3C, которые реагируют с водой с обра- зованием смеси различных газообразных продуктов.
74
6.2.5 Соединения углерода с азотом
При температуре электрической дуги углерод непосредственно соединяется с азотом с образованием дициана:
N2 + 2 C ® (CN)2 .
По химическим свойствам дициан имеет некоторое сходство с галогенами, на- пример, образует с водородом циановодород (синильную кислоту) HCN.
Синильная кислота – очень слабая кислота (слабее угольной), поэтому её соли – цианиды – разлагаются под действием углекислого газа и воды:
2 KCN + CO2 + H2O ® K2CO3 + 2 HCN .
Синильная кислота и цианиды – чрезвычайно ядовиты.
Важным в практическом отношении веществом является карбамид, или мо- чевина. Мочевина получается взаимодействием углекислого газа с аммиаком под давлением: CO2 + 2 NH3 ® (NH2)2CO + H2O .
Карбамид – белые кристаллы, хорошо растворимые в воде; используется в сель- ском хозяйстве как азотное удобрение и добавка к корму жвачных животных, а также в органическом синтезе для производства лекарственных препаратов.
6.3 Кремний
Кремний – один из самых распространённых в земной коре элементов. В природе кремний встречается в виде диоксида (кремнезём, песок, кварц) или в ви- де различных алюмосиликатов, например каолина (Al2O3×2SiO2×2H2O), состав- ляющего основу различных глин.
Чистый кремний – кристаллическое вещество со стальным блеском. Область применения – радиоэлектроника (полупроводниковая техника).
Свободный кремний можно получить восстановлением диоксида кремния магнием: SiO2 + 2 Mg ® 2 MgO + Si .
При высокой температуре кремний вступает во взаимодействие со многими металлами, образуя силициды. Поэтому, при нагревании SiO2 с избытком магния образуется силицид магния: SiO2 + 4 Mg ® Мg2Si + 2 MgO .
В промышленности кремний получают восстановлением диоксида кремния углём при высокой температуре: SiO2 + 2 C ® Si + 2 CO .
При другом соотношении песка и углерода получается карбид кремния SiC – кар- борунд – очень твёрдое и огнеупорное вещество, имеющее структуру алмаза:
SiO2 + 3 C ® SiC + 2 CO .
Кремний (в виде аморфного порошка) легко реагирует при нагревании с кислородом, галогенами и серой. Кислоты, за исключением смеси HNO3 и HF, на кремний не действуют:
3 Si +4 HNO3 + 18 HF ® 3 H2[SiF6] + 4 NO- + 8 H2O .
Кремний энергично взаимодействует с растворами щелочей с образованием силикатов и выделением водорода: Si + 2 KOH + H2O ® K2SiO3 + 2 H2-.
При действии кислот на силициды образуется кремневодород силан:
75
Mg2Si + 4 HCl ® 2 MgCl2 + SiH4-. SiH4 самовоспламеняется на воздухе:
SiH4 + 2 O2 ® SiO2 + 2 H2O .
Диоксид кремния – SiO2 – кислотный оксид, непосредственно с водой не взаимодействующий. Ему соответствуют слабые малорастворимые в воде крем- ниевые кислоты nSiO2×mH2O . В свободном состоянии, например, выделены ор- токремниевая кислота H4SiO4 (n = 1; m = 2) и метакремниевая (или кремниевая) кислота H2SiO3 (n = 1; m = 1). Большинство солей кремниевых кислот (силикатов) нерастворимо в воде; растворимы лишь силикаты калия и натрия; они получаются при сплавлении SiO2 со щелочами или карбонатами:
SiO2 + 2 NaOH ® Na2SiO3 + H2O;
SiO2 + K2CO3 ® K2SiO3 + CO2- .
При сплавлении смесей силикатов нескольких металлов (или смесей сили- катов металлов с диоксидом кремния) получаются аморфные (т.е. не имеющие кристаллической структуры) прозрачные сплавы, называемые стёклами.
Состав обычного оконного стекла приближённо выражается формулой Na2O×CaO×6SiO2. Исходные материалы для его получения – песок, сода и мел:
SiO2 + CaCO3 ® CaSiO3 + CO2- ;
SiO2 + Na2CO3 ® Na2SiO3 + CO2-.
Часто соду заменяют сульфатом натрия и углём:
2Na2SO4 + 2 SiO2 + C ® 2 Na2SiO3 + 2 SO2- + CO2- .
6.4Германий. Олово. Свинец
В ряду Ge – Sn – Pb отчётливо наблюдается усиление металлических свойств простых веществ.
Германий – вещество серебристо-белого цвета; по внешнему виду похож на металл, но имеет кристаллическую решётку типа алмаза (а не металлическую). Олово полиморфно: выше 13,2 °C – это серебристо-белый металл (β-модификация олова, или белое олово); при охлаждении оно переходит в α-модификацию (серое олово) со структурой типа алмаза, представляющую собой серый порошок. Сви- нец – тёмно-серый металл; имеет металлическую кристаллическую решётку.
Изменение структуры простых веществ в ряду Ge – Sn – Pb соответствует изменению их физических свойств: германий и α-олово – полупроводники, а β- олово и свинец – металлы.
В соответствии с электронным строением валентного уровня атомов для германия, олова и свинца характерны чётные степени окисления (+2 и +4); для германия устойчива высшая степень окисления +4, для свинца – степень окисле- ния +2.
Оксид германия (IV) – GeO2 – обладает преимущественно кислотными свойствами; ему соответствует германиевая кислота H2GeO3. Оксиды и гидратные формы оксидов олова и свинца (II) и (IV) – амфотерные соединения.
76
SnO, PbO, Sn(OH)2, Pb(OH)2 растворяются в кислотах с образованием катио- нов Sn2+ и Pb2+ и в растворах щелочей – с образованием гидроксокомплексов, на- пример, Na2[Sn(OH)4], Na2[Pb(OH)4]. При сплавлении оксидов и гидроксидов оло- ва и свинца (II) со щелочами образуются станниты и плюмбиты (Na2SnO2 , Na2PbO2) – соли оловянистой и свинцовистой кислот (H2SnO2, H2PbO2). В водных растворах эти соли полностью гидролизуются, образуя соответствующие гидро- ксокомплексы.
При нагревании Sn и Pb способны взаимодействовать с растворами щело-
чей: |
Э + 2 KOH + 2 H2O ® K2[Э(OH)4] + H2- . |
Германий растворяется в щелочах лишь в присутствии окислителей, напри- |
|
мер, H2O2: |
Ge + 2 KOH + 2 H2O2 ® K2GeO3 + 3 H2O . |
Гидратные формы оксидов SnO2 и PbO2 можно рассматривать как основания Sn(OH)4 и Pb(OH)4 или соответствующие кислоты (в орто- или мета-форме) – оло- вянную и свинцовую H4SnO4 , H4PbO4 , H2SnO3 , H2PbO3. Следует заметить, что эти формулы условны; на самом деле состав этих кислот неопределённый SnO2×xH2O, PbO2×xH2O. Соли оловянной и свинцовой кислот – станнаты и плюм- баты – образуются при сплавлении оксидов и гидроксидов олова и свинца (IV) со щелочами: SnO2 + 2 NaOH ® Na2SnO3+ H2O;
PbO2 + 2 NaOH ® Na2PbO3+ H2O.
Обычно при этом получаются производные от мета-формы кислоты. При взаимо- действии оксидов и гидроксидов олова и свинца (IV) с растворами щелочей обра- зуются соответствующие гидроксокомплексы типа [Э(OH)6]2– :
SnO2 |
+ 2 NaOH + 2 H2O ® Na2[Sn(OH)6]. |
||
PbO2 |
+ 2 NaOH + 2 H2O ® Na2[Pb(OH)6]. |
||
Соли Sn2+ являются восстановителями (jo 4 + |
/ Sn |
2 + = +0,15 В) и окисляются |
|
|
Sn |
|
|
до соединений Sn+4 : |
2 FeCl3 + SnCl2 ® 2 FeCl2 + SnCl4 . |
||
Напротив, соединения свинца (IV) в кислой среде являются сильными окислите-
лями (jo |
|
, 4H+ / Pb2 + , 2 H |
|
= +1,46 В) и восстанавливаются до солей свинца (II): |
PbO |
2 |
2 |
O |
|
|
|
|
PbO2 + 4 HCl ® PbCl2 + Cl2- + 2 H2O .
Различия в химической природе германия, олова и свинца особенно отчёт- ливо проявляются в их отношении к азотной кислоте. При окислении азотной ки- слотой германий образует германиевую кислоту H2GeO3:
Ge + 4 HNO3 ® H2GeO3¯ + 4 NO2- + H2O .
Аналогичным образом реагирует олово при окислении концентрированной азот-
ной кислотой: |
Sn + 4 HNO3 |
(конц.) ® H2SnO3¯ + 4 NO2- + H2O . |
В разбавленной HNO3 олово ведёт себя как металл, т.е. образует соль – нитрат |
||
олова (II): |
3 Sn + 8 HNO3 |
(разб.) ® 3 Sn(NO3)2 + 2 NO- + 4 H2O . |
77
Свинец по отношению к HNO3 любых концентраций ведёт себя как металл и об- разует при взаимодействии с нею соль Pb(NO3)2.
Германий с разбавленными кислотами типа HCl и H2SO4 не взаимодейству- ет; олово медленно растворяется в разбавленных растворах этих кислот с образо- ванием солей Sn (II). При взаимодействии олова с концентрированной H2SO4 об- разуется Sn(SO4)2. Растворение свинца в разбавленных H2SO4 и HCl тормозится образованием малорастворимых продуктов реакции PbSO4 и PbCl2 .
Л Е К Ц И Я 7 P-ЭЛЕМЕНТЫ III ГРУППЫ
7.1 Введение
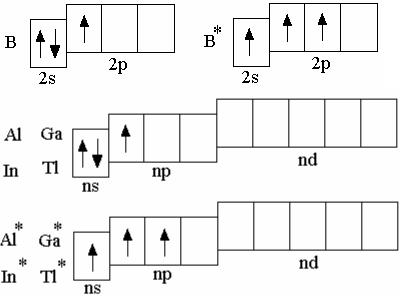
Элементы главной под- группы третьей группы – бор, алюминий, индий и таллий –
характеризуются наличием трёх электронов в наружном электронном слое атома.
Электронная конфигурация атомов в невозбуждённом со- стоянии ns2np1. Поэтому, с теоретической точки зрения,
рассматриваемые элементы могли бы в своих соединени- ях проявлять валентность I и III. Однако для всех этих эле- ментов, за исключением тал-
лия, наиболее характерно трёхвалентное состояние; таллий в соединениях может быть как трёхвалентен, так и одновалентен.
В ряду B–Al–Ga–In–Tl усиливаются металлические свойства простых ве- ществ и основные свойства оксидов и их гидратных форм. Из рассматриваемых элементов только бор является неметаллом; B2O3 является кислотным оксидом, ангидридом борной кислоты (H3BO3 – орто-форма; HBO2 – мета-форма борной кислоты).
Оксиды алюминия, галлия и индия – амфотерны, а оксиды таллия имеют основной характер.
7.2 Бор
Свободный бор представляет собой кристаллическое вещество чёрного цве- та, по твёрдости уступающее лишь алмазу. Бор можно получить в виде аморфного порошка восстановлением борного ангидрида магнием:
78
B2O3 + 3 Mg ® 2 B + 3 MgO ,
а также термическим разложением галогенидов и водородных соединений бора. Бор, как неметалл, при высокой температуре взаимодействует со многими
металлами, образуя бориды, например, Mg3B2. При действии соляной кислоты на Mg3B2 получаются различные бороводороды (бораны) B2H6 (газ), B4H10 (жид- кость), B10H14 (твёрдое вещество) и другие. Пары тетраборана (B4H10) воспламе- няются на воздухе; диборан (B2H6) более устойчив. Водой все бороводороды гид- ролизуются с образованием водорода и борной кислоты:
B2H6 + 6 H2O ® 2 H3BO3 + 6 H2 .
Для бора характерны солеобразные соединения типа Li[BH4], Na[BH4] – тет- рагидридобораты (другие названия – боргидриды, боранаты). Эти соединения по своему строению аналогичны фтороборатам Li[BF4], Na[BF4]. Водород в анионе [BH4]– имеет степень окисления минус 1, вследствие чего все боргидриды – силь- ные восстановители.
Оксид бора представляет собой бесцветную, хрупкую, стеклообразную мас- су; может быть получен непосредственным соединением бора с кислородом или прокаливанием борной кислоты. С водой борный ангидрид взаимодействует с об- разованием метаборной и ортоборной кислот.
H2O |
|
H2O |
|
B2O3 нагревание |
HBO2 |
нагревание |
H3BO3 |
При нагревании ортоборная кислота теряет воду, превращаясь в метаборную ки- слоту и далее – в оксид бора.
H3BO3 – очень слабая кислота (K1 = 6×10–10 , K2 = 2×10–13 , K3 = 2×10–14); она представляет собой белые кристаллы, растворимые в горячей воде.
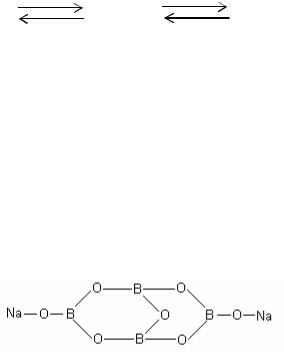
Особенностью борной кислоты является то, что при её нейтрализации рас- твором щёлочи образуется соль не ортоборной, а тетраборной кислоты H2B4O7 , являющейся представителем полиборных кислот:
4 H3BO3 + 2 NaOH ® Na2B4O7 + 7 H2O .
Соли тетраборной кислоты называются тетрабораты. Графическую формулу тет- рабората натрия можно представить следующим образом:
Десятиводный кристаллогидрат тетрабората натрия Na2B4O7×10H2O называется
бура.
При действии на раствор тетрабората натрия серной кислоты образуется ор- тоборная кислота, которая выпадает в осадок при охлаждении раствора, т.к. мало- растворима в холодной воде:
Na2B4O7 + H2SO4 + 5 H2O ® Na2SO4 + 4 H3BO3¯ .
79
Безводные метабораты можно получить сплавлением борного ангидрида
или борной кислоты с оксидами металлов: |
CaO + B2O3 |
→ Ca(BO2)2 . |
Бура в расплавленном состоянии также растворяет |
оксиды различных ме- |
|
таллов с образованием солей метаборной кислоты, из которых многие окрашены в цвета, характерные для каждого металла. Например, метабораты кобальта (II) ок-
рашены в синий цвет: Na2B4O7 + CoO → 2 NaBO2 + Co(BO2)2 .
Эти реакции применяются в качественном анализе. На этом свойстве буры осно- вано также её применение при сварке, резании и паянии металлов, в производстве легкоплавкой глазури для эмалирования различных изделий.
7.3 Алюминий
Алюминий – очень активный серебристо-белый металл. Поверхность алю- миния покрыта прочной оксидной плёнкой, которая защищает его от дальнейшего окисления. Алюминий, лишённый оксидной плёнки, способен вытеснять водород
даже из воды: 2 Al + 6 H2O → 2 Al(OH)3↓ + 3 H2− ,
но реально такие реакции протекают в щелочных средах.
Оксид алюминия Al2O3 и его гидроксид Al(OH)3 растворяются в кислотах с образованием катионов Al3+ и взаимодействуют со щелочами. При сплавлении со щелочами образуются метаалюминаты – производные метаалюминиевой кислоты:
Al2O3 + 2 KOH → 2 KAlO2 + H2O ;
при взаимодействии с раствором щёлочи образуются гидроксокомплексы
Na[Al(OH)4] или Na3[Al(OH)6]:
Al2O3 + 2 NaOH + 3 H2O → 2 Na[Al(OH)4];
Al(OH)3 + NaOH → Na[Al(OH)4];
Al(OH)3 + 3 NaOH → Na3[Al(OH)6] .
Гидроксокомплексы также образуются при окислении металлического алю- миния водными растворами щелочей:
2 Al + 2 NaOH + 6 H2O → 2 Na[Al(OH)4] + 3 H2−.
7.4 Индий. Галлий. Таллий
Индий, галлий и таллий в свободном состоянии представляют собой сереб- ристо-белые металлы с низкими температурами плавления, устойчивые к окисле- нию кислородом воздуха. Воду они не разлагают, но легко растворяются в кисло- тах, а галлий и индий – также и в щелочах, т.е. химия галлия и индия напоминает химию алюминия.
Таллий отличается тем, что для него более характерны соединения, в кото- рых его степень окисления равна +1.
Соединения таллия (I) сходны, с одной стороны, с соединениями щелочных металлов, с другой – с соединениями серебра. Так, Tl2O энергично соединяется с водой, образуя TlOH – сильное, хорошо растворимое в воде основание. Большин- ство солей таллия (I) хорошо растворимо в воде, но соли галогеноводородных ки-
80
слот, как и соответствующие соли серебра, нерастворимы и отличаются светочув- ствительностью, однако, TlF, как и AgF, хорошо растворим в воде.
Поскольку в главных подгруппах с увеличением порядкового номера эле- мента устойчивость высшей степени окисления уменьшается, соединения трёхва- лентного таллия, в отличие от всех остальных элементов подгруппы, проявляют достаточно сильные окислительные свойства, превращаясь в соединения
таллия (I): |
Tl3+ + 2 e– → Tl+ |
ϕo |
3+ |
/Tl |
+ = + 1,25 В . |
|
|
Tl |
|
|
Л Е К Ц И Я 8 S-МЕТАЛЛЫ I и II ГРУПП
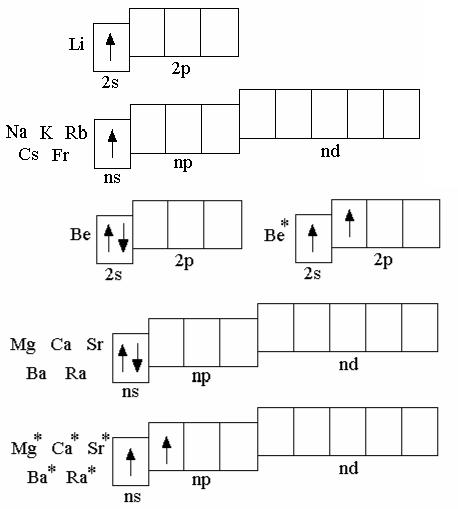
Металлы главной подгруппы первой груп- пы – литий, натрий, ка- лий, рубидий, цезий и франций – называются щелочными металлами.
Главную подгруппу второй группы образуют бериллий, магний, каль- ций, стронций барий и радий. Кальций, строн- ций и барий имеют ис-
торически сложившееся название – щелочнозе- мельные металлы. Все
эти элементы обладают ярко выраженными ме- таллическими свойст- вами; бериллий – амфо- терный металл.
На внешнем энер- гетическом уровне ато-
мов Li, Na, K, Rb, Cs, Fr
на сравнительно большом удалении от ядра находится один электрон, который атомы щелочных металлов довольно легко отдают, превращаясь в однозарядные катионы; этим объясняется очень высокая химическая активность щелочных ме- таллов. Увеличение радиусов атомов с увеличением порядкового номера элемен- тов в главной подгруппе приводит к увеличению химической активности в ряду Li
