
общая и неорганическая химия
.pdf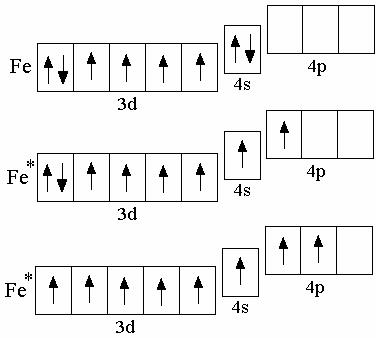
91
2 KMnO4 + 2 H2SO4 (конц.) → Mn2O7 + 2 KHSO4 + H2O .
Соединения марганца в высшей степени окисления +7, в частности перман- ганаты, являются сильными окислителями. Глубина восстановления перманганат- ионов и их окислительная активность зависит от pH среды.
В сильнокислой среде продуктом восстановления перманганатов является ион Mn2+, при этом получаются соли двухвалентного марганца:
MnO4– + 8 H+ + 5 e– → Mn2+ + 4 H2O |
(ϕo |
|
|
,8 H+ |
/ Mn2 + |
, 4 H |
|
|
= +1,51 В). |
||||||||
|
MnO− |
2 |
O |
||||||||||||||
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В нейтральной, слабощелочной или слабокислой среде в результате восста- |
|||||||||||||||||
новления перманганат-ионов образуется MnO2: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MnO4– + 2 H2O + 3 e– → MnO2↓ + 4 OH– |
(ϕo |
− |
, 2 H |
|
O / MnO |
|
, 4 OH |
− = +0,60 В). |
|||||||||
|
MnO |
4 |
2 |
2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
MnO4– + 4 H+ + 3 e– → MnO2↓ + 2 H2O |
(ϕo |
|
|
, 4 H+ |
/ MnO |
|
|
, 2 H |
|
|
= +1,69 В). |
||||||
|
MnO− |
2 |
2 |
O |
|||||||||||||
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
||||
В сильнощелочной среде перманганат-ионы восстанавливаются до манга- |
|||||||||||||||||
нат-ионов MnO42– , при этом образуются соли типа K2MnO4 , Na2MnO4: |
|||||||||||||||||
MnO4– + e– → MnO42– |
(ϕo |
|
− |
|
|
|
|
2 − |
= +0,56 В). |
||||||||
|
MnO |
/ MnO |
|
|
|
|
|
|
|
|
|||||||
|
4 |
|
4 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
9.6 Элементы триады железа |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9.6.1 Железо |
|
|
|
|
|
|
|
|
Электронная конфигу- |
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
рация |
|
|
|
|
невозбуждённого |
|||||||
|
|
|
|
|
атома железа – 3d64s2; воз- |
||||||||||||
|
|
|
|
|
буждённым |
|
|
состояниям |
|||||||||
|
|
|
|
|
атома железа соответствуют |
||||||||||||
|
|
|
|
|
электронные |
|
формулы |
||||||||||
|
|
|
|
|
3d64s14p1, |
3d54s14p2. |
|||||||||||
|
|
|
|
|
|
|
|
|
Для |
железа характер- |
|||||||
|
|
|
|
|
ны два ряда соединений: со- |
||||||||||||
|
|
|
|
|
единения железа (II) и со- |
||||||||||||
|
|
|
|
|
единения железа (III). Кроме |
||||||||||||
|
|
|
|
|
того, известны соли не вы- |
||||||||||||
|
|
|
|
|
деленной в свободном со- |
||||||||||||
|
|
|
|
|
стоянии |
|
|
железной кислоты |
|||||||||
|
|
|
|
|
H2FeO4 – ферраты, – в кото- |
||||||||||||
|
|
|
|
|
рых степень окисления же- |
||||||||||||
леза равна +6. Соединения железа в теоретически возможной высшей степени окисления +8 не получены.
Железо – активный металл, находящийся в ряду напряжений до водорода.
92
Оксид железа (II) FeO и соответствующий ему гидроксид Fe(OH)2 обладают основными свойствами; оксид железа (III) Fe2O3 проявляет слабые амфотерные свойства: при растворении в кислотах образуются соли Fe3+, а при сплавлении со щелочами образуются соли железистой кислоты – метаферриты:
Fe2O3 + 6 HCl ® 2 FeCl3 + 3 H2O; Fe2O3 + 2 NaOH ® 2 NaFeO2 + H2O .
Таким образом, соответствующую Fe2O3 гидратную форму можно рассмат- ривать и как основание Fe(OH)3, и как железистую кислоту (H3FeO3 – орто-форма, HFeO2 – мета-форма). Fe3O4 (или FeO×Fe2O3) – смешанный оксид железа (II, III); его следует рассматривать как соль железистой кислоты – метаферрит железа (II)
Fe(FeO2)2 .
Оксид железа (VI), соответствующий железной кислоте H2FeO4, не получен, как и сама кислота. Соли железной кислоты – ферраты – получаются сплавлением оксида железа (III) с окислителем (нитрат калия) в присутствии щёлочи:
Fe2O3 + 4 KOH + 3 KNO3 ® 2 K2FeO4 + 3 KNO2 + 2 H2O.
Соединения железа (II) проявляют восстановительные свойства и окисляют- ся до соединений железа (III). Например, белый гидроксид железа (II) уже в момент осаждения из растворов принимает зеленоватую окраску вследствие час- тичного окисления кислородом воздуха; затем зелёный цвет изменяется на бурый в результате полного окисления Fe(OH)2 до Fe(OH)3:
4 Fe(OH)2 + O2 + 2 H2O ® 4 Fe(OH)3 .
Соли железа (II) при действии окислителей также легко превращаются в соли же-
леза (III): 6 FeSO4 + 2 HNO3 + 3 H2SO4 ® 3 Fe2(SO4)3 + 2 NO- + 4 H2O .
Поэтому соли железа (II) получаются при растворении металлического железа в кислотах, не проявляющих сильных окислительных свойств: соляной и разбавлен-
ной серной. При растворении железа в азотной или концентрированной |
серной |
||||||||||||||
кислотах при обычных условиях или при нагревании образуются соли |
железа |
||||||||||||||
(III): 2 Fe + 6 H2SO4 ® Fe2(SO4)3 + 3 SO2- + 6 H2O; |
|
|
|
|
|
|
|
|
|||||||
|
Fe + 6 HNO3 ® Fe(NO3)3 + 3 NO2- + 3 H2O . |
|
|
|
|
||||||||||
Ионы Fe3+ проявляют заметные окислительные свойства: jo |
3+ |
/ Fe |
2+ = +0,77 В. |
||||||||||||
|
|
|
|
|
|
|
|
|
Fe |
|
|
|
|
||
Раствор FeCl3 окисляет, например, иодид-ионы (jo |
|
− = + 0,55 В ): |
|
|
|||||||||||
|
|
|
|
|
|
|
I2 / 2 I |
|
|
|
|
|
|
|
|
|
|
|
2 FeCl3 + 2 KI ® 2 FeCl2 + I2 + 2 KCl |
|
|
|
|
|
|
||||||
и металлическую медь (jo |
2+ |
/ Cu |
= + 0,34 В ): |
|
|
|
|
|
|
|
|
||||
|
|
|
Cu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 FeCl3 + Cu ® 2 FeCl2 + CuCl2 . |
|
|
|
|
|
|
||||||
Соединения |
железа |
(VI) |
– |
ферраты – |
очень |
сильные |
окислители |
||||||||
(jo |
, 4 H |
|
> + |
1,9 В); |
они восстанавливаются |
до |
соединений |
||||||||
FeO2 − ,8 H+ / Fe3 + |
2 |
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
железа (III): 2 K2FeO4 + 16 HCl ® 2 FeCl3 + 3 Cl2- + 4 KCl + 8 H2O.
Ионы Fe2+ и Fe3+ – типичные комплексообразователи. Но аммиачные ком-
93
плексы не образуются в водных растворах. Наиболее устойчивые комплексы же-
леза – цианидные. |
При действии на растворы солей железа (II) растворимых циа- |
нидов, например, |
цианистого калия, получается белый осадок цианида желе- |
за (II): |
Fe2+ + 2 CN– → Fe(CN)2↓ , |
который легко растворяется в избытке раствора цианида калия вследствие образо- вания комплексной соли – гексацианоферрата (II) калия («жёлтая кровяная соль»):
Fe(CN)2 + 4 KCN → K4[Fe(CN)6] Fe(CN)2 + 4 CN– → [Fe(CN)6]4– .
Гексацианоферрат (III) калия K3[Fe(CN)6] («красная кровяная соль») получа- ется окислением гексацианоферрата (II) калия:
2 K4[Fe(CN)6] + Cl2 → 2 K3[Fe(CN)6] + 2 KCl .
Гексацианоферрат (III) калия не удаётся получить непосредственным взаимодей- ствием соли железа (III) с цианидами из-за восстановления ионов Fe3+ цианид-
ионами: |
2 FeCl3 + 6 KCN → 2 Fe(CN)2↓ + (CN)2− + 6 KCl. |
|
Гексацианоферрат (II) калия K4[Fe(CN)6] является чувствительным реакти- |
||
вом на ионы Fe3+: |
FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6]↓ + 3 KCl; |
|
|
||
|
+3 |
+2 |
|
Fe3+ + K+ + [Fe(CN)6]4– → KFe[Fe(CN)6]↓. |
|
При этом образуется малорастворимый гексацианоферрат(II) калия-железа(III) ин- тенсивно синего цвета. Это соединение часто называют «берлинской лазурью».
Гексацианоферрат (III) калия K3[Fe(CN)6] является реактивом на ионы Fe2+: FeCl2 + K3[Fe(CN)6] → KFe[Fe(CN)6]↓ + 2 KCl;
+2 +3
Fe2+ + K+ + [Fe(CN)6]3– → KFe[Fe(CN)6]↓.
Образующийся осадок – гексацианоферрат(III) калия-железа(II) – окрашен в интенсивно синий цвет; его часто называют «турнбулевой синью».
Результаты рентгеноструктурных исследований показывают, что турнбулева синь и берлинская лазурь имеют одну и ту же кристаллическую решётку, т.е. пол- ностью идентичны и представляют собой одно и то же соединение.
При взаимодействии роданида калия (KSCN) или аммония (NH4SCN) с со- лями железа (III) образуется ряд комплексных частиц [Fe(SCN)]2+, [Fe(SCN)2]+, Fe(SCN)3, [Fe(SCN)4]–, [Fe(SCN)5]2–, [Fe(SCN)6]3–, придающих раствору кроваво-
красную окраску: |
Fe3+ + 3 SCN– → Fe(SCN)3; |
|
FeCl3 + 3 KSCN → Fe(SCN)3 + 3 KCl. |
Эта реакция также является качественной реакцией на ионы Fe3+ и применяется в аналитической химии.
9.6.2 Кобальт
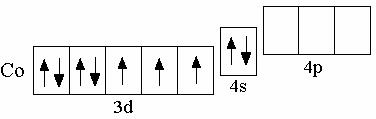
Электронная конфигурация невозбуждённого атома кобальта
94
выражается формулой 3d74s2. Наиболее характерна для кобальта степень окисле- ния +2.
Соединения кобальта в степени окисления +3 устойчивы только в комплекс- ных формах.
Соли кобальта (II) в безводном состоянии обычно синего цвета, а их водные растворы и кристаллогидраты имеют розовую окраску, характерную для акваком- плексов [Co(H2O)6]2+. Фильтровальная бумага, пропитанная раствором хлорида кобальта и затем высушенная, может служить грубым гигрометром (указателем влажности), так как в зависимости от содержания влаги в воздухе принимает раз- ные оттенки цветов – от синего до розового.
Гидроксид кобальта (II) существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли кобальта (II):
Co2+ + 2 OH– → Co(OH)2↓.
При нагревании в кипящей воде синяя модификация переходит в розовую; при прокаливании Co(OH)2 образуются серо-зелёные кристаллы оксида ко- бальта (II).
Процесс окисления 4 Co(OH)2 + O2 + 2 H2O → 4 Co(OH)3
протекает гораздо медленнее, чем аналогичное превращение Fe(OH)2 в Fe(OH)3. Однако в присутствии сильных окислителей в щелочной среде окисление гидро- ксида кобальта (II) в чёрно-бурый гидроксид кобальта (III) протекает быстро:
2 Co(OH)2 + Cl2 + 2 NaOH → 2 Co(OH)3 + 2 NaCl. |
|
||||
Катионы кобальта (III) – очень сильные окислители (ϕo |
= + 1,84 В). |
||||
|
|
|
|
Co3+ / Co2+ |
|
Они способны окислять даже воду (ϕoO |
2 |
, 4 H+ / 2 H |
2 |
O = + 1,23 В). Поэтому при дей- |
|
|
|
|
|
||
ствии на гидроксид кобальта (III) растворов кислородсодержащих кислот соли ко-
бальта (III) |
не образуются, а выделяется кислород, и получаются соли |
ко- |
бальта (II): |
4 Co(OH)3 + 4 H2SO4 → 4 CoSO4 + O2− + 10 H2O. |
|
Из соляной кислоты Co+3 выделяет хлор:
2 Co(OH)3 + 6 HCl → 2 CoCl2 + Cl2− + 6 H2O.
Степень окисления +3 стабилизируется в многочисленных комплексных со- единениях кобальта: например, ионы [Co(NH3)6]3+ в водных растворах достаточно устойчивы и воду не разлагают. Комплексные соединения кобальта +2 известны, но они менее устойчивы, чем комплексы кобальта +3. Например, амминокомп- лексы кобальта (II) легко окисляются даже молекулярным кислородом:
4 [Co(NH3)6]2+ + O2 + 2 H2O → 4 [Co(NH3)6]3+ + 4 OH– .
9.6.3 Никель
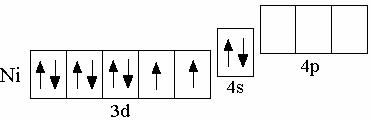
Электронная конфигурация невозбуждённого атома никеля выражается формулой 3d84s2. Соединения никеля сходны с соединениями кобальта. Как и для
95
кобальта, для никеля известны гидроксиды Ni(OH)2 и Ni(OH)3 и соответствующие им оксиды. Однако известен только один ряд солей никеля, в
которых он находится в степени окисления +2.
Водные растворы солей ни- келя окрашены в зелёный цвет;
при действии на них щелочей выпадает светло-зелёный осадок гидроксида никеля (II):
Ni2+ + 2 OH– → Ni(OH)2↓.
В отличие от гидроксидов железа (II) и кобальта (II), гидроксид никеля кислоро- дом воздуха не окисляется. Однако действием сильных окислителей в щелочной среде на Ni(OH)2 можно получить гидроксид никеля (III) чёрно-бурого цвета:
2 Ni(OH)2 + Cl2 + 2 NaOH → 2 Ni(OH)3 + 2 NaCl.
Ионы Ni3+ обладают ещё более ярко выраженной окислительной активностью, чем ионы Co3+.
Таким образом, в ряду Fe – Co – Ni отчётливо прослеживается уменьшение устойчивости степени окисления +3, и усиление окислительной активности со- единений железа, кобальта и никеля в этой степени окисления.
Ион Ni2+ – типичный комплексообразователь; известно большое число ком- плексных соединений никеля (II), окрашенных в характерные цвета (аквакомплек- сы, амминокомплексы, цианидные комплексы):
Ni2+ + 6 H2O → [Ni(H2O)6]2+ |
(зелёная окраска); |
Ni2+ + 6 NH3 → [Ni(NH3)6]2+ |
(фиолетовая окраска); |
Ni2+ + 4 CN– → [Ni(CN)4]2– |
(жёлтая окраска). |
Известны также галогенидные комплексы никеля и комплексы с органическими лигандами, например, диметилглиоксимом. Диметилглиоксим образует с ионами никеля осадок комплексного соединения красного цвета. Эта
реакция применяется в аналитической химии для обнаружения и количественного определения никеля.
Литература
1Глинка Н.Л. Общая химия. – Л.: Химия, 1987.
2Ахметов Н.С. Неорганическая химия. – М.: Высшая школа, 1975.
3Некрасов Б. В. Основы общей химии. – М.: Химия, 1974. – Т. 1 – 2.
4Суворов А.В., Никольский А.Б. Общая химия. – Л.: Химия, 1995.
5Семёнов И.Н., Перфилова И.Л. Химия. – Санкт-Петербург: Химиздат, 2000.
6Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. – М.: Мир, 1969. – Т. 1 – 3.
96
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
Конспект лекций для студентов
технологических специальностей
Часть 2. Свойства элементов и их соединений
Составитель |
Огородников Валерий Анатольевич |
Редактор |
Бажанова Т.Л. |
Технический редактор |
Щербакова А.А. |
____________________________________________________________________
Подписано в печать ______________ |
Формат 60×84 1/16 |
|
Печать офсетная. Усл. печ. л. ______ |
Уч. изд. л. _________ |
|
Тираж _____экз. _______Заказ _____ |
|
|
ЛП № 226 |
от 12.02.2003 г. |
|
ЛИ № 604 |
от 03.06.2003 г. |
|
____________________________________________________________________
Отпечатано на ризографе МГУП 212027, Могилёв, пр-т Шмидта, 3
