
общая и неорганическая химия
.pdf21
В главных подгруппах с увеличением порядковых номеров элементов уве- личиваются радиусы атомов, что связано с появлением новых, всё более удалён- ных от ядра электронных слоёв. Это приводит к уменьшению энергии ионизации атомов (см. таблицу 1.4) и, как следствие, усилению металличности. Следователь-
но, металлические свойства элементов главных подгрупп усиливаются с уве-
личением порядкового номера.
Как уже было сказано ранее, все s-элементы (кроме водорода и гелия), все d- и f-элементы являются металлами. Что же касается p-элементов, то среди них есть как металлы, так и неметаллы. Если провести диагональ от бора к астату, то окажется, что все p-элементы, находящиеся на диагонали и выше её являются неметаллами. Все p-элементы, расположенные ниже диагонали, являются метал- лами, за исключением германия (следует заметить, что в некоторых учебных по- собиях германий совершенно необоснованно относят к металлам).
Изменение свойств элементов в побочных подгруппах отличается от тех за- кономерностей, которые имеют место в главных подгруппах. В побочных под- группах при переходе от d-элемента четвёртого периода к d-элементу пятого пе- риода наблюдается несколько меньшее увеличение радиусов атомов, чем у эле- ментов главных подгрупп. Это связано с тем, что увеличение радиусов атомов за счёт возрастания числа электронных слоёв несколько компенсируется сжатием, вызванным заполнением предвнешнего 4d-подуровня у d-элементов пятого пе- риода (так называемое d-сжатие).
Увеличение же радиусов атомов, которое должно было бы наблюдаться при переходе от d-элементов пятого к d-элементам шестого периода, практически полностью скомпенсировано сжатием, вызванным заполнением третьего снаружи 4f-подуровня у f-элементов шестого периода (так называемое лантаноидное сжа- тие). Поэтому при переходе от d-элемента пятого периода к d-элементу шестого периода радиус атома практически не изменяется (см. таблицу 1.4).
Таблица 1.4 – Изменение атомных радиусов и энергий ионизации элементов
пятой группы
Элемент |
|
Радиус |
Первая |
Элемент |
|
Радиус |
Первая |
|
главной |
Заряд |
энергия |
побоч- |
Заряд |
энергия |
|||
под- |
ядра |
атома |
иониза- |
ной под- |
ядра |
атома |
иониза- |
|
(Ǻ) |
(Ǻ) |
|||||||
группы |
|
ции (эв) |
группы |
|
ции (эв) |
|||
|
|
|
|
|||||
As |
33 |
1,21 |
9,81 |
V |
23 |
1,34 |
6,74 |
|
|
|
|
|
|
|
|
|
|
Sb |
51 |
1,41 |
8,64 |
Nb |
41 |
1,46 |
6,88 |
|
|
|
|
|
|
|
|
|
|
Bi |
83 |
1,82 |
7,29 |
Ta |
73 |
1,46 |
7,88 |
|
|
|
|
|
|
|
|
|
22
Такой характер изменения радиусов атомов в побочных подгруппах при одновре- менном увеличении заряда ядра приводит, как правило, к увеличению энергии ио- низации атомов при переходе от d-элементов IV периода к d-элементам VI перио-
да (см. таблицу 1.4). В побочных подгруппах с увеличением порядкового номера
элементов наблюдается ослабление металличности.
Металличность элемента непосредственно определяет кислотно-основные свойства оксидов и гидроксидов, которые может образовывать данный элемент. Чем более металличен элемент, тем более основными свойствами обладают его оксиды и гидроксиды. Напротив, усиление неметалличности элемента приводит к усилению кислотных свойств оксидов и их гидратных форм.
Окислительно-восстановительная активность соединения определяется не только тем, в какой степени окисления – высшей, низшей или промежуточной – находится тот или иной атом в этом соединении, но и устойчивостью данной сте- пени окисления. Если некоторый атом находится в неустойчивой степени окисле- ния, то вещество, в состав которого входит этот атом, также будет неустойчивым; такое вещество будет легко вступать в реакции, в результате которых степень окисления элемента изменится на более устойчивую.
Вглавных подгруппах при переходе от p-элементов третьего периода к p-элементам шестого периода наблюдается тенденция к уменьшению устойчивости высшей степени окисления. Вследствие этого в главных подгруппах p-элементов сверху вниз усиливаются окислительные свойства соединений с
атомом в высшей степени окисления. Например, K3PO4 практически не прояв-
ляет окислительной активности в растворах; K3AsO4 проявляет слабые окисли- тельные свойства в кислой среде, а KBiO3 в кислых растворах является одним из сильнейших окислителей.
Вотличие от главных подгрупп в побочных подгруппах с увеличением порядкового номера элемента проявляется тенденция к увеличению устойчивости высшей степени окисления и ослаблению окислительной активности соединений с атомом в высшей степени окисления. Так, при растворении марган-
ца в азотной кислоте образуется нитрат марганца (II); при растворении же рения в азотной кислоте металл окисляется максимально с образованием рениевой кисло-
ты HReO4, что связано с повышенной устойчивостью высшей степени окисления атома рения. В то же время марганцовая кислота HMnO4 и её соли – пермангана- ты – проявляют в реакциях свойства сильнейших окислителей вследствие неус- тойчивости высшей степени окисления +7 атома марганца, при этом марганец по-
нижает степень окисления до более устойчивой. Рениевая же кислота HReO4 и её соли – перренаты – не имеют ярко выраженной окислительной активности.

23
1.5 Химическая связь и строение молекул
1.5.1 Механизмы образования ковалентной связи Теория строения атома явилась предпосылкой для создания теории химиче-
ской связи. В 1916 году (к этому времени уже стали известны основные черты электронной структуры атомов) немецкий учёный В. Коссель предположил, что при взаимодействии двух атомов один из них отдаёт электроны, а другой прини- мает; при этом первый атом превращается в положительно заряженный ион, а второй – в отрицательно заряженный. Электростатическое притяжение образо- вавшихся ионов приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений об ион- ной связи.
В том же 1916 году американский физико-химик Дж. Льюис высказал пред- положение, что химическая связь возникает в результате образования электронной пары, одновременно принадлежащей двум атомам. Эта идея послужила исходным пунктом для разработки современной теории ковалентной связи.
Процесс спаривания электронов при образовании молекулы водорода может быть изображён следующей схемой:
Представления о механизме образования химической связи, развитые на примере молекулы водорода, были распространены и на более сложные молеку- лы. Разработанная на этой основе теория химических связей получила название метода валентных связей (метод ВС). В основе метода валентных связей лежит рассмотренное выше положение о том, что любая ковалентная химическая связь возникает в результате взаимодействия двух электронов с противоположно на- правленными спинами, причём изначально эти электроны принадлежат различ- ным атомам, а образующаяся общая электронная пара – обоим атомам. Такой ме- ханизм образования ковалентной связи называется обменным механизмом. Именно по обменному механизму образованы химические связи в молекулах во- дорода и хлороводорода:
H + H |
H H |
H + Cl |
H Cl |
Согласно методу ВС ковалентная связь тем прочнее, чем в большей степени пере- крываются взаимодействующие электронные облака.
Таким образом, согласно методу ВС ковалентная связь является двухэлек- тронной двухцентровой связью, поскольку пара из двух электронов движется в
24
силовом поле, образованном двумя центрами – ядрами двух атомов. Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную струк-
туру молекулы, получили название валентных схем. |
|
|
Кроме обменного механизма возможен донорно-акцепторный |
|
H |
механизм образования ковалентной связи, отличие которого можно |
|
|
|
x |
|
показать на примере образования иона аммония. Атом азота в молекуле |
H |
x N |
x |
||
аммиака связан с тремя атомами водорода тремя ковалентными связя- |
|
H |
ми, образованными по обменному механизму (крестиками в формуле |
|
|
аммиака показаны электроны, изначально принадлежавшие атомам во- |
|
|
дорода). Кроме того, у атома азота есть два спаренных электрона. Такая |
|
|
пара электронов тоже может участвовать в образовании ковалентной |
|
|
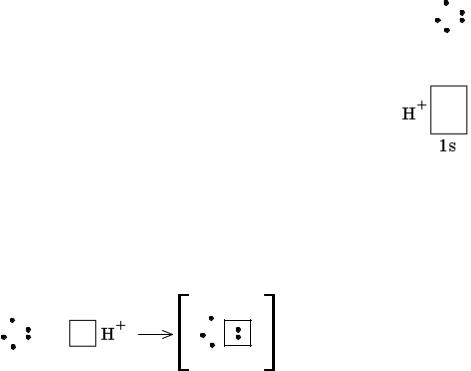
связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь. Незаполненная орбиталь есть у иона водорода. При
взаимодействии молекулы аммиака с ионом водорода ковалентная связь возника- ет вследствие того, что неподелённая пара электронов атома азота, перекрываясь со свободной орбиталью иона H+, становится общей для обоих атомов. В резуль- тате этого взаимодействия образуется ион аммония.
H |
H |
+ |
x |
x |
H |
H x N + |
H x N |
|
x |
x |
|
H |
H |
|
Следует заметить, что часто встречающийся в литературе термин «донорно- акцепторная связь» не всегда правильно интерпретируется. Важно понимать, что имеет смысл говорить лишь о донорно-акцепторном механизме образования кова- лентной связи, поскольку после образования, например, иона аммония NH4+ не- возможно определить, какая из ковалентных связей образована по донорно- акцепторному, а какая по обменному механизму. Все четыре ковалентные связи в ионе аммония между атомом азота и атомами водорода абсолютно одинаковы.
1.5.2 Направленность ковалентной связи Образование ковалентной связи, являющееся результатом перекрывания ва-
лентных электронных облаков взаимодействующих атомов, возможно только при определённой взаимной ориентации электронных облаков. При этом область пе- рекрывания располагается в определённом направлении по отношению к взаимо- действующим атомам. Иначе говоря, ковалентная связь обладает направленно- стью.
Представление о направленности ковалентных связей позволяет объяснить взаимное расположение атомов в многоатомных молекулах. Так, например, при образовании молекулы воды электронные облака двух неспаренных 2p-электронов атома кислорода перекрываются с 1s-электронными облаками двух атомов водо-

25 |
|
|
|
|
рода (рисунок 1.3 а). Поскольку p-электронные |
|
|
|
|
облака атома кислорода расположены перпен- |
z |
|
|
|
дикулярно друг к другу, то молекула H2O имеет |
|
H |
y |
|
угловое строение, причём можно было |
бы |
O |
||
предположить, что угол между связями |
O–H |
|
|
|
а) |
|
|
||
должен составлять 90°. |
|
|
|
|
Молекула аммиака, образующаяся при |
|
H |
|
|
взаимодействии трёх p-электронов атома азота |
|
|
|
|
с s-электронами трёх атомов водорода, имеет |
z |
|
x |
|
структуру пирамиды, в вершине которой нахо- |
|
|||
дится атом азота, а в основании пирамиды – |
H |
|
|
|
атомы водорода (рисунок 1.3 б). И в этом слу- |
|
|
||
|
|
|
||
чае следовало бы ожидать, что в молекуле NH3 |
|
H |
y |
|
углы между связями N–H будут равны 90°. На |
|
|||
|
|
|
||
самом же деле углы между связями (т.е. ва- |
б) |
|
|
|
лентные углы) в молекулах воды и аммиака не- |
H |
|
||
|
|
|||
сколько отличаются от 90°. Причина этого об- |
N |
|
||
|
|
|||
суждается далее. |
|
Рисунок 1.3 – Схемаxобра- |
||
Если область перекрывания электронных |
||||
облаков находится на оси, соединяющей ядра |
зования ковалентных связей: |
|||
взаимодействующих атомов (т.е. на оси связи), |
а) в молекуле воды; |
|
||
то такая ковалентная связь называется σ-связью |
б) в молекуле аммиака |
|||
(сигма-связь) (рисунок 1.4 а – в).
При взаимодействии p-электронных облаков, ориентированных перпендику- лярно оси связи, образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-связью (пи- связь) (рисунок 1.4 г).
а |
б |
в |
г |
|
Рисунок 1.4 – Образование σ- |
и π-связей: |
|
а) образование σ-связи при перекрывании двух s-электронных облаков; б) образование σ-связи при перекрывании s- и p-электронных облаков; в) образование σ-связи при перекрывании двух p-электронных облаков; г) образование π -связи при перекрывании двух p-электронных облаков
При образовании молекулы азота из атомов, три неспаренных p-электрона одного атома азота и три неспаренных p-электрона другого, образуют одну σ- и две π-связи (рисунок 1.5) .

|
26 |
N |
N |
ось связи
Рисунок 1.5 – Взаимодействие p-электронных облаков атомов азота при образовании молекулы N2
1.5.3 Гибридизация атомных орбиталей
Для объяснения отличия валентных углов в молекулах воды и аммиака от 90° необходимо учесть, что устойчивому состоянию молекулы отвечает такая её
геометрия и такое пространственное расположение электронных облаков внешних оболочек атомов, при которых потенциальная энергия соединения будет мини- мальной. Это приводит к тому, что при образовании соединения формы и взаим-
ное расположение электронных облаков атомов изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достига- ется более полное перекрывание валентных электронных облаков и, вследствие этого, образование более прочных ковалентных связей. В рамках метода валент-
ных связей такая перестройка электронной структуры атома рассматривается на основе представления о гибридизации атомных орбиталей.
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании соединения вместо исходных атомных s-, p- и d-электронных об- лаков образуются такие равноценные «смешанные» (т.е. гибридные) электронные облака, которые вытянуты по направлению к соседним атомам, вследствие чего достигается более полное перекрывание с электронными облаками этих атомов. Такое изменение электронных облаков требует затраты энергии, однако более
полное перекрывание электронных облаков взаимодействующих атомов приводит к образованию более прочных химических связей и, как следствие, к некоторому выигрышу в энергии. Если этот энергетический выигрыш достаточен, чтобы
скомпенсировать затраты энергии на деформацию исходных электронных облаков атомов, то такая гибридизация приводит к уменьшению потенциальной энергии образующейся молекулы и повышению устойчивости молекулы. Далее концепция гибридизации атомных орбиталей рассматривается на конкретных примерах обра- зования молекул BeF2 , BF3 , CH4 , SF6 .
Атом бериллия в возбуждённом состоянии имеет два неспаренных электрона, занимающих 2s- и 2p- орбитали. При перекрывании этих орбиталей с p-
электронными облаками двух атомов фтора могли бы образоваться две ковалентные связи. Так как s- и p- орбитали отличаются по форме и энергии, то образовав-
27
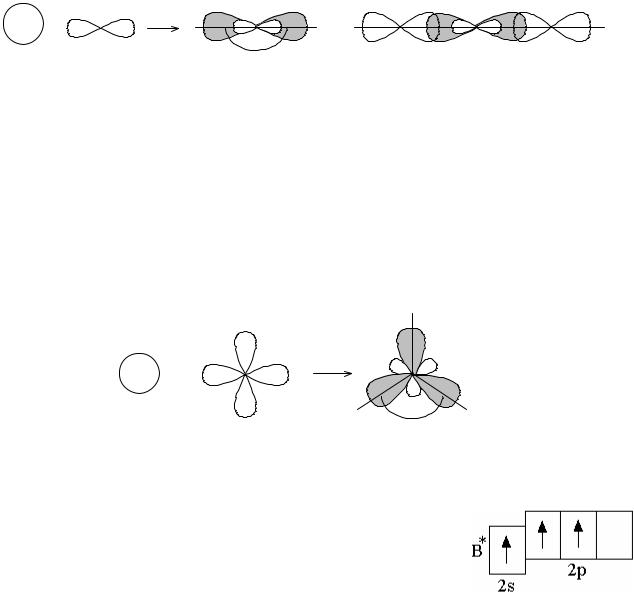
шиеся связи должны были бы быть неравноценными. Опыт же показывает, что в молекуле BeF2 обе связи равноценны. Этот факт можно объяснить с позиций тео- рии гибридизации атомных орбиталей: вместо одной s- и одной p-орбиталей атома бериллия образуются две гибридные sp-орбитали, которые расположены под уг- лом 180° друг к другу (рисунок 1.6). Образование двух sp-гибридных орбиталей из одной s- и одной p-орбиталей называется sp-гибридизацией. Перекрывание гиб- ридных sp-электронных облаков атома бериллия с p-электронными облаками ато- мов фтора приводит к образованию линейной молекулы BeF2 (рисунок 1.6).
S + |
P |
SP |
F |
Be |
F |
|
|
|
|
|
180o
Рисунок 1.6 – sp-гибридизация
Таким образом, при sp-гибридизации электронных облаков центрального атома образующаяся молекула имеет линейную конфигурацию.
Возможны и другие случаи гибридизации атомных орбиталей, причём число
образующихся гибридных орбиталей равно числу исходных атомных орбита-
лей, участвующих в гибридизации. Например, при гибридизации одной s- и двух p-орбиталей (sp2-гибридизация; читается: «эс-пэ-два») образуются три равноцен- ные sp2-орбитали. В этом случае гибридные электронные облака располагаются под углом 120° друг к другу (рисунок 1.7).
P |
2 |
S + P |
S P |
|
|
Рисунок 1.7 – sp2-гибридизация |
120o |
|
Этому типу гибридизации соответствует образование плоской треугольной молекулы. Примером такой молекулы является BF3. Исходные орбитали атома бора в возбуждён- ном состоянии (одна s- и две p-орбитали) участвуют в гиб-
ридизации с образованием трёх равноценных sp2-орбиталей. Поэтому молекула BF3 построена в форме правильного треугольника, в центре которого находится атом бора, а в вершинах располагаются атомы фтора.
Если в гибридизации участвует одна s- и три p-орбитали (sp3-гибридизация; читается: «эс-пэ-три»), то в результате образуются четыре гибридные sp3-
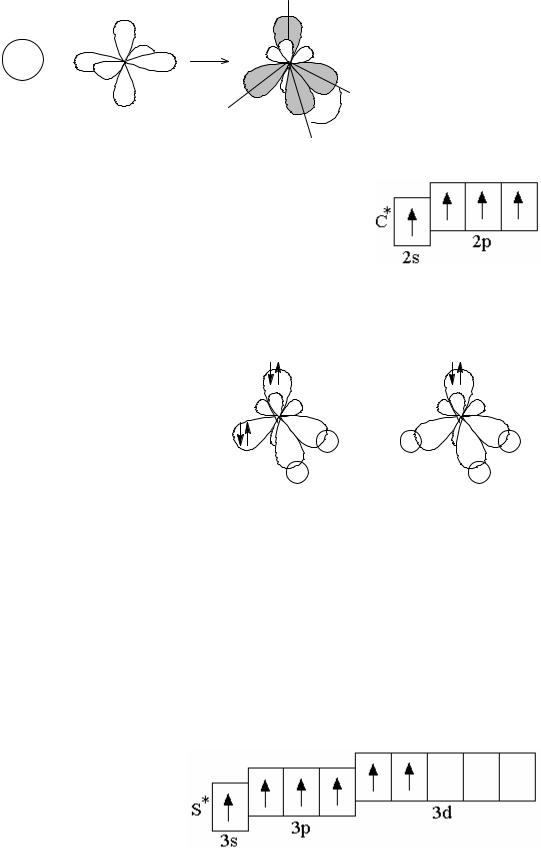
28
орбитали, вытянутые по направлению к вершинам тетраэдра, т.е. sp3-электронные облака ориентированы в пространстве под углом 109° 28´ по отношению друг к другу (рисунок 1.8).
|
|
|
P |
|
3 |
|
|
|
|
|
|
S P |
|
|
|
S |
+ |
|
P |
|
|
|
|
P |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
o |
' |
|
Рисунок 1.8 – sp3-гибридизация |
109 |
28 |
|
||||
|
|
|
|||||
Этот тип гибридизации осуществляется в возбуждён- |
|
|
|||||
ном атоме углерода при образовании молекулы CH4. По- |
|
|
|||||
этому молекула метана имеет форму тетраэдра, причём все |
|
|
|||||
четыре связи С–H |
в этой молекуле равноценны. |
|
|
||||
При образовании молекул воды и аммиака также |
|
|
|||||
происходит sp3-гибридизация электронных облаков атомов |
|
|
|||||
кислорода и азота соответственно. |
|
а) |
|
|
|||
Именно поэтому валентные углы в моле- |
|
б) |
|
||||
кулах воды и аммиака равны не 90°, а |
|
|
|
|
|||
близки к тетраэдрическим |
( HOH = |
O |
|
|
|
||
= 104,5°; HNH = 107,3°). Некоторое |
|
N |
|
||||
отличие этих углов от 109°28´ объясняет- |
|
|
|
|
|||
ся следующим образом. У |
атома кис- |
|
H |
H |
H |
||
лорода из четырёх гибридных орбиталей |
|
|
|
||||
|
H |
H |
|
||||
только две участвуют в образовании хи- |
|
|
|||||
|
Рисунок 1.9 – Схема обра- |
|
|||||
мических связей с атомами водорода, а |
|
|
|||||
две другие заняты неподелёнными па- |
|
зования химических связей: |
|
||||
рами электронов (рисунок 1.9 а). В мо- |
|
а) в молекуле воды; |
|
||||
лекуле аммиака из четырёх гибридных |
|
б) в молекуле аммиака |
|
||||
sp3-орбиталей атома азота только три участвуют в образовании химических свя- зей; одна гибридная sp3-орбиталь содержит неподелённую пару электронов (рису- нок 1.9 б). Такая асимметрия в распределении электронных облаков вокруг ядер атомов кислорода (в молекулах воды) и азота (в молекулах аммиака) приводит к наблюдаемым отклонениям валентных углов от тетраэдрических, характерных для случая sp3-гибридизации.
У элементов третьего и по- следующего периодов в образо-
вании гибридных электронных облаков могут участвовать и d- орбитали. Например, при образо-
29
вании молекулы SF6 происходит гибридизация одной s-, трёх p- и двух d- орбиталей возбуждённого атома серы (sp3d2-гибридизация).
При sp3d2-гибридизации образуются шесть равноценных гибридных орбита- лей, вытянутых к вершинам октаэдра (рисунок 1.10). Именно sp3d2-гибридизацией объясняется октаэдрическая структура молекулы SF6 .
P |
d |
3 |
2 |
S P d |
|
||
S + P |
P + d |
|
|
Рисунок 1.10 – sp3d2-гибридизация
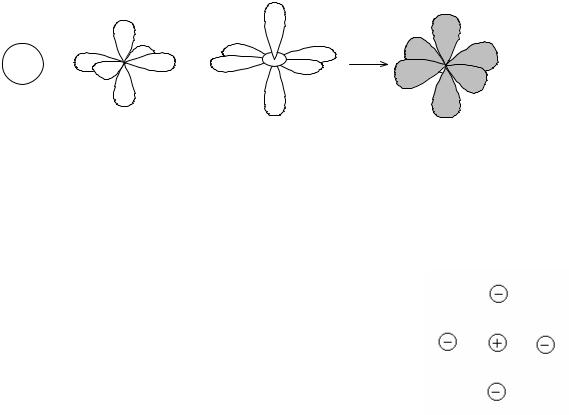
В отличие от ковалентной связи, ионная связь не обладает направленно- стью, поскольку взаимодействие между ионами осуществляется независимо от
направления (рисунок 1.11). |
|
|
Два разноимённых иона, притянувшиеся друг |
|
|
к другу, сохраняют способность электростатически |
|
|
взаимодействовать с другими ионами. В этом со- |
|
|
стоит ещё одно различие между ионным и кова- |
|
|
лентным типами связи: ионная связь не обладает |
|
|
насыщаемостью (рисунок. 1.11). Поэтому к данному |
|
|
иону может присоединиться различное число ионов |
|
|
противоположного знака. Это число определяется |
Рисунок 1.11 – Нена- |
|
размерами взаимодействующих ионов, а также тем, |
||
правленность и ненасы- |
||
что силы притяжения между противоположно за- |
||
щаемость ионной связи |
||
ряженными ионами должны преобладать над сила- |
||
|
||
ми отталкивания, действующими между одноимён- |
|
|
но заряженными ионами. |
|
1.5.4 Металлическая связь Исследования электронного строения твёрдых металлов показали, что в уз-
лах кристаллической решётки металла находятся ионы металла, а валентные элек- троны, осуществляющие химическую связь, принадлежат не двум или нескольким определённым атомам (ионам), а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объёме кристалла. Образованную подобным образом химическую связь называют металлической связью, а сово- купность свободных электронов, находящихся между узлами кристаллической решётки металла – электронным газом. Наличием электронного газа, способного свободно перемещаться по всему кристаллу металла объясняются такие характер-
30
ные для металлов свойства, как высокие электро- и теплопроводность. Пластичность металлов также объясняется специфическими свойствами ме-
таллической связи. При механическом воздействии на твёрдое тело отдельные слои его кристаллической решётки смещаются друг относительно друга. В кри- сталлах с атомной структурой в узлах кристаллической решетки находятся атомы, связанные друг с другом ковалентными связями, и такое смещение слоёв приво- дит к разрыву связей между атомами, принадлежащими различным слоям, и кри- сталл разрушается. В кристаллах с ионной структурой при взаимном смещении слоёв создаётся такое положение, при котором рядом оказываются одноимённо заряженные ионы; при этом возникают силы электростатического отталкивания, и кристалл также разрушается. В случае же металла при смещении отдельных слоёв
его кристаллической решётки происходит лишь некоторое перераспределение электронного газа, связывающего друг с другом атомы (ионы) металла, при этом разрыва химических связей не происходит, металл деформируется, не разрушаясь.
Л Е К Ц И Я 2 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
2.1 Введение
В самый ранний период развития химической науки были получены вещест- ва, которые как бы состояли из стехиометрических смесей двух или большего чис- ла соединений, каждое из которых способно к независимому существованию. Не- которые из этих соединений, например, Fe(CN)2×4KCN, AlF3×3KF, получили назва- ние «двойные соли». Другие вещества представлялись «соединениями присоеди- нения», в которых соль металла сочетается с одной или несколькими нейтральны- ми молекулами, например, молекулами аммиака. Так, ещё около 200 лет назад было установлено, что добавление водного раствора аммиака к зелёному раствору NiCl2 вызывает изменение окраски на фиолетовую; из образующегося раствора можно выделить фиолетовые кристаллы состава NiCl2×6NH3. Аналогичным обра- зом можно получить соединение CuSO4×4NH3.
Большая заслуга в установлении природы этих соединений принадлежит швейцарскому химику Альфреду Вернеру, который создал координационную тео- рию, объясняющую многие свойства комплексных (или, как их ещё называют, ко- ординационных) соединений, за что и получил Нобелевскую премию по химии.
2.2 Основные положения координационной теории
К концу XIX века накопленные экспериментальные данные свидетельство- вали о том, что можно получить пять соединений присоединения аммиака к хло-
риду платины (IV): 1) PtCl4×6NH3, 2) PtCl4×5NH3, 3) PtCl4×4NH3, 4) PtCl4×3NH3, 5) PtCl4×2NH3. Кроме того, было известно, что при добавлении избытка раствора
