
общая и неорганическая химия
.pdf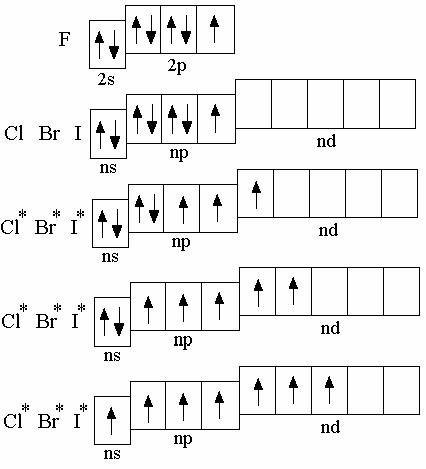
41
Л Е К Ц И Я 3 ГАЛОГЕНЫ
3.1 Введение
Входящие в главную под- группу VII группы элемен- ты фтор, хлор, бром, йод и астат называются галоге- нами. У атомов галогенов
во внешнем электронном слое по семь электронов: 2 на s-орбиталях и 5 на p- орбиталях (ns2np5). Гало- гены – типичные неметал- лы: их атомы, обладая
значительным сродством к электрону, легко присое- диняют электрон, образуя
однозарядные отрицатель-
ные ионы F–, Cl–, Br–, I–. С
повышением порядкового номера элементов в ряду F
– Cl – Br – I – At увеличи-
ваются радиусы атомов, и уменьшаются электроот- рицательность, неметал-
лические свойства и окислительная способность элементов.
В отличие от других галогенов, фтор в соединениях всегда имеет степень окисления минус 1, так как он – самый электроотрицательный элемент.
Остальные галогены могут иметь различные степени окисления от минус 1 до +7. За исключением некоторых оксидов, все степени окисления галогенов – не- чётные; это связано с тем, что и в основном, и возбуждённом состояниях атомы галогенов имеют нечётное число неспаренных электронов.
3.2 Физические свойства галогенов
При нормальных условиях фтор – газ бледно-жёлтого цвета, хлор – газ жёл- то-зелёного цвета, бром – красно-бурая жидкость, йод – кристаллическое вещест- во серого цвета. При нагревании при атмосферном давлении йод сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Молекулы простых веществ, образуе- мых атомами галогенов, двухатомны. С увеличением радиусов атомов (и размеров
42
молекул) обычно усиливается межмолекулярное взаимодействие, поэтому в ряду F2 – Cl2 – Br2 – I2 – At2 наблюдается увеличение температур плавления и кипения. В то же время, в ряду Cl2 – Br2 – I2 – At2 с увеличением радиусов атомов прочность химической связи в молекулах галогенов уменьшается.
Все галогены обладают резким запахом. Вдыхание их даже в небольших ко- личествах приводит к раздражению дыхательных путей. Значительные количества галогенов могут вызвать тяжёлое отравление.
Галогены слабо растворимы в воде. Фтор не может быть растворён в воде, так как окисляет её. В органических растворителях галогены растворимы значи- тельно лучше, чем в воде.
3.3 Химические свойства галогенов
Свободные галогены проявляют высокую химическую активность. Они вступают во взаимодействие со многими простыми веществами, проявляя в этих реакциях свойства окислителей. Например, фтор непосредственно не взаимодей- ствует только с кислородом, азотом, гелием, неоном и аргоном; хлор непосредст- венно не взаимодействует с кислородом, азотом и инертными газами. Химическая активность брома и йода меньше, чем у хлора, но всё же достаточно велика. При этом бром по активности мало уступает хлору, а йод отличается от хлора значи- тельно. Многие металлы сгорают в атмосфере хлора, образуя хлориды. Особенно бурно эта реакция протекает со щелочными и щелочноземельными металлами.
2 Na + Cl2 → 2 |
NaCl (яркая вспышка); |
Cu + Cl2 → CuCl2; |
2 Fe + 3 Cl2 → 2 FeCl3 . |
Окислительные свойства галогены проявляют также и в реакциях взаимо- действия со сложными веществами. Например, под действием хлора и брома со- единения двухвалентного железа окисляются до соединений железа (III):
2 FeCl2 + Cl2 → 2 FeCl3 .
Сера в степени окисления минус 2 обычно окисляется до свободной серы:
H2S + I2 → S + 2 HI.
Сульфиты окисляются галогенами до сульфатов, нитриты – до нитратов:
Na2SO3 + I2 + H2O → Na2SO4 |
+ 2 HI; |
KNO2 + Cl2 + H2O → KNO3 + 2 HCl. |
|
Исключительно высока химическая активность фтора. Со многими неметал- |
|||
лами он реагирует со взрывом и воспламенением. |
|
||
H2 + F2 → 2 HF; |
Si + 2 F2 → SiF4; |
S + 3 F2 → SF6. |
|
При нагревании со фтором соединяются даже некоторые инертные газы, на- |
|||
пример, ксенон: Xe + F2 → XeF2; |
Xe + 2 F2 → XeF4. |
||
Очень энергично реагирует фтор со сложными веществами. В его атмосфере |
|||
горят такие устойчивые вещества, как стекло в виде ваты и вода: |
|||
SiO2 + 2 F2 → SiF4 |
+ O2; |
2 H2O + 2 F2 → 4 HF + O2 . |
|
При этом происходит окисление связанного кислорода до простого вещества. Для фтора известно соединение с кислородом, в котором кислород имеет степень
43
окисления +2 (фторид кислорода). OF2 можно получить осторожным взаимодей- ствием фтора с водным раствором щёлочи:
2 F2 + 2 NaOH → 2 NaF + OF2 + H2O .
Окислительная активность галогенов уменьшается от фтора к астату, а вос- становительная активность галогенид-ионов в этом направлении увеличивается:
ϕo |
= +2,77 В; ϕo |
|
/ 2 Cl− |
= +1,36 В; ϕo |
|
/ 2 Br − |
= +1,09 В; ϕo |
/ 2 I− |
= +0,55 В. |
|
F / 2 F− |
Cl |
2 |
Br |
2 |
I |
2 |
|
|||
2 |
|
|
|
|
|
|
|
|||
Эта закономерность проявляется в способности более лёгких галогенов окислять галогенид-ионы более тяжёлых галогенов:
Cl2 + 2 NaI → I2 + 2 NaCl;
Br2 + 2 NaI → I2 + 2 NaBr;
Cl2 + 2 NaBr → Br2 + 2 NaCl .
Галогены также могут реагировать друг с другом с образованием бинарных соединений типа ClF, ClF3, ClF5, BrF3, BrF5, IF3, IF5, IF7, ICl, ICl3 .
3.4 Получение галогенов
В лаборатории галогены получают окислением галогенид-ионов (как прави- ло, в кислой среде) такими окислителями, как KMnO4, K2Cr2O7, PbO2, MnO2, KСlO3 и другими:MnO2 + 4 HCl (конц.) → MnCl2 + Cl2− + 2 H2O;
2 KMnO4 + 16 HCl (конц.) → 2 MnCl2 + 5 Cl2− + 2 KCl + 8 H2O
Промышленный способ получения галогенов – электролиз расплавов и рас- творов солей галогеноводородных кислот.
3.5 Водородные соединения галогенов
Галогены непосредственно соединяются с водородом, при этом фтор реаги- рует со взрывом; смесь хлора и водорода не взаимодействует в темноте, но взры- вается при ультрафиолетовом облучении. Эта реакция имеет цепной механизм.
Cl2 hν 2 Cl×
→
Cl× + H2 → HCl + H×
H× + Cl2 → HCl + Cl×
Взаимодействие брома и йода с водородом происходит лишь при нагревании; эти реакции обратимы и протекают неполностью. Образующиеся галогеноводороды
– бесцветные газообразные вещества, хорошо растворимые в воде. Их водные растворы представляют собой кислоты: HF – фтороводородная (плавиковая) кис- лота, HCl – хлороводородная (соляная) кислота, HBr – бромоводородная кислота, HI – йодоводородная кислота. С увеличением радиусов атомов галогенов умень- шается прочность связи в молекулах галогеноводородов и увеличивается сила ки- слот.
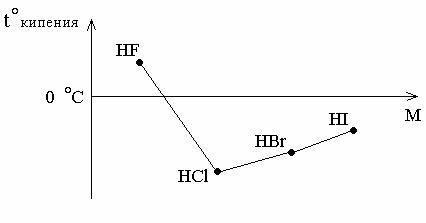
В ряду HI – HBr – HCl температуры кипения закономерно уменьшаются с
44
уменьшением молекулярных масс, а при переходе к HF наблюдается увеличение температуры кипения (рисунок 3.1).
Рисунок 3.1 – Зависимость температуры кипе-
ния галогеноводородов от молекулярной массы
Это обусловлено ассоциацией молекул фтороводорода вследствие образования между ними водородных связей. Возникновение водородных связей в первом приближении можно объяснить действием электростатического притяжения меж- ду положительно заряженным атомом водорода одной молекулы HF и отрица- тельно заряженным атомом фтора другой молекулы:
ЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧЧHδ+– Fδ–ЧЧЧЧЧ
Условием образования водородной связи является высокая электроотрицатель- ность атома, непосредственно связанного с атомом водорода. В этом случае атом
водорода практически лишён электронной оболочки и способен внедриться в электронную оболочку другого атома. Именно поэтому водородная связь харак- терна для соединений водорода с самыми электроотрицательными элементами.
Диссоциация HF требует значительной затраты энергии на разрыв водород- ных связей. Поэтому фтороводород слабо диссоциирован в водных растворах. Об- разовавшиеся при диссоциации ионы F– в значительной степени связываются во- дородными связями с недиссоциированными молекулами HF с образованием ио-
нов HF2– : |
[F–·····H–F] ® [F·····H·····F]– . |
Поэтому для плавиковой кислоты известны кислые соли, например, KHF2 .
3.6 Получение галогеноводородов
Плавиковую кислоту получают действием концентрированной серной кис- лоты на фторид кальция (плавиковый шпат), используя для этого аппаратуру из
свинца: CaF2 (твёрдый.) + H2SO4 (конц.) ® 2 HF- + CaSO4 .
Плавиковая кислота реагирует с SiO2, входящим в состав стекла, поэтому HF нельзя получать и хранить в стеклянной посуде.
SiO2 + 4 HF(газ) ® SiF4- + 2 H2O.
45
В растворе образующийся SiF4 реагирует с избытком HF с образованием гексафторокремниевой кислоты: SiO2 + 4 HF → SiF4 + 2 H2O
SiF4 + 2 HF → H2[SiF6].
Хлороводород обычно получают сульфатным или синтетическим способа-
ми.
Сульфатный способ: H2SO4 (конц.) + NaCl (твёрдый.) → NaHSO4 + HCl−; NaHSO4 + NaCl → Na2SO4 + HCl−.
Первая из этих реакций протекает при небольшом нагревании; вторая стадия про- цесса требует достаточно сильного нагревания.
Синтетический способ: H2 + Cl2 → 2 HCl .
Большие количества HCl получают в качестве побочного продукта хлориро- вания органических соединений:
RH + Cl2 → RCl + HCl;
в этой реакции R – органический радикал.
Бромоводородную и йодоводородную кислоты нельзя получить сульфатным методом, так как бромиды и иодиды окисляются концентрированной серной ки- слотой. Это связано с тем, что в ряду Сl– – Br– – I– значительно усиливаются вос- становительные свойства галогенид-ионов:
H2SO4 + 2 HBr → Br2 + SO2 + 2 H2O;
H2SO4 + 6 HI → 3 I2 + S + 4 H2O;
H2SO4 + 8 HI → 4 I2 + H2S + 4 H2O. HBr и HI получают гидролизом бромидов и иодидов фосфора:
PBr3 + 3 H2O → H3PO3 + 3 HBr; PI3 + 3 H2O → H3PO3 + 3 HI .
3.7 Кислородсодержащие соединения галогенов
Эти соединения могут быть получены только косвенным путём. Растворы HClO, HBrO, HIO очень малой концентрации получаются растворением галогенов
в воде: Э2 + HOH HЭO + HЭ .
В ряду Cl2 – Br2 – I2 равновесие этой реакции всё сильнее смещается влево.
При освещении раствора HClO хлорноватистая кислота разлагается с выде-
лением кислорода: HClO → HCl + O× ; 2 O× → O2 ;
при нагревании раствора протекает реакция диспропорционирования HClO: 3 HOCl → 2 HCl + HClO3 .
Более полно (практически полностью) реакция диспропорционирования га- логенов протекает в растворе щёлочи (например, KOH):
а) в холодном растворе образуется хлорид и гипохлорит калия:
Сl2 + 2 KOH → KClO + KCl + H2O;
б) в горячем растворе – хлорид и хлорат калия:
3 Сl2 + 6 KOH → KClO3 + 5 KCl + 3 H2O.
При действии хлора на сухой гидроксид кальция протекает реакция

46
Сl2 + Ca(OH)2 (сухой) ® Cl–O–Ca–Cl + H2O.
Соединение Cl–O–Ca–Cl (хлорид-гипохлорит кальция) представляет собой сме- шанную соль соляной и хлорноватистой кислот. Это вещество (брутто-формула CaOCl2) имеет техническое название «хлорная известь».
HClO – очень слабая кислота, которая вытесняется из солей даже угольной кислотой: 2 KClO + H2O + СO2 ® K2CO3 + 2 HClO.
KСlO3 – хлорат калия (техническое название – бертолетова соль) взрывает при детонации; при нагревании разлагается:
2 KСlO3 ® 2 KCl + 3 O2 (в присутствии катализатора MnO2); 4 KСlO3 ® 3 KСlO4 + KCl (без катализатора).
Действием серной кислоты на KСlO4 получают хлорную кислоту, при де- гидратации которой образуется оксид хлора (VII) :
H2SO4 + 2 KСlO4 ® K2SO4 + 2 HClO4;
2 HClO4 + P2O5 ® Cl2O7 + 2 HPO3 . Cl2O7 – чрезвычайно взрывчатое вещество.
Для хлора известны оксиды ClO2 – бурый взрывчатый газ, и ClO3 – красная маслянистая взрывчатая жидкость. ClO2 можно рассматривать как смешанный ан- гидрид хлорноватой и хлористой кислот:
2 ClO2 + 2 NaOH ® NaClO3 + NaClO2 + H2O;
ClO3 является смешанным ангидридом хлорноватой и хлорной кислот:
2 ClO3 + H2O ® HClO3 + HClO4 .
Бромноватую и йодноватую кислоты можно получить окислением брома и йода хлором или другими сильными окислителями:
Br2 + 5Cl2 + 6H2O ® 2 HBrO3 + 10 HCl;
3 I2 + 10 HNO3 ® 6 HIO3 + 10 NO + 2 H2O .
Окислением броматов фтором в щелочной среде можно получить перброма-
ты: NaBrO3 + F2 + 2 NaOH ® NaBrO4 + 2 NaF + H2O .
Йодная кислота выделяется из раствора в ортоформе HIO4×2H2O, т.е. H5IO6; это пятиосновная кислота. Она может быть получена окислением HIO3 на аноде:
IO3– + H2O ® IO4– + 2 H+ + 2 e– .
Изменение свойств кислородсодержащих кислот хлора можно выразить следующей схемой:
усиление кислотных свойств, повышение устойчивости
HClO |
HClO2 |
HClO3 |
HClO4 |
усиление окислительной способности
Как видно из приведённой схемы, сила кислородсодержащих кислот увели- чивается с увеличением степени окисления элемента, образующего кислоту.
Сила кислородсодержащих кислот галогенов с увеличением порядкового номера элемента ослабевает. Это объясняется тем, что при увеличении радиуса
47
атома галогена (Э) уменьшается плотность положительного заряда на атоме Э+n, что приводит к ослаблению связи Э–OH, т.е. диссоциация по типу основания уси- ливается, а по типу кислоты (ЭO–H) ослабевает. Эта закономерность справедлива и для кислородсодержащих кислот, образуемых p-элементами других групп.
3.8 Применение галогенов
Фтор и его соединения применяются для получения термоустойчивых пластмасс (тефлон), жидкостей для холодильных машин (фреоны).
Хлор используется в больших количествах для производства соляной кис- лоты синтетическим методом, хлорорганических инсектицидов, пластмасс, синте- тических волокон, хлорной извести, отбеливания тканей и бумаги, хлорирования воды в целях обеззараживания.
Соединения брома и йода используются для производства лекарственных препаратов, фотоматериалов.
Л Е К Ц И Я 4 P-ЭЛЕМЕНТЫ VI ГРУППЫ
4.1 Введение
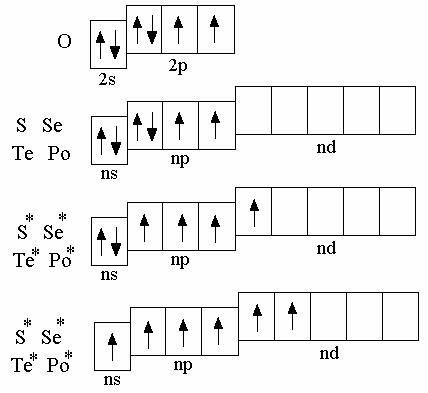
К p-элементам VI группы относятся кисло- род, сера, селен, теллур, полоний.
На внешнем элек- тронном слое атомов рас-
сматриваемых элементов находится шесть электро- нов; электронная конфи-
гурация внешнего уровня описывается формулой ns2np4. Атом кислорода отличается от атомов дру- гих p-элементов VI груп- пы отсутствием d-
подуровня на внешнем энергетическом уровне, поэтому валентность ки- слорода, как правило, рав-
на двум. Остальные элементы подгруппы могут проявлять валентность равную 2; 4; 6.
48
Все элементы данной подгруппы, кроме полония, – неметаллы. Полоний – радиоактивный металл. Кислород, сера, селен, теллур в соединениях с металлами и водородом чаще всего проявляют степень окисления минус 2, в соединениях с более электроотрицательными неметаллами степень окисления серы, селена и теллура может быть равна +4 или +6. Кислород по электроотрицательности усту- пает только фтору, поэтому положительную степень окисления (+2) он имеет только в соединении OF2. Кислород в пероксидах (H2O2, BaO2), а сера в полисуль- фидах (H2Sx, FeS2) имеют степень окисления минус 1.
Как и в подгруппе галогенов, увеличение радиусов атомов элементов в ряду O – S – Se – Te приводит к уменьшению электроотрицательности, окислительной
активности простых веществ и усилению восстановительных свойств атомов в степени окисления минус 2. Поэтому неметаллические свойства, ярко выражен- ные у кислорода, оказываются очень ослабленными у теллура.
4.2 Кислород
Кислород самый распространённый элемент земной коры. Молекула кисло- рода двухатомна (O2). Простое вещество – молекулярный кислород – представляет собой газ без цвета и запаха, плохо растворимый в воде. В атмосфере Земли со- держится 21 % (по объёму) кислорода. В природных соединениях кислород встре- чается в виде оксидов (H2O, SiO2) и солей оксокислот. Одно из важнейших при- родных соединений кислорода – вода, или оксид водорода H2O.
Помимо оксидов, кислород способен образовывать пероксиды – вещества, содержащие следующую группировку атомов: –O–O– . Один из важнейших пе- роксидов – пероксид водорода H2O2 (H–O–O–H). В пероксидах атомы кислорода имеют промежуточную степень окисления минус 1, поэтому эти соединения могут быть как окислителями, так и восстановителями:
H2O2 |
+ 2 H+ + 2 e– → 2 H2O |
ϕo |
|
O |
|
, 2H+ / 2H |
= + 1,776 В; |
||||||
|
|
H |
2 |
O |
|
||||||||
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
H2O2 |
+ 2 e– → 2 OH– |
ϕo |
|
O |
|
/ 2OH |
− |
= + 0,88 В; |
|||||
|
|
H |
2 |
|
|
|
|
|
|
||||
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
H2O2 |
→ 2 H+ + O2 + 2 e– |
ϕo |
|
, 2H+ / H |
|
O |
|
|
= + 0,682 В; |
||||
|
|
O |
2 |
|
2 |
|
|
|
|||||
|
|
|
|
|
|
2 |
|
|
|
|
|||
H2O2 |
+ 2 OH– → O2 + 2 H2O + 2 e– |
ϕo |
|
, 2 H |
O / H |
O |
|
, 2 OH |
− = – 0,076 В. |
||||
|
|
O |
2 |
2 |
|
||||||||
|
|
|
|
|
2 |
|
|
2 |
|
|
|
||
Из величин стандартных электродных потенциалов следует, что окисли- тельные свойства H2O2 наиболее сильно проявляются в кислой среде, а восстано- вительные – в щелочной. Например, пероксид водорода в кислой среде способен окислять те вещества, стандартный потенциал электрохимической системы кото- рых не превышает +1,776 В, и восстанавливать только те, у которых потенциал больше +0,682 В.
49
Пероксид водорода обладает свойствами очень слабой кислоты, но с неко- торыми основаниями он способен образовывать соли:
H2O2 + Ba(OH)2 → 2 H2O + BaO2↓ (пероксид бария).
Лабораторный способ получения пероксида водорода заключается в дейст- вии серной кислоты на пероксид бария:
BaO2 (тв.) + H2SO4 → H2O2 + BaSO4↓ .
В промышленности пероксид водорода получают гидролизом пероксоди- серной кислоты (см. раздел 4.3.6 «Мононадсерная и пероксодисерная кислоты» данной лекции).
Аллотропной модификацией кислорода является озон (O3) – газ со специфи- ческим запахом. Озон получают действием «тихих» электрических разрядов на кислород в специальных приборах – озонаторах. Реакция превращения кислорода в озон требует затраты энергии:
3O2 2O3 – 285 кДж .
Обратный процесс – распад озона – протекает самопроизвольно.
Озон – один из сильнейших окислителей; по окислительной активности он
уступает только фтору: |
|
|
|
|
|
|
|
|
|
O3 + 2 H+ + 2 e– → O2 + H2O |
ϕo |
, 2 H+ / O |
|
|
, H |
|
= + 2,07 В; |
||
|
O |
2 |
O |
||||||
|
3 |
|
|
|
2 |
|
|
||
O3 + H2O+ 2 e– → O2 + 2 OH– |
ϕo |
, H |
O / O |
|
|
, 2 OH |
− = + 1,24 В. |
||
|
O |
2 |
|
||||||
|
3 |
2 |
|
|
|
|
|
||
Он окисляет все металлы, кроме золота и платиновых металлов, а также большинство неметаллов. Он переводит низшие оксиды в высшие, а сульфиды металлов в сульфаты. Во всех окислительно-восстановительных реакциях озон, восстанавливаясь, превращается в молекулу O2:
2 KI + O3 + H2O → I2 + 2 KOH + O2 .
Промышленный способ получения кислорода – ректификация жидкого воз- духа. В лаборатории кислород получают термическим разложением перманганата
калия: 2 KMnO4 → K2MnO4 + MnO2 + O2−
или хлората калия (см. раздел 3.7 «Кислородсодержащие соединения галогенов» лекции 3). Кислород можно также получить термическим разложением нитратов щелочных металлов (см. раздел 5.2.5 «Азотная кислота и её соли» лекции 5), элек- тролизом воды и каталитическим разложением пероксида водорода:
MnO2
2 H2O2  2 H2O + O2− .
2 H2O + O2− .
4.3 Сера
4.3.1 Свойства серы – простого вещества Известны несколько аллотропных модификаций серы: ромбическая сера,
моноклинная, пластическая. При нормальных условиях сера – твёрдое жёлтое ве-
50
щество, нерастворимое в воде, хорошо растворимое в сероуглероде, бензоле и не- которых других органических растворителях. При испарении растворителя из этих растворов образуются светло-жёлтые кристаллы ромбической серы. При медлен-
ном охлаждении расплавленной серы можно получить моноклинную серу в виде длинных темно-желтых игольчатых кристаллов. Эта модификация серы устойчива лишь при температурах выше +96 °C; при более низкой температуре моноклинная сера медленно превращается в ромбическую. Молекулы и ромбической, и моно- клинной серы имеют кольцевое строение и состоят из восьми атомов (S8). Разли- чия в свойствах моноклинной и ромбической серы обусловлены различной струк- турой кристаллов.
При нагревании выше 112,8 °C сера плавится. При температурах, превы- шающих 150 – 160 °C кольцевые молекулы серы начинают разрываться, обра- зующиеся цепочки атомов соединяются в длинные цепи, вследствие чего вязкость расплава сильно увеличивается. При дальнейшем нагревании происходит разрыв и этих цепей, и вязкость расплава уменьшается. Если расплавленную серу, нагре- тую до кипения, вылить тонкой струёй в холодную воду, то образуется коричневая резиноподобная масса – пластическая модификация серы, которая через несколь- ко часов становится хрупкой, приобретает жёлтый цвет и постепенно превращает- ся в ромбическую серу.
В парах серы с увеличением температуры число атомов в молекуле посте- пенно уменьшается: S8 ® S6 ® S4 ® S2 ® S . При 800 – 1400 °C пары серы со- стоят из молекул S2, при температуре выше 1700 °C – из атомов.
Сера – типичный неметалл. Со многими металлами (Zn, Al, Fe, Cu щелоч- ные и щелочноземельные металлы) она взаимодействует непосредственно с выде- лением большого количества теплоты: 2 Al + 3 S ® Al2S3 .
4.3.2 Сероводород, сульфиды, полисульфиды При высокой температуре сера взаимодействует с водородом с образовани-
ем сероводорода (H2S) – бесцветного газа с характерным запахом гниющего бел- ка. Поскольку эта реакция обратима, то на практике сероводород обычно получа- ют действием разбавленных кислот на сульфиды металлов:
FeS + 2 HCl ® H2S- + FeCl2 .
Сероводород – сильный восстановитель; при поджигании на воздухе горит голу- боватым пламенем:
2 H2S + 3 O2 ® 2 SO2 + 2 H2O (в избытке кислорода). Поэтому смесь сероводорода с воздухом взрывоопасна. При недостатке кислорода
сероводород окисляется только до свободной серы:
2 H2S + O2 ® 2 S + 2 H2O .
Сероводород очень ядовит и способен вызвать тяжёлые отравления. Раствор сероводорода в воде обладает свойствами слабой двухосновной ки-
слоты (К1 = 6×10–8, К2 = 1×10–14). Средние соли сероводородной кислоты – сульфи-
