
- •Перечень условных обозначений
- •Введение
- •1. Методы синтеза пиразолоизохинолинов
- •2. Гликозилирование ароматических соединений
- •3. Материалы и методика исследования
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси-β-d-глюкопиранозилокси)фенил]-3-метил-5,6-диметокси-1-фенилпиразо[4,5‑c]изохинолина (75)
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси-β-d-глюкопиранозилокси-3-метокси)фенил]-5,6-диметокси-1-фенил-3-этилпиразо[4,5-c]изохинолина (77)
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси-β-d-глюкопиранозилокси)фенил]-5,6-диметокси-1-фенил-3-этилпиразо[4,5‑c]изохинолина (79)
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси-β-d-глюкопиранозилокси)фенил]-3-метил-5,6-диметокси-пиразо[4,5‑c]изохинолина (81)
- •Синтез 1-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси--d-глюкопиранозил)-3,8-диметил-5,6-диметокси-пиразо[4,5‑c]изохинолина (83)
- •4. Охрана труда и безопасность в черезвычайных ситуациях
- •4.1. Карбонат калия
- •4.2. Ацетонитрил
- •4.3. Хлороформ
- •4.4. Изопропиловый спирт
- •4.5. Ацетон
- •4.6. Бромид ртути (II)
- •4.7.Краун-эфиры
- •4.8. Электробезопасность
- •4.9. Техника безопасности при работе с персональным компьютером
- •5. Обсуждение результатов
- •Список литературы
1. Методы синтеза пиразолоизохинолинов
Формирование углерод – углеродной связи – один из важнейших процессов в синтетической органической химии. Среди разнообразных методов её образования реакция Пикте–Шпенглера является одной из ключевых реакций в синтезе гетероциклических соединений, которую интенсивно применяют для синтеза, например алкалоидов и их синтетических аналогов на протяжении последних 100 лет. Она основана на кислотно-катализируемой конденсации альдегида или кетона с 2 арил(гетарил)этиламином, ароматический фрагмент которого способен к электрофильной атаке. Последующая циклизация С-нуклеофила (гетеро) ароматического ядра и иминиевого иона приводит к образованию новой углерод – углеродной связи и образование азотсодержащего гетероцикла (схема 1).Однако, несмотря на всю привлекательность этой стратегии, её использование было ограничено только триптамином/триптофаном, гистамином/гистидином, и дофамином/тирамином как аминными субстратами, что неизменно приводит к образованию гетероциклов с базовыми структурами тетрагидро-β-карболина (ТГБК), тетрогидроимидазопиридина (ТГИ) и тетрагидроизохинолина (ТГИХ) (схема 11) [8, 9]. В настоящее время, несмотря на большое количество работ с использованием реакции Пикте-Шпенглера [10-12], стратегия синтеза осталась неизменной. Даже на твердой фазе, использование которой открыло новые возможности в химии гетероциклов, реакция Пикте-Шпенглера ограничена формированием только классических систем ТГБК, ТГИ и ТГИХ [13-17].
В последние годы эта реакция переживает второе рождение – использование так называемых субстратов Пикте-Шпенглера другого поколения дало возможность значительнее расширить круг получаемых азотсодержащих гетероциклических систем.
В основе нового подхода лежит использование для циклизации не алифатических, а ароматических и гетероциклических аминов – орто-гетарилзамещенных анилинов, орто-арил- и орто-гетарилзамещенных аминогетероциклов.
Схема 1

Можно сказать, что эти исходные соединения по структуре и глубине их превращений не могут быть прямо соотнесены к субстратам реакции Пикте-Шпенглера, и их циклизация на самом деле является новыми кислотно-катализируемыми реакциями. Использование термина «протокол Пикте-Шпенглера», включает в себя одновременно условия, направление циклизации и общее строение получаемых гетероциклов.
Исследование взаимодействия арилзамещенных аминогетероциклов, в том числе 5-амино-4-арилпиразолов, с карбонильными соединениями в условиях модифицированной реакции Пикте-Шпенглера открыло новый путь синтеза конденсированных производных изохинолина. Подавляющее большинство изохинолинов, индоло[2,3-с]-пиридинов и поликонденсированных гетероциклов на их основе получено в результате использования давно открытых и хорошо изученнных реакций – Померанца-Фрича, Бишлера-Напиральского, Пикте-Шпенглера [18].
Авторами работы [18] показаны превращения N-гетарилзамещенных 5‑аминопиразолов в условиях реакции диазотирования, а также модифицированной реакции Пикте-Шпенглера, с целью расширения возможностей разработанных ранее методов получения конденсированных азотсодержащих гетероциклов и выяснения влияния гетероциклического заместителя в положении 1 пиразольного цикла на ход реакций и строение конечных продуктов.
Хотя метод получения 5-аминопиразолов из β-кетонитрилов и гидразинов является общим и неоднократно описан, условия проведения циклизации часто зависят от свойств применяемых реагентов. Гетарилзамещенные гидразины отличаются меньшей, по сравнению с фенилгидразином, реакционной способностью, а также малой растворимостью в большинстве органических растворителей. Для получения аминопиразолов 12а-f с удовлетворительными выходами потребовалось длительное нагревание реагентов в ледяной уксусной кислоте, поскольку при проведении реакции в течение 1-2 часов выходы продуктов не превышают 20-30% (Табл. 1).Спектральные характеристики аминопиразолов 12а-f соответствуют предложенным структурам. Введение гетарильного заместителя в молекулу 5-аминопиразола приводит к увеличению их температур плавления, по сравнению с N-арилзамещенными [19, 20].
Схема 2

Таблица 1
Время и выходы замещенных N-гетарил-5-аминопиразолов 12а-f
|
№ |
R |
Het |
Время, час |
Выход,% |
|
12a |
Me |
3,5-дихлор-2-пиридил |
12 |
65 |
|
12b |
Ph |
3,5-дихлор-2-пиридил |
13 |
65 |
|
12c |
4-ClPh |
3,5-дихлор-2-пиридил |
14 |
69 |
|
12d |
Me |
бензотиазол-2-ил |
12 |
70 |
|
12e |
Ph |
бензотиазол-2-ил |
13 |
67 |
|
12f |
Me |
4,6-диметилпиримидин-2-ил |
12 |
60 |
При взаимодействии аминопиразолов 12а-f с нитритом натрия в уксусной кислоте образуются продукты реакции не ионной природы: промежуточно образующиеся соли диазония вступают в реакцию внутримолекулярного азосочетания с образованием соответствующих 3-Неt-1-R-7,8-диметоксипиразоло[3,4-c]циннолинов 14а-f. Выходы соответствующих азоло[3,4-c]циннолинов 14а-f приведены в таблице 2.
Схема 3
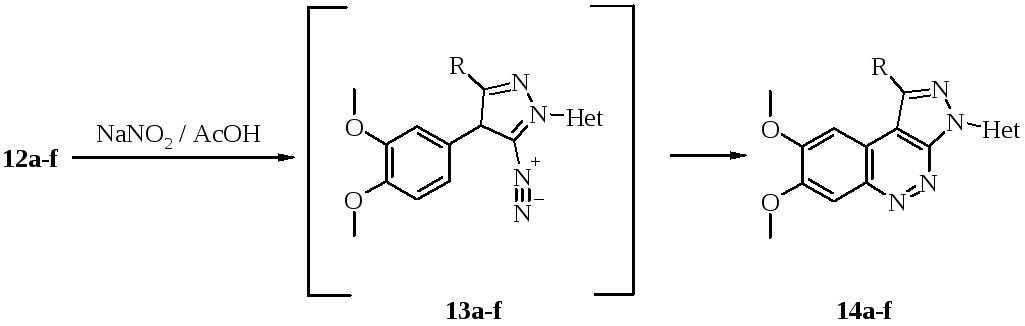
Таблица 2
Выходы 3-Неt-1-R-7,8-диметоксипиразоло[3,4-c]циннолинов 14а-f
|
№ |
R |
Het |
Выход, % |
|
14а |
Me |
3,5-дихлор-2-пиридил |
85 |
|
14b |
Ph |
3,5-дихлор-2-пиридил |
41 |
|
14c |
4-ClPh |
3,5-дихлор-2-пиридил |
31 |
|
14d |
Me |
1,3-бензтиазол-2-ил |
45 |
|
14e |
Ph |
1,3-бензтиазол-2-ил |
34 |
|
14f |
Me |
4,6-диметилпиримидин-2-ил |
62 |
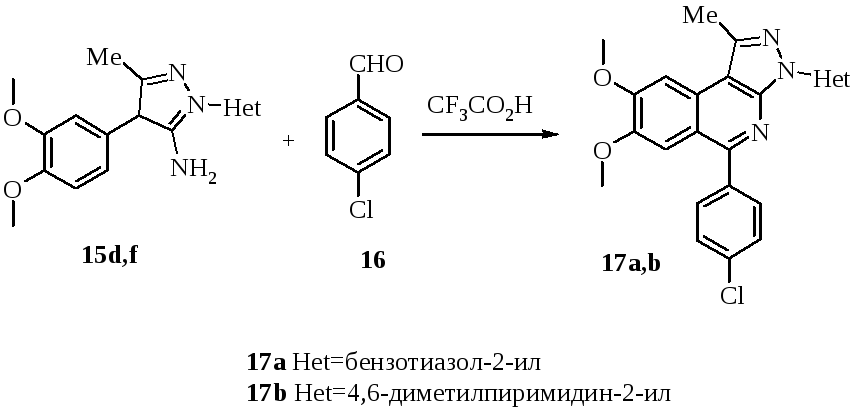
В работах [20, 21] авторами было показано, что направление реакции и возможность циклизации определяются как строением карбонильного соединения, так и природой гетероцикла. Поэтому представлялось актуальным изучить реакции N-гетарилзамещенных аминопиразолов с различными карбонильными соединениями, например с 4-хлорбензальдегидом, формальдегидом и изатином. Известно, что алканали, кетоны алифатического, алициклического и ароматического рядов не реагируют с аминопиразолами.
Взаимодействие аминопиразолов 12а, 12d и 12f с 4-хлорбензальдегидом протекает по пути окислительной циклизации, но наличие гетероциклического заместителя в положении 1 пиразольного цикла оказывает влияние на протекание реакции и строение конечных продуктов. Образование пиразоло[3,4-c]изохинолинов 17а, 17b из аминопиразолов 12d и 12f протекает с выходами 45% и 37% соответственно (схема 11). Реакционная масса частично осмоляется, что может быть связано с взаимодействием бензальдегида и аминопиразола по другому пути. Строение полученных 5-арилпиразоло[3,4-c]изохинолинов 17а, 17b подтверждено аналитическими и спектральными методами. Их протонные спектры находятся в соответствии с предполагаемой структурой и данными работы.
Схема 4
При нагревании 5-амино-1-(3,5-дихлорпирид-2-ил)-пиразола (12а) и 4-хлорбензальдегида в трифторуксусной или муравьиной кислоте в течение 10−15 часов из реакционной массы были выделены два продукта реакции. Спектральные и аналитические характеристики одного из них соответствуют ожидаемому 1-метил-7,8-диметокси-3-(3,5-дихлорпиридин-2-ил)-5-(4-хлорфенил)пиразоло[3,4-c]изохинолину (19). Данные ИК-спектроскопии и элементного анализа также подтверждают структуру 1-метил-7,8-диметокси-5-(4-хлорфенил)пиразоло[3,4-c]изохинолина (20) (схема 5).
Схема 5

Циклизации аминопиразолов 12а и 12d с параформальдегидом протекают с образованием 5-незамещенных пиразоло[3,4-c]изохинолинов 21 и 22 с невысокими выходами - около 20%.
Схема 6
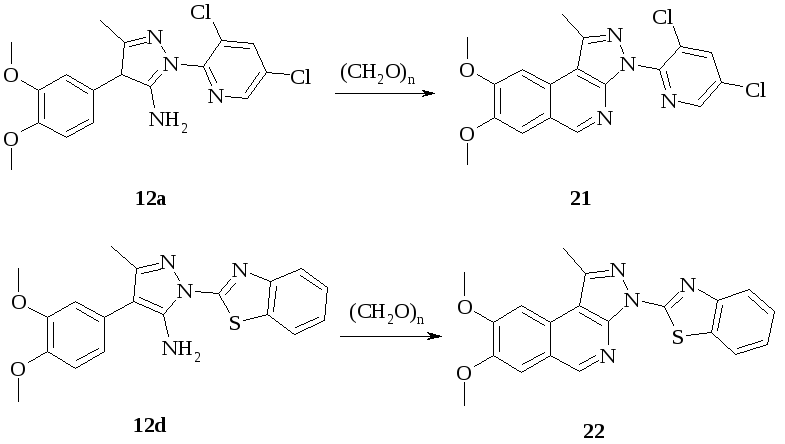
Продукты взаимодействия аминопиразола 12f с параформальдегидом не выделены. В реакции с изатином продукт циклизации 1-метил-3-(бензотиазол-2-ил)-7,8-диметокси-4,5-дигидропиразоло[3,4-c]изохинолин-5-спиро-3’-(2-оксоиндолина) (53) был получен только с аминопиразолом 12d [18] (схема 7).
Схема 7

В реакции 5-аминопиразолa 12d с параформом впервые получен 5H-пиразоло[3,4-с]изохинолин. Циклизация N-незамещенных аминопиразолов 26a‑c сопровождается метилированием атома азота пиразольного цикла. Определено, что алкилирование азота пиразольного кольца происходит перед образованием анелированного пиридинового цикла.
С другими алифатическими альдегидами и кетонами, ацетофенонами аминопиразолы не взаимодействуют и выделяются из реакции неизменными.
Схема 8

С бензальдегидами аминопиразолин реагируют с образованием ароматических 5-арилпиразоло[3,4-с]изохинолинов с выходами от 55 до 80%. Интермедиаты превращения – азометины– могут быть выделены с почти 100% выходом. Классические продукты реакции Пикте-Шпенглера – 4,5‑дигидропроизводные – в реакционных смесях не обнаружены, хотя для этого были приняты специальные усилия, в частности защита аминогруппы. Непременным условием циклизации является участие кислорода; в инертной атмосфере азометин остается неизменным.
Схема 9

Окисление азометина кислородом в контролируемых условиях показало, что максимальное поглощение кислорода составляет 2,2 моля на 1 моль азометина.
Конечный результат взаимодействия аминопиразолов с гетероциклическими альдегидами зависит от свойств альдегида и может остановиться на стадиях образования азометина, 5-гетарилпиразоло[3,4 с]изохинолина или, в случае использования индол-3 ил и тиофен-2-альдегида, 5-незамещенного пиразолоизохинолина, который образуется при отщеплении гетероциклического остатка альдегида (схема 10).
Схема 10

Использование протокола Пикте – Шпенглера для циклизации других гетероциклов не всегда дает результат. По этой методологии не получено изоксазоло[5,4-с]изохинолинов, так как в условиях реакции происходит деструкция исходных аминов.
