
- •Перечень условных обозначений
- •1. Введение
- •2. Гликозилирование ароматических соединений
- •3. Методы синтеза пиразолоизохинолинов
- •3.1 Циклизация орто-арилзамещенных аминогетаренов с карбонильными соединениями
- •3.2 Циклизация орто-арилзамещенных аминогетаренов азотистой кислотой
- •4. Материалы и методика исследования
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси--d-глюкопиранозилокси)фенил]-3-метил-5,6-диметокси-1-фенилпиразо[4,5 c]изохинолина (106)
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси--d-глюкопиранозилокси-3-метокси)фенил]-5,6-диметокси-1-фенил-3-этилпиразо[4,5 c]изохинолина (108)
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси--d-глюкопиранозилокси)фенил]-5,6-диметокси-1-фенил-3-этилпиразо[4,5 c]изохинолина (110)
- •Синтез 8-[4-(2-aцетамидо-3,4,6-три-о-ацетил-2-дезокси--d-глюкопиранозилокси)фенил]-5,6-диметокси-3-этилпиразо[4,5 c]изохинолина (112)
- •5. Охрана труда и безопасность в черезвычайных ситуациях
- •Общие правила техники безопасности:
- •5.1. Карбонат калия
- •5.2. Ацетонитрил
- •5.3. Хлороформ
- •5.4. Изопропиловый спирт
- •5.5. Ацетон
- •5.7. Электробезопасность
- •6. Обсуждение результатов
- •Выводы список литературы
СВЕДЕНИЯ О ДИПЛОМНОЙ РАБОТЕ
Дипломная работа "______" изложена на 48 страницах машинописного текста; иллюстрирована 6 таблицами, 27 схемами. Список литературных источников, упоминаемых в тексте, включает 26 работ.
Экспериментальная часть работы выполнена на кафедре органической и биологической химии ТНУ имени В.И. Вернадского в 2013-2014 годах по плану НИР кафедры.
ОГЛАВЛЕНИЕ
|
|
стр.
|
|
ПЕРЕЧЕНЬ УСЛОВНЫХ ОБОЗНАЧЕНИЙ |
4 |
|
1. ВВЕДЕНИЕ |
5 |
|
2. ГЛИКОЗИЛИРОВАНИЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ |
7 |
|
3. МЕТОДЫ СИНТЕЗА ПИРАЗОЛОИЗОХИНОЛИНОВ |
16 |
|
3.1. Циклизация орто-арилзамещенных аминогетаренов с карбонильными соединениями |
18 |
|
3.2. Циклизация орто-арилзамещенных аминогетаренов азотистой кислотой |
27 |
|
4. МАТЕРИАЛЫ И МЕТОДИКА ИССЛЕДОВАНИЯ |
30 |
|
5. ОХРАНА ТРУДА И БЕЗОПАСНОСТЬ В ЧЕРЕЗВЫЧАЙНЫХ СИТУАЦИЯХ |
34 |
|
5.1. Карбонат калия |
36 |
|
5.2. Ацетонитрил |
36 |
|
5.3. Хлороформ |
37 |
|
5.4. Изопропиловый спирт |
37 |
|
5.5. Ацетон |
38 |
|
5.6. Краун-эфир |
38 |
|
5.7. Электробезопасность |
39 |
|
6. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ |
42 |
|
ВЫВОДЫ |
44 |
|
СПИСОК ЛИТЕРАТУРЫ |
45 |
Перечень условных обозначений
ТГБК – Тетрагидро-β-карболин
ТГИ – Тетрогидроимидазопиридин
ТГИХ – Тетрагидроизохинолина
ТСХ – Тонкослойная хроматография
15К5 – 15-Краун-5
ЯМР – Ядерный магнитный резонанс
Ме – Метил
LD – Летальная доза
Ph – Фенил
1. Введение
Несмотря на значительные успехи, достигнутые в гликозидном синтезе, универсальных подходов, регио- и стереоселективно, и с высокими выходами приводящих к гликозидам определенного строения, не существует. Поэтому в химии аномерного центра центральное место занимает развитие существующих и разработка новых селективных и эффективных методов построения гликозидной связи [1].
В 60-х годах прошлого века были сформулированы основные принципы межфазного катализа [2-5]. В настоящее время можно сказать, что по широте охвата типов химических реакций катализ в двухфазных системах представляет собой уникальное явление, и широко применяется в тонком и малотоннажном органическом синтезе. Данный подход нашел широкое распространение и в химии углеводов, наряду с известными методами гликозидного синтеза [1-4]. Наряду с очевидным достоинством межфазного катализа – высокие выходы продуктов и стереоспецифичностью, следует отменить и существенные недостатки – использования избытка реагентов и водных растворов оснований, затрудняющих гликозилирование соединений, неустойчивых в этих условиях. Но, несмотря на это, межфазные каталитические процессы остаются весьма ценными в синтетической химии углеводов.
Введение углеводных остатков в молекулы биологически активных соединений или природных соединений позволяет решить ряд важных научных и практических задач. Гликозилирование антибиотиков, противоопухолевых, антивирусных препаратов модифицировало действие исходных гликозил-акцепторов по сравнению с негликозилированными аналогами. Применяемые в этих целях моно- или олигосахариды, как правило, не токсичны для организма человека и животных, что делает такой способ модификации весьма перспективным. Полученные новые флуоресцентно меченые гликопептиды оказались актуальными для изучения механизма действия гликопептидов, β-глюкуронидаз, сиалидаз и т.д.
Синтезировано большое количество как 1,2-транс-, так и 1,2-цис-гликозидов, пригодных для подобных исследований, поэтому продолжение изучения синтеза ключевых промежуточных соединений остается актуальным в настоящее время и является целью настоящей дипломной работы.
2. Гликозилирование ароматических соединений
Первые шаги в химическом синтезе гликозидов были сделаны Михаэлем (1879),Фишером (1893), Кенигсом и Кнорром (1901), Гельферихом и Олстом (1962), Лемье с сотрудниками (1975) и Паулсеном (1982) и способствовали пониманию стереоспецифичности образования O‑гликозидной связи. К методу Кенигса-Кнорра близко примыкает синтез арилгликозидов из ацилгалогеноз. Поскольку соответствующие агликоны обладают сравнительно низкой нуклеофильностью, их непосредственное использование в условиях реакции Кенигса-Кнорра приводит к низким выходам. Поэтому эти соединения вводят в конденсацию с ацилгалогенозами в виде солей. Так, гликозиды фенолов получают, конденсируя феноляты натрия или калия с ацилгалогенозами в водном ацетоне.
Первый синтез фенилглюкозида в основных условиях осуществлен американским химиком А. Михаэлем в 1879 г. взаимодействием полного ацетата α-D-глюкопиранозилхлорида 1с фенолятом натрия 2 в 96% этаноле (схема 1) [3]. Использование фенолят-анионами, в качестве нуклеофильных агентов для получения О-β-арилгликозидов сопровождается частичным дезацетилированием как исходных гликозил-доноров, так и целевых продуктов реакции, гидролизом связи С-1 – галоген, что обусловливает низкие выходы получения соответствующих гликозидов. Высокая нуклеофильность фенолят-иона позволяет проводить эту реакцию с высоким выходом и в мягких условиях, причем гидролиз ацилгалогеноз не успевает пройти в заметной степени и не может служить серьезной помехой основной реакции. Конденсация, как правило, приводит к 1,2-транс-гликозидам.
Схема 1
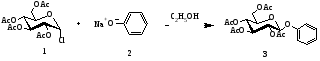
Аналогичным образом для введения в положение 1 остатков карбоновых или минеральных кислот используют конденсацию ацилгалогеноз с соответствующими ртутными или серебряными солями. В этих случаях реакцию проводят при нагревании в индифферентных растворителях. Таким путем, например, синтезируют 1-О-фосфаты альдоз. Таким образом для синтеза арилгликозидов применялись в основном два метода. Первый основан на сплавлении полных ацетатов сахаров с фенолами в присутствии различных кислотных катализаторов [6]. Второй заключается во взаимодействии фенолятов щелочных металлов с ацилгликозилбромидами или ацилгликозилхлоридами в водном ацетоне или смеси спирт-хлороформ [7]. Известны также многочисленные модификации метода Гельфериха [8].
Ни один из указанных методов не является универсальным. Наиболее общий из них, метод сплавления, применим лишь для низкоплавких монофункциональных фенолов. Второй по значению метод, основанный на использовании фенолятов, не пригоден для синтеза арилгликозидов с электронодонорными заместителями в ядре [7], а также для синтеза производных некоторых сахаров, например рамнозы [9]. Модификации метода Гельфериха не могут быть использованы в случае полифункциональных фенолов [10]. Таким образом, известные методы синтеза страдают серьезными недостатками при гликозилировании полифункциональных фенолов, несущих электронодонорные заместители, а также при распространении их на некоторые классы углеводов, типа пентоз или дезокси-гексоз.
Развитие методов межфазного катализа в этой области биоорганической химии позволило получить малодоступные другими методами производные, существенным образом повысить селективность ряда процессов и значительно увеличить выходы продуктов многих химических превращений моносахаридов.
Для качественной и количественной оценки работы ферментов, рассматриваются объекты как природного происхождения, так и синтетические. Например, агликоноподобных α-кетозидаз должны обеспечивать легкое их обнаружение с помощью спектроскопических свойств. Арильные производные N-ацетилнейраминовой кислоты оказались удобными для данных исследований. Ряд методов для стереоселективного получения α-кетозидов из N-ацетилнейраминовой кислоты, широко описаны в литературе и содержат ряд недостатков. Например, по методу Кенигса-Kнoрра получение подобных производных требовало применение дорогих катализаторов, предусматривало многостадийный процесс или продолжительный синтез, протекающий зачастую с низкими выходами. Одной из причин невысоких выходов являлась низкая растворимость образующихся солей ароматических соединений в органических растворителях. Проведение реакции в межфазных условиях позволяла исключить эти недостатки. Так, Джордж Ротермель с сотрудниками показал, что гликозилирование N‑ацетилнейраминовой кислоты в условиях межфазного катализа в системе «хлороформ-водного раствора щелочи» с применением в качестве катализатора бензилтриэтиламмоний хлорида (ТЭБАХ) позволило получить известные и новые арил-α-кетозиды с высокой стереоселективностью. Реакция протекала быстро и приводила к хорошим выходам арилпроизводных. Например, 4-метилумбеллиферил α-кетозид, являющийся стандартным субстратом нейраминидаз, в данных условиях получен с выходом 70%. Для получения 4-метилумбеллифирильного производного необходимо использование 0,1 н. раствора основания. Уменьшение и увеличение концентрации раствора щелочи приводило к протеканию побочных процессов: гидролиз гликозил-галогенида; деструкция 4-метилумбеллиферона. Авторам работы удалось синтезировать новый кетозид флуоресцеин N‑ацетилнейраминовой кислоты. Монокетозид получен с выходом 40%, тогда как метод Кенигса-Kнoрра приводил к получению гликозида с выходом ниже 10%. В условиях межфазного катализа идентифицировано образование в небольших количествах побочного продукта – биспроизводного N‑ацетилнейраминовой кислоты, выделение которого не представлял затруднений, что еще раз показывает преимущество данного подхода, в отличие от метода Кенигса-Kнoрра.
Схема 2
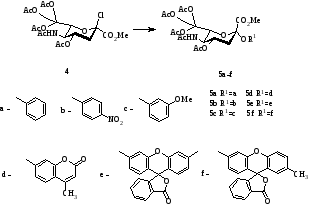
Авторами работы [1] на примере N-ацетилированных 4‑нитрофенилгликозидов была показано возможность получения соединений, потенциально являющихся хромогенными субстратами для изучения гиалуронидазы. После предварительной этерификации и ацетилированиигиалуроновой кислоты получены исходные для синтеза 4‑нитрофенилгликозидов. Гликозилирование проводилось в условиях межфазного катализа в системе «метиленхлорид – 1М раствор карбонат калия» с применением в качестве катализатора тетрабутиламмония гидросульфата (ТБАГ). Получение 4-нитрофенилглюкозида хондроитина проводили аналогичным образом. Замена 1-О-ацильного производного на метилгликозидгиалуроновой кислоты приводило к невысоким выходам 4‑нитрофенилглюкозида. Причиной этого является низкая концентрация образующего в реакционной системе α-бромида гиалуроновой кислоты.
Схема 3

Новые гидрогели, полученные с низкой молекулярной массой, в последние годы привлекают значительный интерес из-за их уникальных функций и возможностей применения. Это получение новых органических мягких материалов, матричный синтез, лекарственные препараты и применение их в методах разделения. Синтезированы подобные соединения с разными структурными фрагментами, например, включающими углеводы, аминокислоты, мочевину и холестерин. Подобные органические гели или гидрогели могут образовывать наноразмерные структуры (волокна, ленты, трубы). Ранее Шинкай и его сотрудники [9] исследовали ряд гидрогелей, состоящих из производных глюкозы. Механизм формирования самоорганизующихся структур гидрогелей широко обсуждался. Было установлено, что водородные связи между гидроксильными фрагментами сахара и амидными группами агрегата определяли общую морфологию. На основе морфологического строения гидрогелей были получены волокна и витые ленты, в то время как трубчатые структуры не образовывались. Работа ЧинуаБао с сотрудниками явилась продолжением исследований в этой области. Они показали, что подобные гидрогели могут быть получены реакцией замещенных фенилглюкозидов с первичными аминами с образованием оснований Шиффа. В таких соединениях π-π взаимодействия между основаниями Шиффа играют важную роль в образовании гидрогеля, за исключением водородных связей между гидроксильными группами. Взаимодействием ацетобромглюкозы в условиях межфазного катализа получен п‑формилглюкозид с выходом 55%. Реакция проводилась в системе хлороформ – водный раствор карбоната калия в присутствии тетрабутиламмоний бромида.
Схема 4

Авторами работы [2] было показано, что использование р‑нитрофенил-2-О-α-L-фукопиранозил-β-D-галактопиранозида в качестве субстрата позволяло обнаружить α-L-фукозидазу, имеющую специфичность к α-(1→2)-связи. р-Нитрофенил-3,4,6-три-O-ацетил-β-D-галактопиранозид получен в условиях межфазного катализа. Реакция 3,4,6-три-О-ацетил-2-O-(2,3,4-три-О-ацетил-α-L-фукопиранозил)-α-D-галактопиранозилбромид с р-нитрофеноксидом протекала в среде метиленхлорида в присутствии амберлиста А-26 с выходом продукта реакции 34%.
Схема 5
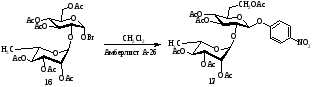
Замещенные фенилгликозиды широко используется для обнаружения ферментативного расщепления гликозидной связи. В работе [2] был получен ряд замещенных фенил-2-ацетамидо-2-дезокси-α- и β‑D‑глюкопиранозидов. Замещенные фенил-2-ацетамидо-2-дезокси-β-D-глюкопиранозиды были получены реакцией α-хлорида N‑ацетилглюкозамина с фенолятом натрия по методу Кенигса-Кнора. Взаимодействием сполна ацетилированных глюкозамина с различными фенолом в присутствии безводного хлорида цинка получены соответствующие α‑гликозиды (схема 6). Выходы α- и β-D-глюкопиранозидов приведены в таблице 1.
Схема 6
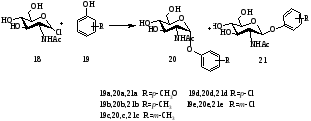
Таблица 1.
Выходы замещенных фенил 2-ацетамидо-2-дезокси-D-глюкопиранозидов
|
Заместители |
Формула |
Выход |
|
Фенил-3,4,6-три-O-ацетил-2-ацетомидо-2-диокси-α-D-глюкопиранозид | ||
|
p-CH3O |
C21H27O10N |
17 |
|
p-CH3 |
C21H27O9N |
30 |
|
m-CH3 |
C21H27O9N |
24 |
|
p-Cl |
C20H24O9NCl |
17 |
|
m-Cl |
C20H24O9NCl |
16 |
|
Фенил-3,4,6-три-O-ацетил-2-ацетомидо-2-диокси-β-D-глюкопиранозид | ||
|
p-CH3O |
C21H27O10N |
13 |
|
p-CH3 |
C21H27O9N |
27 |
|
m-CH3 |
C21H27O9N |
38 |
|
p-Cl |
C20H24O9NCl |
8 |
|
m-Cl |
C20H24O9NCl |
11 |
Ранее авторами работы синтезирован ряд гликозидов трет-бутил-4-гидрохинонас целью изучения их антиоксидантных свойств. Подобные соединения ингибируют липидное окисление. В качестве исходных гликозил-доноров рассматривались сполна ацетилированная D-глюкоза, D-галактоза и 2-дезокси-2-бутанамидоглюкопиранозилхлорид. Были изучены условия гликозилирования трет-бутил-4-гидрохинона (таблица 2). Во всех случаях реакция протекала с образованием смеси аномеров. Суммарный выход α- и β-гликозидов составил от 33 до 40%. Образование продуктов с β‑конфигурации гликозидной связи наблюдалось в большей степени (табл. 1).В качестве побочного продукта идентифицирован гликозид (24) с выходом 2% (схема). Использование трифлата иттербия (Yb(OTf)3) уменьшало время реакции, но не влияет на выход продуктов и стереоселективность реакции. Взаимодействием пентаацетата β-D-галактозы (2b) с замещенным гидрохиноном получен соответствующий β-галактозиды с выходом 40% (10:90, α/β) (табл. 2). Введение 2-дезоксисахара в молекулу двухатомного фенола стало возможным при использовании β-D-глюкопиранозилхлорида. 2-Аминогликозид гидрохинона получен с выходом 60%.
Таблица 2.
Выходы углеводных производных трет-бутилгидрохинона
|
Донор |
Условия |
Продукт |
Суммарный выход, (%) |
Соотношение α/β |
|
2a |
p-толуолсульфокислота, 1250С |
24a/24a+4 |
33+2 |
29/71 |
|
2a |
p-толуолсульфокислота, CH2Cl2 |
24a/24a |
67 |
4/96 |
|
2a |
p-толуолсульфокислота, Yb(OTf)3, CH2Cl2 |
24a |
61 |
10/90 |
|
3b |
p-толуолсульфокислота, CH2Cl2 |
24b/24b |
40 |
15/85 |
|
3c |
ZnCl2, CH2Cl2 |
24c/24c |
60 |
11/89 |
|
3b |
ZnCl2, CH2Cl2 |
24d/24d+5 |
40+13 |
5/95 |
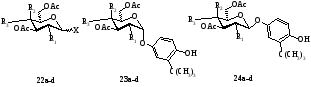
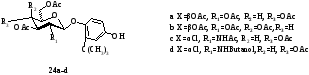
Рис. 1. Строение гликозидов трет-бутил-4-гидрохинона 22-25a-d
В работе [3] авторы показали возможность получение 4‑оксихинолин-β-гликозида. Соединения хинина известны как противомалярийные препараты. Анализ синтетических аналогов, обладающих противомалярийным действием, в настоящее время остается актуальным.
Схема 7
 Таким
образом, преимущества МФК перед обычными
органическими процессами заключаются
в следующем:
Таким
образом, преимущества МФК перед обычными
органическими процессами заключаются
в следующем:
– возможность осуществления реакций, которые не идут в иных условиях;
– проведение процессов в неполярных растворителях (химия «голых» анионов);
– изменение селективности;
– изменение соотношения региоизомеров;
– повышение выходов целевых продуктов вследствие подавления побочных процессов.
