
методичка по молекулярке
.pdf
внутрь ломаного цилиндра длиной ϑτ и радиусом основания d . Умножив число молекул в единице объема газа n на объем цилиндра, получим среднее число столкновений движущейся молекулы с неподвижной за время τ
Z ′ = nπd 2 |
|
|
(2) |
ϑτ. |
|||
В действительности все молекулы движутся. Поэтому число столкновений определяется не абсолютной (относительно стенок сосуда) средней скоростью молекулы, а средней скоростью движения молекул относительно друг к другу. С учетом этого обстоятельства среднее число столкновений молекулы за время τ оказывается равным
Z = |
2πd 2 ϑτn , |
(3) |
||
a частота столкновений |
Z |
|
|
|
ν = |
= |
2πd 2 ϑn. |
(4) |
|
|
τ |
|
|
|
Средняя длина свободного пробега равна, очевидно, средней длине прямолинейного отрезка между столкновениями, т.е. отношение длины пути, пройденного молекулой, к числу испытанных на этом пути столкновений
λ = |
ϑ |
τ |
= |
|
ϑ |
|
|
(5) |
||
Z |
Zν |
|||||||||
или |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
λ = ( 2πd 2n)−1 . |
(6) |
|||||||||
Согласно уравнению состояния идеального газа число |
молекул в единице |
|||||||||
объема газа составляет |
p |
|
|
|
|
|
|
|
||
n = |
|
, |
|
|
|
|
(7) |
|||
kT |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||
где p - давление газа; T - его абсолютная температура; |
k =1,38×10-23 Дж/К - |
|||||||||
постоянная Больцмана.
Из соотношений (6) и (7) получаем уравнение, выражающее связь эффективного диаметра молекул газа со средней длиной свободного пробега через макроскопические параметры, характеризующие состояние газа
|
kT |
|
d = |
2πλp . |
(8) |
Столкновения молекул играют решающую роль в механизме перехода газа к равновесному состоянию, так как физической причиной явлений переноса в газах (теплопроводности, вязкости, диффузии) является хаотическое движение молекул. Скорости выравнивания концентраций, температур, количества движения молекул существенно зависят от частоты столкновений молекул. Поэтому исследование явлений переноса в газах
71
дает возможность определить кинематические характеристики движения молекул.
Величины, характеризующие движение молекул и диффузию в газах, взаимосвязаны.
Для установления этой связи предположим, что плотность газа ρ
меняется в направлении ОХ (рис.3.5). |
|
|
|
|
λ |
|
|
||
Рассмотрим площадку S , перпенди- |
|
λ |
||
кулярную этому направлению. Через неё за |
|
|
|
|
время ∆t проходит масса газа, |
∆M , про- |
|
|
|
порциональная величине площадки, про- |
|
|
|
|
межутку времени ∆t и изменению плотно- |
|
|
|
|
|
∆ρ |
|
|
|
сти в расчете на единицу длины |
: |
|
|
|
|
∆x |
|
|
|
∆М = −D ∆ρ S∆t . |
(9) |
|
|
|
|
|
∆x |
|
|
|
|
|
|
Коэффициент D носит название |
ко- |
0 |
|
|
X |
|
|
|
|
|
|
||
эффициента диффузии. Он численно ра- |
|
|
Рис. 3.5. |
|
||
вен массе газа, проходящей через единицу |
|
|
|
|
|
|
|
|
|
|
|
||
площади за единицу времени при градиенте плотности, равном единице.
Знак минус поставлен для того, чтобы D было положительным ( ∆M и |
||
|
∆ρ |
разных знаков). |
|
|
|
|
∆x |
|
|
|
Проведем вычисление коэффициента диффузии. Выберем элементы |
объема толщиною ϑ∆t на расстояниях λ слева и справа от площадки S . Масса ∆M , проходящая за время ∆t через площадку S , равна разности масс ∆М1 и ∆М2 , проходивших через неё слева и справа. Если плотности
газа в левом и правом объёме равны соответственно ρ1 = n1m, ρ2 = n2m, то, очевидно,
∆M1 = 16 n1mSϑ∆t = 16 ρ1Sϑ∆t, ∆M1 = 16 n2mSϑ∆t = 16 ρ2 Sϑ∆t,
∆M = ∆M1 −∆M 2 = 16 (ρ1 −ρ2 )Sϑ∆t .
Здесь n1, n2 - концентрации молекул газа слева и справа от площадки S .Но
ρ1 −ρ2 = −(ρ2 −ρ1 ) = − ∆∆ρx 2λ.
Поэтому
∆M = − |
1 |
|
|
|
∆ρ S∆t. |
(10) |
λϑ |
|
|||||
|
3 |
|
|
|
∆t |
|
72
Сравнивая (9) и (10), находим, что коэффициент диффузии равен
D = |
1 |
|
|
. |
(11) |
λϑ |
|||||
|
3 |
|
|
|
|
Средняя скорость ϑ беспорядочного движения молекул для различных газов обратно пропорциональна корню из молекулярного веса. Поэтому, если сравнить при данных давления и температуре различные газы, обладающие примерно одинаковой средней длиной свободного пробега молекул, коэффициент диффузии их по (11) будет больше для легкого газа.
Экспериментальная установка
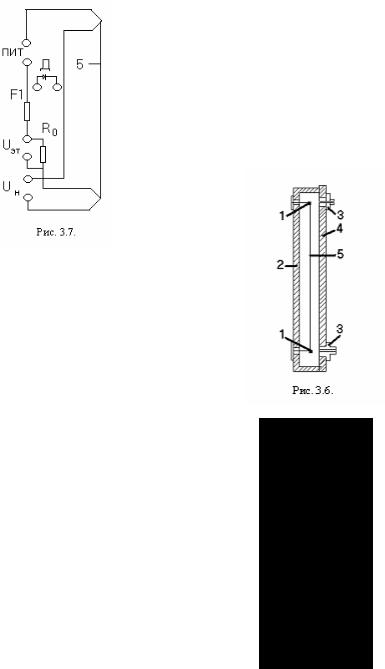
В работе используется блок N:1 "СВОЙСТВА ГАЗОВ" и модуль 06 (Рис. 3.6), который предназначен для измерения теплопроводности воздуха и других газов методом нагрева нити, а также для оценки коэффициентов диффузии газов в воздухе по изменению теплопроводности. Узел размещен на панели 4. Металлическая нить 5 (сплав на основе никеля) натянута между стойками 1 по оси цилиндрического канала в корпусе 2. Канал закрыт пробками 3. В корпус ввернут
датчик температуры Д.
На рис.3.7 показана схема соединений. Нить подключена к гнездам “Uн” на панели модуля. Последовательно с нитью включен резистор R0 , подключенный
к гнездам “Uэт”. Источник питания подключают к гнездам “ПИТ”. Измерив напряжение на нити и на резисторе R0 , определяют сопротивление нити и выделяющую-
ся в ней тепловую мощность. Схема построена так, что сопротивление подводящих питание проводников не вносит погрешности в результаты (использован так называемый четырехзондовый метод измерения сопротивления). По сопротивлению нити определяют её температуру. Убедившись, что разность температур нити и корпуса пропорциональна тепловой мощности, находят теплопроводность газа.
Диаметр нити d = 0,1мм, эффективный диаметр канала D =12 мм, длина нити L = 240 мм, сопротивление нити R = 2,5...3,5 Ом, температурный коэффициент сопротивления нити (при 00С) α = 5,6 10−3 град−1 , сопротивление эталонного резистора R0 =10 Ом. Максимальный ток в нити 0,5 А, максимальная мощность 1Вт.
73
Методика определения коэффициента диффузии газа в воздухе
Методика определения коэффициента диффузии газа в воздухе заключается в исследовании закономерностей выхода исследуемого газа из вертикального канала и замещении его воздухом.
Распределение концентрации по длине канала описывается одномерным уравнением диффузии. Решение его при соответствующих граничных условиях, удовлетворяющих диффузии газа из вертикального канала, показывает, что после кратковременного начального периода средняя (по длине канала) теплопроводность χ смеси газов в канале будет приближаться
к теплопроводности χ0 воздуха по экспоненте
|
χ−χ0 |
|
= сonst exp(− |
t |
) |
|
|
|
|||||
|
||||||
с характерным временем |
|
|
τ |
|||
|
|
|
|
|||
τ = 4 |
L2 |
|
≈ 0,4 |
L2 |
, |
(12) |
||||
π2 D |
D |
|||||||||
|
|
|
|
|
||||||
где L - длина канала, D -коэффициент диффузии. Для определения τ нуж- |
||||||||||
но построить график зависимости |
ln( |
|
χ−χ0 |
|
) |
от времени, выделить на нем |
||||
|
|
|||||||||
линейный участок и определить на этом участке угловой коэффициент графика. В опыте необходимо контролировать температуру Tk стенок ка-
нала, так как при длительных измерениях корпус модуля нагревается. Для измерения χ0 нужно на 5-10с открыть вторую пробку и дать газу вы-
течь, затем закрыть пробку и ещё раз измерить теплопроводность.
Порядок выполнения работы:
1.Установите блок N:1 "СВОЙСТВА ГАЗОВ" в рабочей зоне каркаса.
2.Согласно схеме, приведенной на рис. 3.7, подключите модуль 06 (гнезда "ПИТ") к источнику питания (гнезда "НАГР" и "ОБЩ" ИСТ -3)
3.Заполните канал газом.
1.Установите ток 200-300 мА.
2.Определить комнатную температуру T1 .
3.Подготовить мультиметр для измерения напряжений. С этой целью выбрать пределы измерений мультиметра так, чтобы показания имели не менее 3 значащих цифр.
4.Мультиметром измерить напряжение U0 на эталонном резисторе R0 (гнезда “U0 ”).
5.Мультиметром измерить напряжение Uн на нити (гнезда “Uн ”).
6.Выверните одну из пробок: верхнюю, если газ тяжелее воздуха, или нижнюю, если газ легче воздуха. При этом газ не будет " вытекать " из канала и будет выходить лишь вследствие диффузии. От момента удаления пробки начинается отсчет времени.
74
7.Необходимо контролировать температуру Tk стенок канала (при длительных измерениях корпус модуля нагревается).
8.Исследуйте зависимость сопротивления нити от времени при постоянном напряжении на выходе источника питания. С этой целью измерьте через 1; 2; 5; 10; 15; 20 и 30 мин U0 , Uн и Tk и занесите в таблицу. По
формуле I = U0 вычислите значение силы тока (в таблице 3.5 Uн =U ).
R0
Таблица 3.5.Результаты эксперимента
|
|
t , мин |
|
0 |
1 |
2 |
5 |
10 |
|
15 |
20 |
30 |
|
χ0 , Вт/м К |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U0 , мВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
U , мВ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I , мА |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
W , Вт |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R , Ом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tk , 0С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T , 0С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T −Tk , 0С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
χ, Вт/м К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln( |
|
χ−χ0 |
|
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9. |
По формуле |
R1 = R0 |
U |
вычислите сопротивление нити при комнатной |
||||||||||||||||||||
|
||||||||||||||||||||||||
|
температуре. |
|
|
U0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
10. Вычислить сопротивление |
R при искомой температуре T . |
|
|
|
|
|||||||||||||||||||
11. |
Вычислить искомую температуру |
T по формуле |
Т =Т1 + |
R − R1 |
× |
1+αT1 |
, |
|||||||||||||||||
R |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
α |
|
|
1
где α = 5,6 10−3 град−1 . 12. Определить Т −Тк
75
13.Вычислить мощность нагревания нити W = I 2 R .
14.Теплопроводность газа определяют по формуле
|
ln |
D |
|
|
|
|
|
||
χ =W |
d |
|
|
. |
(13) |
||||
|
|
|
|
|
|||||
2π(T −T )L |
|||||||||
15. Построить график зависимости ln( |
|
|
|
k |
|
) |
от времени, выделить на нем |
||
|
χ−χ0 |
|
|||||||
|
|
||||||||
линейный участок и определить на этом участке угловой коэффициент графика.
16.Для измерения χ0 нужно на 5-10с открыть вторую пробку и дать газу вытечь, затем закрыть пробку и ещё раз измерить U0 , Uн и Tk , вычислить по вышеуказанным формулам I , R1 , R , T , T −Tk , W и теплопроводность воздуха χ0 по формуле (13) .
17.По графику определить τ. Оно равно времени, соответствующему пересечению построенной кривой с осью абсцисс.
18.Используя формулу (12), вычислить коэффициент диффузии D для исследуемого газа.
19.Обработать результаты измерений согласно теории ошибок.
20.В выводах сравнить результаты экспериментальных исследований D для исследуемого газа с табличными значениями.
76
ЛАБОРАТОРНАЯ РАБОТА № 5
КРИВАЯ ФАЗОВОГО РАВНОВЕСИЯ ВОДЫ
Цели работы:
1.Изучение основ физики фазовых переходов.
2.Экспериментальное определение теплоты испарения жидкости.
Теория метода
Фазой называется макроскопическая физически однородная часть вещества, отделенная от остальных частей системы границами раздела, так что она может быть извлечена из системы механическим путем.
Допустим, например, что в закрытом сосуде заключена некоторая масса воды, над которой находится смесь воздуха с водяными парами. Эта система является двухфазной. Она состоит из двух фаз: жидкой (вода) и газообразной (смесь воздуха с водяными парами). Если бы воздуха не было, то в системе также было бы две фазы: жидкая (вода) и газообразная (водяные пары). Бросим в воду кусочки льда. Система превратится в
трехфазную. И будет состоять из твердой фазы (лед), жидкой (вода) и
газообразной (смесь воздуха с водяными парами). Добавим к воде некоторое количество спирта. Число фаз не изменится, так как вода смешивается со спиртом, образуя физически однородную жидкость. Однако если к воде добавить ртуть, то последняя не смешивается с водою, и получится система с двумя жидкими фазами: ртутью и водой. Газообразная фаза попрежнему будет одна: она состоит из смеси воздуха, паров воды и паров ртути. Бросив в воду кусочки поваренной соли, получим систему с двумя твердыми фазами: льдом и твердой поваренной солью. При подсчете числа фаз не имеет значения, является ли та или иная фаза единым телом или состоит из нескольких частей, отделенных одна от другой. Так, капельки тумана в воздухе образуют вместе с ним двухфазную систему, состоящую из жидкой (вода) и газообразной фазы (смесь воздуха с водяными парами). В системе может быть несколько твердых или жидких фаз. Но она не может содержать более одной газообразной фазы, так как все газы смешиваются между собой.
Представляет интерес выяснение условий, при которых система, состоящая из двух или нескольких фаз, находится в равновесии. Последнее включает в себя механическое и тепловое равновесия. Для теплового равновесия необходимо, чтобы все фазы системы имели одну и ту же температуру. Необходимым условием механического равновесия является равенство давлений по разные стороны границы раздела соприкасающихся фаз. Последнее условие строго справедливо только в случае плоских границ раздела. В случае кривых границ оно нарушается действием сил по-
77
верхностного натяжения. Так, на поверхности раздела жидкости и её пара при равновесии существует разность давлений
|
1 |
|
1 |
Р2 − Р1 = σК , |
(1) |
где К = |
+ |
- средняя кривизна этой поверхности. |
|
||
R |
R |
|
|||
|
|
|
|
||
|
1 |
|
2 |
|
|
Равенство давлений и температур ещё не означает, что система находится в равновесии, так как соприкасающиеся фазы могут превращаться друг в друга. Такие превращения называются фазовыми превращениями. При фазовых превращениях одни фазы растут, другие уменьшаются и даже могут совсем исчезнуть. Состояние равновесия характеризуется тем, что массы всех фаз системы остаются неизменными. Следовательно, должно быть выполнено ещё одно необходимое условие равновесия – равновесие по отношению к взаимным превращениям фаз.
Примерами фазовых превращений могут служить изменения агрегатного состояния вещества. Под агрегатными состояниями понимают твердое, жидкое и газообразное состояния вещества. Твердое и жидкое состояния называются конденсированными. Испарением или парообразованием в широком смысле слова называют переход вещества из конденсированного состояния в газообразное. Обратный переход называется конденсацией. В узком смысле испарение есть переход вещества из жидкого состояния в газообразное. Переход из твердого состояния непосредственно в газообразное называется сублимацией или возгонкой. Переход из твердого состояния в жидкое называется плавлением, а обратный переход из жидкого состояния в твердое – затвердеванием или кристаллизацией. Примерами сублимации является, например, превращение льда в пар – мокрое белье высыхает на морозе. Если нагреть кристаллики йода в стеклянной колбе, в ней образуются фиолетовые пары йода, т.е. паления не наблюдается. При охлаждении пары йода, соприкасаясь с холодными стенками колбы, кристаллизуются и оседают на них в виде маленьких кристалликов.
Твердое состояние вещества может реализоваться в различных кристаллических модификациях. Это явление называется полиморфизмом. Например, твердый углерод может существовать в виде графита или алмаза, которые отличаются друг от друга кристаллической структурой. Существуют несколько разновидностей льда, т.е. твердой воды. Твердое железо может существовать в четырех различных модификациях (α−,β−, γ −и
δ− железо). Некоторые жидкости могут также существовать в виде различных модификаций (жидкие кристаллы, жидкие гелий I и гелий II). При изменении температуры и давления одни модификации могут превращаться в другие. Такие превращения относятся также к числу фазовых превращений. Превращение вещества из одной кристаллической модификации в другую называется полиморфным превращением.
78
В целях уяснения смысла равновесия между фазами рассмотрим более подробно простейший пример фазовых превращений – испарение и конденсацию. Допустим, что в закрытом сосуде заключена некоторая масса жидкости, над которой находится её пар. Объём сосуда остается неизменным, а температура поддерживается постоянной. Молекулы вещества совершают движение и все время пересекают границу раздела между жидкостью и паром. Происходит непрерывный обмен молекулами между этими двумя фазами. Если из жидкости в пар переходит больше молекул, чем из пара в жидкость, то количество жидкости уменьшается, т.е. идет процесс испарения. Тогда говорят, пар над жидкостью ненасыщенный или перегретый. Если, наоборот, число молекул, переходящих в обратном направлении больше, то пар конденсируется в жидкость. В этом случае пар называется пересыщенным. Наконец, когда число молекул, переходящих из жидкости в пар, равно числу молекул, переходящих за то же время из пара в жидкость, наступает состояние динамического или статистического равновесия. Это и есть состояние фазового равновесия. Вообще го-
воря, фазовое равновесие между фазами 1 и 2 не есть статическое со-
стояние, в котором полностью прекратились фазовые превращения, а характеризуется равенством средних скоростей двух взаимно противоположных процессов: превращения фазы 1 в фазу 2 и обратного пре-
вращения фазы 2 в фазу 1. При равновесии эти противоположные процессы взаимно компенсируют друг друга, как того требует принцип детального равновесия. Благодаря этому количество вещества в каждой фазе в среднем остается неизменным.
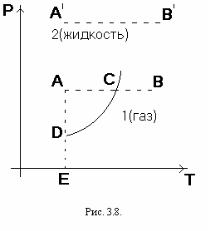
Изобразим состояние вещества точкой на плоскости ТР (рис. 3.8) Каждая точка этой плоскости соответствует однородному (однофазному) состоянию вещества – либо жидкости, либо её пару. Исключение составляют точки линии DK. Каждая точка линии DK изображает либо жидкость, либо её пар, либо смесь этих фаз в любых пропорциях. Уравнение этой кривой имеет вид
Р = Р(Т) . |
(2) |
Это уравнение дает зависимость давления на-
сыщенного пара от температуры. Кривая DK называется кривой равно-
весия жидкости и её насыщенного пара или кривой испарения.
Пересечем кривую испарения горизонтальной прямой, т.е. изобарой АВ. Пусть давление на изобаре АВ меньше критического. В точке А вещество находится в жидком состоянии. Действительно, здесь давление Р=ЕА выше давления насыщенного пара Р=ЕD при той же температуре. Под таким давлением пар существовать не может. Он конденсируется в жидкость. При нагревании жидкости под постоянным давлением изобра-
79

жающая точка перемещается вправо. В точке С пересечения изобары АВ с кривой ДК начнется испарение жидкости. Во все время испарения температура жидкости и её насыщенного пара будет оставаться неизменной. Когда вся жидкость испарится, изображающая точка при дальнейшем нагревании будет перемещаться по изобаре вдоль отрезка СВ – этому соответствует нагревание пара при постоянном давлении. Следовательно, точки, лежащие левее кривой испарения ДК, изображают жидкое состояние вещества, а точки, лежащие правее этой кривой, – газообразное состояние. Допустим теперь, что давление на изобаре выше критического, т.е. изобара А'B' проходит выше критической точки К. Тогда при изобарическом нагревании или охлаждении никаких превращений жидкости в пар или обратно не произойдет. Поэтому кривая испарения DK должна оканчиваться сверху в критической точке К. В этом можно убедиться также, проведя вертикальные прямые, т.е. изотермы. Если изотерма пересекает кривую DK, то соответствующий изотермический процесс сопровождается превращениями жидкости в пар или обратно. В этом случае температура ниже критической. Если же температура выше критической, то изотерма не может пересечь кривую испарения. Значит, последняя должна оканчиваться в какой-то точке, именно в критической точке К, причем рассматриваемая изотерма проходит правее этой точки.
Следствием обрыва кривой испарения в критической точке является непрерывность жидкого и газообразного состояний вещества. Действительно, из произвольной начальной точки А можно перейти в произвольную точку В так, чтобы при переходе пересечь кривую испарения. Тогда произойдет фазовое превращение. Но можно перейти в то же состояние, обойдя критическую точку К без пересечения кривой испарения DK. Тогда не наступит никаких превращений. Вещество все время останется физически однородным, а его свойства будут меняться непрерывно.
Найдем наклон кривой испарения. Для этого воспользуемся методом циклов. Проведем цикл Карно с двухфазной системой, состоящей из жидкости и её насыщенного пара. Так как давление насыщенного пара однозначно определяется его температурой, то для такой системы изотерма T = const является в то же время изобарой P = const . На диаграмме VP изотермы изображаются горизонтальными прямыми. Пусть начальное состояние двухфазной системы изображается точ-
кой 1 (рис. 3.9). Приведя систему в тепловой контакт с нагревателем, будем квазистатически подводить к ней тепло. Жидкость начнет испаряться, а система совершать работу, например, поднимая нагруженный поршень. Когда испарится единица массы жидкости, устраним тепловой контакт и
80
