
методичка по молекулярке
.pdf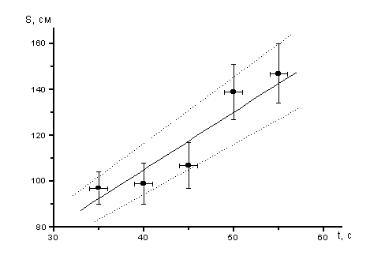
Последовательность операций
1.Строим оси координат и устанавливаем на них шкалы, исходя из интервалов изменения измеренных величин. Начало оси абсцисс (время) бе-
рем при t = 30 с, а начало оси ординат (расстояние) - при S =80см. Размечаем ось абсцисс с шагом 10с, а ось ординат с шагом 20см.
2.Наносим на координатную плоскость точки, представленные в таблице. Для каждой точки откладываем влево и вправо погрешность ∆t в масштабе оси абсцисс, а вверх и вниз погрешность ∆S в масштабе оси ординат.
3.Исходя из предположения о равномерном движении, т.е. о линейной зависимости S(t) = v0t , проводим прямую с таким расчетом, чтобы она наилучшим образом проходила через все измеренные точки. При проведении прямой учитываем, что в данном опыте при t = 0 путь S = 0 независимо от скорости, т.е. согласно теоретической формуле продолжение прямой должно проходить через точку (0,0), которая находится
за пределами рабочего участка координатной плоскости. Так как скорость v = dS / dt , а производная геометрически представляется тангенсом угла наклона касательной к графику функции, то для равномерного движения тангенс угла наклона прямой дает скорость v0 . Находить из графика следует именно тангенс, т. е. отношение противолежащего катета к прилежащему, взятых в масштабных единицах соответствующих осей. Очевидно, что угол наклона прямой зависит от выбора масштаба на осях. Поэтому измерение угла с последующим определением его тангенса смысла не имеет.
4.Для оценки погрешности проводим через экспериментальные точки еще две прямые с максимальным и минимальным наклоном в преде-
лах погрешностей большинства точек и с учетом того, что продолжения этих прямых должны пересекать точку (0,0). Определяем тангенс угла наклона этих прямых и устанавливаем интервал, в пределах которого находится искомая величина (скорость).
Окончательный результат построений Рис. 1 показан на рисунке 1.
11
Следует заметить, что графическая обработка опытных данных не столь строга, как аналитическая, зато она проста и наглядна.
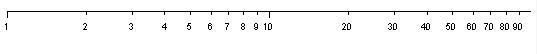
В тех случаях, когда диапазон изменений измеряемой величины превышает порядок, при построении графика обычно применяют логарифмический масштаб. Для построения логарифмической шкалы по оси от начальной точки в некотором масштабе откладываются отрезки, равные десятичным логарифмам ряда чисел. Если отложен lg a , то около соответст-
вующей точки ставится пометка a . Около начальной точки должна стоять пометка 1 (lg1 = 0). Таким образом, на логарифмической шкале расстояние
от пометки 1 до пометки a . равно в выбранном масштабе lg a . Так как lg(10a)=1+ lg a , то пометки на логарифмической шкале на участке от 10
до 100 будут в точности соответствовать пометкам на участке от 1 до10. Это же рассуждение может быть проведено и для других участков шкалы. Поэтому, для изображения чисел от 1 до 100 на логарифмической оси требуется увеличить длину оси всего в два раза по сравнению с осью, размеченной от 1 до 100. Пусть, например, на оси длиной 10см требуется отобразить числа от 1 до 100. Тогда на одну декаду будет приходиться 5см. Соответственно пометка 2 должна стоять на расстоянии lg 2 5 =1,5 см от
начала оси, пометка 3 на расстоянии lg3 5 = 2,4см, а пометка 30 на расстоянии lg30 5 = 7,4 см. На рисунке 2 приведен пример участка оси с логарифмической шкалой.
Рис. 2
12
ЧАСТЬ I. «ИДЕАЛЬНЫЙ ГАЗ», «РЕАЛЬНЫЙ ГАЗ», «ЯВЛЕНИЯ ПЕРЕНОСА»
ЛАБОРАТОРНАЯ РАБОТА №1
ОПРЕДЕЛЕНИЕ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ МЕТОДОМ ОТКАЧКИ
Приборы и принадлежности: насос Камовского, стеклянный баллон с краном, весы технические, разновесы, пинцет, вакуумметр.
Цели работы:
1.Изучение законов идеального газа;
2.Экспериментальное определение значения универсальной газовой постоянной.
Теория метода
Газ - это совокупность одинаковых, хаотически движущихся, не взаимодействующих друг с другом на расстоянии молекул. По-гречески слово "хаос" означает газ. Размеры молекул столь малы, что их суммарным объемом можно пренебречь по сравнению с объемом сосуда. Большую часть времени каждая молекула движется свободно, претерпевая иногда упругие соударения с другими молекулами или стенками сосуда.
В отличие от жидкостей и твердых тел в газах отсутствует и ближний, и дальний порядок.
Газ, молекулы которого не взаимодействуют друг с другом на расстоянии (силами притяжения) и представляются абсолютно твердыми шарами очень малых размеров, называется идеальным. Следовательно, энергия взаимодействия молекул идеального газа Uпот = 0 . Иными словами, в
идеальном газе отсутствуют силы межмолекулярного притяжения, а бесконечно большие силы отталкивания возникают только при непосредственном соприкосновении молекул шаров при их соударении. Сказанное означает, что условие идеальности газа Uпот = 0 , очевидно, будет выпол-
няться хорошо при выполнении двух условий: 1) число столкновений между всеми молекулами газа (за единицу времени) должно быть намного меньше числа их столкновений со стенками сосуда: Ζ >> ∑Ζi ; 2) объем
газа (сосуда) должен быть намного больше суммарного объема всех молекул: V >> ∑VI . Эти два условия означают, что любой реальный газ при
достаточном разрежении, когда среднее расстояние между молекулами намного больше диаметров самих молекул, удовлетворяет условию идеальности газа.
13
С достаточной степенью точности множество реальных газов, в том числе и воздух, при комнатной температуре и атмосферном давлении можно считать идеальными газами, поскольку среднее расстояние между молекулами при обычных условиях гораздо больше размеров самих молекул.
В зависимости от внешних условий газ может иметь различные свойства и различные состояния. Состояние данной массы идеального газа m характеризуется следующими параметрами: давлением p , объемом V ,
занимаемым газом, и абсолютной температурой T . Формула, связывающая параметры газа, называется уравнением состояния
f ( p,V ,T ) = 0. |
(1.1) |
Связь между параметрами газа описывается экспериментально открытыми законами:
1. Закон Бойля-Мариотта описывает изотермический процесс - процесс, проходящий при постоянной температуре (T = const ): для данной массы идеального газа произведение давления газа на его объем в процессе изотермического изменения состояния газа остается величиной постоянной:
pV = const . |
(1.2) |
Графиком, описывающим изотермический процесс в координатах p −V , является гипербола, получившая название изотермы. Для двух со-
стояний 1 и 2, лежащих на одной изотерме T = const , закон БойляМариотта записывается так:
p1V1 = p2V2 .
2. Закон Гей-Люссака описывает изобарный процесс - процесс, протекающий при постоянном давлении ( p = const ): для данной массы газа
при постоянном давлении объем газа прямо пропорционален абсолютной температуре:
V |
= const . |
(1.3) |
|
T |
|||
|
|
Графиком, описывающим изобарный процесс в координатах T −V , является прямая линия, получившая название изобары. Она выражает зависимость объема газа от абсолютной температуры. Для двух состояний 1 и 2, лежащих на одной изобаре p = const закон Гей-Люссака записывается так:
V1 = V2 .
T1 T2
3. Закон Шарля описывает изохорный процесс - процесс, протекающий при постоянном объеме (V = const ): для данной массы газа при постоянном объеме давление газа прямо пропорционально абсолютной температуре:
14
p |
= const . |
(1.4) |
|
T |
|||
|
|
Графиком, описывающим изохорный процесс в координатах T − p ,
является прямая линия, получившая название изохоры. Она выражает зависимость давления газа от абсолютной температуры. Для двух состояний 1 и 2, лежащих на одной изохоре V = const закон Шарля записывается так:
p1 |
= |
p2 |
. |
|
|
|
|||
T |
1 |
|
T |
|
|
|
2 |
|
|
Закон, обобщающий вышеуказанные экспериментальные газовые за-
коны, называется законом или уравнением Клапейрона-Менделеева, и
имеет вид:
pV = |
m |
RT , |
(1.5) |
||||
|
|
||||||
|
|
µ |
|
|
|
||
где µ - молярная масса газа, R - универсальная газовая постоянная. Из |
|||||||
формулы (1.5) следует, что |
pV |
|
|
|
|||
R = |
|
. |
(1.6) |
||||
|
|
||||||
|
|
m |
T |
|
|||
|
|
µ |
|
||||
|
|
|
|
|
|
|
|
Для выяснения физического смысла R рассмотрим процесс изобарического расширения идеального газа. Допустим, что температура 1 моля такого газа изменяется от T1 до T2 при p = const . Можно показать, что ра-
бота, совершаемая газом, при этом, равна: |
|
|
|
|
|||||
|
А= R(T2 −T1 ) . |
|
|
|
(1.7) |
||||
С другой стороны, из формулы работы вытекает, что |
|
||||||||
|
А = p(V2 |
−V1 ) . |
|
|
|
(1.8) |
|||
В этой формуле V1 и V2 |
- начальный и конечный объемы газа. Из |
||||||||
формул (1.7) и (1.8) можно получить: |
|
|
|
|
|
|
|||
R = |
p(V2 −V1 ) |
|
= |
p∆V |
= |
A |
. |
(1.9) |
|
|
∆T |
|
|||||||
|
T |
−T |
|
|
∆T |
|
|||
2 |
1 |
|
|
|
|
|
|
|
|
Таким образом, газовая постоянная численно равна работе, совершаемой одним молем идеального газа при нагревании его на 1K при постоянном давлении.
Зная газовую постоянную, можно определить и постоянную Больцмана по формуле:
k = |
R |
, |
(1.10) |
|
|||
|
NA |
|
|
где NA = 6,02 1023 моль−1 - число Авогадро. Зная постоянную Больцмана, по формуле
15
Е = |
i |
kT , |
(1.11) |
|
|||
2 |
|
|
|
где i - число степеней свободы молекул газа, можно определить среднюю энергию одной молекулы идеального газа.
Для экспериментального определения R рассмотрим идеальный газ, заполняющий баллон объема V . Запишем уравнение МенделееваКлапейрона для этого газа при комнатной температуре T и атмосферном
давлении p1 для массы M1 : |
|
M1 |
|
|
|
||
p V = |
RT . |
(1.12) |
|||||
|
|
||||||
1 |
|
µ |
|
|
|
||
|
|
|
|
|
|||
Если откачать насосом газ (в работе - воздух) из баллона объемом V |
|||||||
до давления p2 , то уравнение (1.12) запишется в виде: |
|
||||||
p V = |
M2 |
RT . |
(1.13) |
||||
|
|||||||
|
2 |
µ |
|
|
|||
|
|
|
|
||||
Предполагаем, что после откачки части воздуха температура воздуха в баллоне равна комнатной температуре, т.е. T1 =T2 =T . Вычтем из урав-
нения (1.12) уравнение (1.13) и найдем универсальную газовую постоянную:
µ(p1 − p2 )V |
|
R = (M1 − M 2 )T . |
(1.14) |
Таким образом, зная значения давления и массы газа в баллоне до и после откачки из баллона газа, можно определить экспериментально численное значение универсальной газовой постоянной.
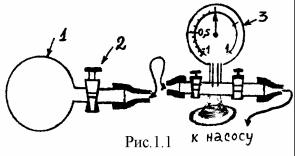
Описание установки
Установка для определения универсальной газовой постоянной R изображена схематически на рис.1.1. Стеклянный баллон 1 присоединен к вакуумметру 3 и дальше - к насосу Камовского. Кран 2 служит для того, чтобы осуществлять связь баллона с атмосфе-
рой. Масса баллона с мешочком (внимание: мешочек не снимать!) без учета находящегося внутри баллона воздуха - mб . Его объем равен 1,2л.
Молярная масса воздуха µ = 29 10−3 кг моль−1 .
Порядок выполнения работы
1.Баллон с помощью резинового патрубка аккуратно присоедините к вакуумметру, соединенному с насосом Камовского. Откройте кран 2.
2.Откачайте воздух до ∆p = 0,5кгс см−2 и закройте кран 2.
16

3.Осторожно отсоедините баллон от вакуумметра, подвесьте к левой чашке весов и взвесьте с точностью до сотых долей грамма массу баллона с воздухом m2 . Масса воздуха в баллоне M 2 = m2 − mб .
4.Снимите баллон с весов, осторожно откройте кран 2 (должно слышаться легкое шипение). Тогда p1 = pатм. .
5.Снова взвесьте баллон с воздухом, определите m1 с такой же точностью. Масса воздуха в баллоне M1 = m1 − mб .
6.Повторите измерения еще 4 раза. Результаты измерений занесите в таблицу.
Таблица 1.1. Результаты эксперимента
№ |
m , мг |
∆m |
, мг |
∆ |
2 |
, мг |
2 |
m , мг |
∆m , мг |
( |
∆ |
2 |
, мг |
2 |
||
опыта |
2 |
2 |
|
( |
m ) |
|
1 |
1 |
|
m ) |
|
|||||
|
|
|
|
2 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
… |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
5 |
|
|
|
|
|
- |
m2 = |
- |
∑(∆m2i )2 |
= |
m1 = |
- |
∑(∆m1i )2 |
= |
||||||||
|
|
|
|
i=1 |
|
|
|
|
|
|
i=1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7. Вычислите R по результатам прямых измерений и найдите его среднее значение по формуле:
µ∆pV
R)T .
8.Вычислите относительную εR = ∆RR 100% и абсолютную ∆R погрешно-= (m1 −m2
сти по методике обработки результатов косвенных измерений.
9. Окончательно запишите результат в виде: R = R ± ∆R , εR = ∆RR 100% .
10.Используя формулу (1.10), определите постоянную Больцмана k = k ± ∆k, εk = ∆kk 100%.
11.По формуле (1.11) рассчитайте энергию одной молекулы воздуха при комнатной температуре E = E ± ∆E , εE = ∆EE 100% и внутреннюю энер-
гию одного моля воздухаU =U ± ∆U , εU = ∆UU 100% .
12.Запишите вывод по работе. При этом обязательно сравните экспериментально полученные результаты с литературными данными.
17
ЛАБОРАТОРНАЯ РАБОТА №2
ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ БОЛЬЦМАНА
Приборы и принадлежности: стеклянный баллон, жидкостный манометр, шприц медицинский, термометр для измерения температуры воздуха, этиловый эфир.
Цели работы:
1.Изучение основ молекулярно-кинетической теории;
2.Экспериментальное определение постоянной Больцмана.
Теория метода
Формула для определения постоянной Больцмана получается из основного уравнения молекулярно-кинетической теории газов:
k = |
∆p . |
(2.1) |
|
nT |
|
В этом отношении n - число молекул эфира в единице объема:
|
|
n = |
|
|
M |
|
, |
|
|
|
m V |
||||||
|
|
|
|
|
||||
|
|
m0 - масса молекул эфира, M - |
|
|
0 |
|
|
|
где |
|
масса жидкого эфира ( M = ρЭVЭ , |
||||||
ρ |
|
= 0,714г см−3 ), V - объем сосуда, m |
|
= |
|
µ |
, где µ - масса одного моля |
|
Э |
|
|
|
|||||
|
|
0 |
|
NA |
||||
|
|
|
|
|
|
|||
эфира, равная 74 10−3 кг моль−1 , N A - число Авогадро.
Учитывая, что парциальное давление эфира уравновешивается давлением столба жидкости высотой ∆h в манометре, можно определить его величину по формуле: ∆p = ρg∆h .
Тогда, подставляя значение n и ∆P в формулу (2.1), получим:
|
|
k = |
∆p |
= |
ρg∆hm0V = |
ρgVµ ∆h |
|
(2.2) |
||||||||
|
|
nT |
ρ |
|
N |
|
TV |
|
|
|||||||
|
|
|
|
MT |
|
Э |
A |
|
|
|
|
|||||
или |
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|||
|
|
|
|
|
∆h |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k = B |
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TV |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|
|
|
|
|
|
где |
B = |
ρgVµ . Здесь B - постоянный коэффициент, т.к. ρ, ρЭ , |
g , V , |
|
µ |
|
||||||||||
|
N A |
|||||||||||||||
|
|
ρЭNA |
|
|
|
|
|
|
|
|
|
|
|
|
||
не меняются в процессе опыта. Экспериментальная часть опыта, таким образом, сводится к определению объема эфира VЭ , увеличения давления∆p ,
т.е. ∆h , и температуры T .
18

Методика выполнения работы
Работа начинается с проверки начальных уровней в коленах манометрической трубки (рисунок 2.1). Затем с помощью шприца в сосуд вводится
этиловый эфир объема VЭ . Эфир
очень быстро испаряется, т.к. его |
|
масса очень мала, и в сосуде образу- |
|
ется газообразный эфир, к которому |
|
применимы законы идеального газа. |
|
При этом давление внутри сосуда |
|
увеличивается на величину парци- |
|
Рис.2.1 |
|
ального давления газообразного |
|
|
|
эфира ( ∆p ). |
|
Рассчитав постоянную Больцмана по формуле (2.2) по экспериментальным данным, необходимо вычислить абсолютную и относительную ошибки. Объем сосуда может быть дан, а может быть найден экспериментально. Для этого сосуд наполняют водой, измеряя ее объем (насыщающие водяные пары, образующиеся в сосуде после этой операции, не повлияют на точность результата, т.к. постоянная Больцмана определяется по добавочному парциальному давлению паров эфира).
Порядок выполнения работы
1.Плотно закройте бутыль и запишите показания манометра и термометра.
2.Наберите в шприц эфир, запишите его объем (VЭ = 0,5см3 ).
3.Введите иглу шприца в резиновую пробку так, чтобы конец иглы оказался в сосуде.
4.Впрысните эфир и немедленно уберите шприц. Отверстие в пробке зажмите.
5.По мере испарения эфира парциальное давление его будет возрастать.
6.По истечении нескольких минут после впрыскивания эфира рост
давления прекратится, после запишите показания манометра, т.е. Величину ∆h .
7.Измерьте объем сосуда V по вышеуказанной методике.
8.Произведите вычисление значений постоянной больцмана и подсчитайте погрешности для двух случаев: по табличному и измеренным значениям.
9.Запишите окончательный результат в виде: k = k ± ∆k , εk = ∆kk 100%.
10.Оформите отчет. В выводе обязательно сравните окончательный результат с табличным значением постоянной больцмана.
19
ЛАБОРАТОРНАЯ РАБОТА №3
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЕМКОСТЕЙ ГАЗОВ
Приборы и принадлежности: стеклянный сосуд, жидкостный манометр, насос Камовского.
Цели работы:
1.Изучение законов термодинамики;
2.Экспериментальное определение отношения удельных теплоемкостей для воздуха методом Клемана и Дезорма.
Теория метода
Величина отношения теплоемкости при постоянном давлении Cp к
теплоемкости при постоянном объеме CV для газов, γ = Сp , получившая
СV
название адиабаты, играет очень большую роль при адиабатических процессах и процессах, близких к ним. Для примера укажем, что ею, в частности, определяется скорость распространения звука в газах, от нее зависит течение газов по трубам со звуковыми скоростями и достижение сверхзвуковых скоростей в расширяющихся трубах.
Описываемый ниже способ определения отношения удельных тепло-
емкостей газов γ = Сp чрезвычайно прост.
СV
Пусть мы имеем стеклянный сосуд, соединенный с манометром (см. рисунок 3.1). Посредством крана сосуд может соединиться с атмосферой, и пусть первоначально в нем было атмосферное давление. Если закрыть кран и с помощью насоса накачать небольшое количество воз-
духа, давление в сосуде, конечно, повысится. Но, РИС.3.1 если накачка была произведена достаточно быст-
ро, постоянная разность уровней жидкости в трубке устанавливается не сразу, а постепенно, через некоторый промежуток времени, так как при быстрой накачке сжатие воздуха близко к адиабатическому сжатию, и, следовательно, температура повысилась. Окончательная разность уровней жидкости в манометре h1 установится только тогда, когда температура внутри сосуда сравняет-
сяблагодарятеплопроводностистенокстемпературойокружающеговоздуха.
20
