
методичка по молекулярке
.pdfТаблица 3.7. Результаты эксперимента
T , 0С |
t1 , |
t2 , |
U1 , |
I1 , |
W1 , |
U2 , |
I2 , |
W2 , |
|
с |
с |
B |
A |
Вт |
B |
A |
Вт |
|
|
|
|
|
|
|
|
|
Комн. |
0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
40 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
80 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12.По формулам (4) и (5) вычислить мощность потерь и теплоемкость системы.
13.По формуле (6) вычислить КПД нагревателя. 14. Вычислить погрешности определения W ′,C0 ,η.
15.Сделать выводы.
Таблица 3.8. Результаты расчетов
T , |
0 |
С |
∆t1 , |
∆t2 , с |
W ′, |
C0 , |
η |
|
с |
Вт |
Дж/кг |
||||
|
|
|
|
|
|
||
40 |
|
|
|
|
|
||
|
|
|
|
|
|
||
60 |
|
|
|
|
|
||
|
|
|
|
|
|
||
80 |
|
|
|
|
|
||
|
|
|
|
|
|
||
100 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
91
ЧАСТЬ 4. ВИРТУАЛЬНАЯ ЛАБОРАТОРИЯ «ОТКРЫТАЯ ФИЗИКА»
ВВЕДЕНИЕ
Данный раздел лабораторных работ с элементами компьютерного моделирования содержит описания к лабораторным работам, в которых используются компьютерные модели, разработанные фирмой «Физикон» в среде Windows и включенные в CD-ROM «Открытая физика 1.0» часть 1.
Работа в среде Windows требует определенных навыков и привычки оперировать с некоторыми стандартными для этой среды способами организации диалога компьютер-пользователь.
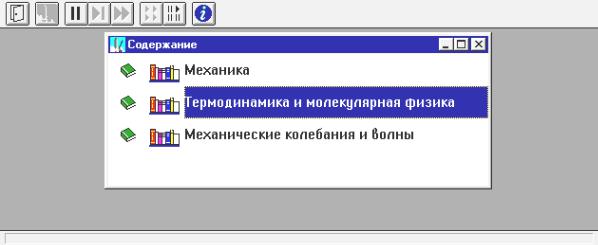
Для запуска программы необходимо дважды щелкнуть левой кнопкой мыши, когда ее маркер расположен над эмблемой данной части сборника компьютерных моделей. После этого появится начальная картинка (рис. 4.1), где необходимо дважды щелкнуть левой кнопкой мыши, установив ее маркер над названием радела, в котором расположена данная модель.
Чтобы увидеть дальнейшие пункты содержания данного раздела (рис. 4.2), надо щелкать левой кнопкой мыши, установив ее маркер на кнопку со стрелкой вниз, расположенную в правом нижнем углу внутреннего окна.
Рис. 4.1
Кнопки вверху картинки являются служебными. Предназначение каждой проявляется, если маркер мыши располагается над нею в течение 1-2 секунд (без нажатия кнопок мыши). Очень важной является кнопка с
92
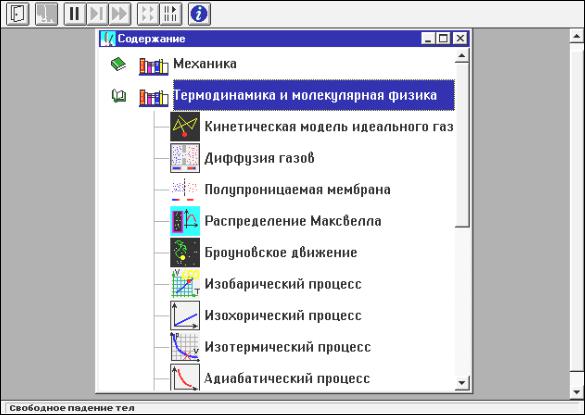
двумя вертикальными чертами « », которая служит для остановки эксперимента, а рядом расположенные кнопки – для шага «X » и продолжения
«» работы.
Рис. 4.2
Прочитав надписи во внутреннем окне, установите маркер мыши над надписью требуемой компьютерной модели и дважды коротко нажмите левую кнопку мыши. В появившемся внутреннем окне сверху также будут расположены служебные кнопки. Кнопка с изображением страницы служит для вызова теоретических сведений. Перемещать окна можно, зацепив (нажав и удерживая левую кнопку) мышью заголовок окна (имеющий синий фон). Закрытие окна теории обеспечивается нажатием кнопки с крестом в правом верхнем углу внутреннего окна.
93

ЛАБОРАТОРНАЯ РАБОТА №1
АДИАБАТИЧЕСКИЙ ПРОЦЕСС
Цели работы:
1.Знакомство с компьютерной моделью, описывающей адиабатический процесс в идеальном газе;
2.Экспериментальное подтверждение закономерностей адиабатического процесса;
3.Экспериментальное определение показателя адиабаты, количества степеней свободы и структуры молекул газа в данной модели.
Теория метода
Состояние системы имеет фиксированные значения макроскопических параметров, описывающих систему в целом. Параметры, характеризующие систему в целом, называются параметрами состояния. Примерами являются температура, давление, объем и т.д.
Равновесным называется такое состояние системы, при котором все параметры системы имеют определенные значения, остающееся неизменными сколь угодно долго при неизменных внешних условиях.
Обратимым называется процесс, при реализации которого в обратном направлении система проходит через те же состояния, что и при прямом ходе, но в обратной последовательности. Равновесные процессы всегда обратимы.
Круговым процессом (циклом) называется процесс, при котором система после ряда изменений возвращается в исходное состояние.
Уравнение состояния идеального газа (уравнение МенделееваКлапейрона)
pV = mµ RT .
Теплоемкость тела численно равна отношению количества тепла dQ , сообщенного телу, к изменению температуры тела dT , которое при этом произошло:
C = dQdT .
Удельной теплоемкостью вещества называется отношение теплоемкости к массе тела.
Если тело не меняет свой объем, то оно не совершает работы, поэтому при постоянном объеме тела переданное телу тепло dQ идет на изменение его внутренней энергии dU .
94
Теплоемкость при постоянном объеме
|
|
|
CV |
|
dQ |
dU |
|
|
i m |
R . |
|
|
||||||
|
|
|
= |
|
|
= |
|
= |
|
|
|
|
|
|
|
|||
|
|
|
|
|
dT |
2 µ |
|
|
||||||||||
|
|
|
|
|
dT V |
|
|
|
|
|||||||||
Теплоемкость при постоянном давлении |
|
|
|
|||||||||||||||
|
|
dQ |
|
dU |
|
dV |
|
i m |
|
i +2 m |
R . |
|||||||
|
Cp = |
|
= |
dT |
+ p |
|
= |
|
|
|
|
|
R + |
|
||||
|
2 µ |
2 µ |
||||||||||||||||
|
|
dT p |
|
|
dT p |
|
|
|
||||||||||
Отношение |
CP |
= γ |
является константой (в определенном диапазоне |
|||||||||||||||
|
||||||||||||||||||
|
C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
температур) для данного газа. Эта константа называется показателем адиабаты.
Формула
γ =1 + 2i
устанавливает связь отношения теплоемкостей γ с числом степеней свободы молекулы газа i .
Число степеней свободы есть минимальное количество независимых координат, необходимых для однозначного описания положения молекулы в пространстве или минимальное количество независимых движений, суперпозиция которых дает любое движение молекулы.
Поступательное движение всегда дает 3 степени свободы. Вращательное движение дает 2 степени свободы для линейной молекулы и 3 степени свободы, если атомы в молекуле не расположены на одной линии. Колебательное движение дает 2 nкол степеней свободы, где nкол – количество
независимых колебаний атомов в молекуле (у двухатомной молекулы
nкол =1).
Адиабатическим называется процесс, происходящий без теплообмена с внешней средой ( dQ = 0 ). Уравнение адиабаты
pV γ = const .
Порядок выполнения работы:
Внимательно рассмотрите картинку на рисунке 4.3, найдите рисунок элемента, в котором реализуется адиабатический процесс, обратите внимание на его теплоизоляцию. Найдите математическую формулировку условия теплоизоляции. Ознакомьтесь с графиками в правой части изображения. Зарисуйте необходимое в свой конспект лабораторной работы.
1.Установите начальное значение объема Vнач = 40 дм3 и начальную температуру T1 газа, близкую к числам из таблицы 4.1. Для этого нажмите кнопку «ВЫБОР», переместите маркер мыши так, чтобы его острие находилось в указанной точке вблизи границы столбика на градуснике, и коротко нажмите и удерживая левую кнопку мыши двигайте столбик.
2.Нажмите мышью кнопку «СТАРТ» на экране и наблюдайте перемещение поршня на левой картинке модели и перемещение точки по крас-
95
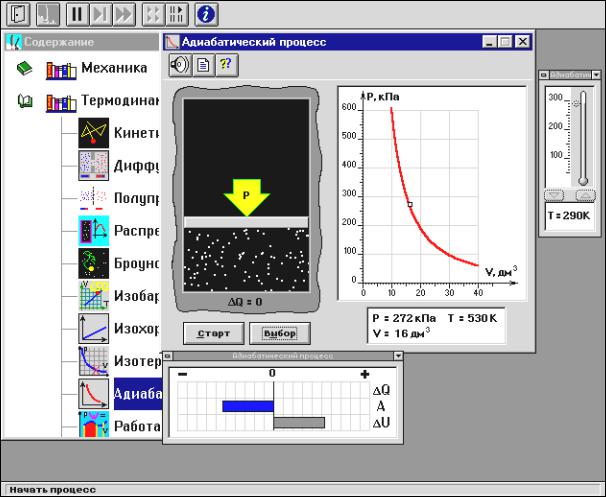
ной кривой теоретической адиабаты. Попробуйте останавливать процесс нажатием кнопки «СТОП». Последующий запуск процесса осуществляется нажатием кнопки «СТАРТ».
Рис. 4.3
3.После автоматической остановки процесса запустите его снова, нажав кнопку «СТАРТ», и останавливайте, нажимая кнопку «СТОП», когда крестик на теоретической адиабате (красная кривая) будет находиться вблизи следующих значений объема: 15, 20, 25, 30, 35 и 40дм3 (6 значений), записывая при остановке значения объема, температуры и давления в таблицу 4.2.
4.Установите новое значение температуры T2 , взяв его из таблицы 4.1, задавая Vнач = 40 дм3 и повторите измерения, записывая результаты в таблицу 4.3.
96
Таблица 4.1. Начальные значения температуры
Группа |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
T1 |
50 |
70 |
100 |
120 |
140 |
170 |
200 |
220 |
|
|
|
|
|
|
|
|
|
T2 |
230 |
240 |
250 |
260 |
270 |
280 |
290 |
300 |
|
|
|
|
|
|
|
|
|
Таблицы 4.2, 4.3. Результаты измерений
T , К
V , дм3
p , кПа
5.Постройте на одном рисунке графики экспериментальных зависимостей логарифма давления от логарифма объема для обеих адиабат (указав на них начальные температуры).
6.Для каждой адиабаты определите по графику экспериментальное
значение показателя, используя формулу |
γ = − |
∆(ln p) |
. |
|
|||
|
|
∆(lnV ) |
|
7.Определите число степеней свободы молекулы газа, исследуемого в данной компьютерной модели.
8.Подберите распространенный газ, структура молекулы которого близка к наблюдаемой.
9.Запишите ответы и проанализируйте ответы и графики.
97
ЛАБОРАТОРНАЯ РАБОТА №2
РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА
Цели работы:
1.Знакомство с компьютерной моделью, описывающей поведение молекул идеального газа;
2.Экспериментальное подтверждение распределения Максвелла молекул идеального газа по скоростям;
3.Экспериментальное определение массы молекул в данной модели.
Теория метода:
Вероятностью Pi получения некоторого результата измерения на-
зывается предел отношения количества измерений, давших этот результат Ni , к полному числу измерений N , когда N → ∞.
Элементарной вероятностью dPv при измерении величины скорости
v называется вероятность наличия скорости величиной от v до v + dv . Эта вероятность пропорциональна приращению скорости dv
dPv = F(v)dv ,
где коэффициент пропорциональности F(v) называется функцией распределения молекул по величине скорости
|
|
|
|
3 |
|
|
mυ2 |
|
|
m |
|
|
2 |
|
|
|
|
|
|
− |
2kT |
|||||
F(v) = |
|
|
|
|
e |
|
4πv2 . |
|
|
|
|
||||||
|
2πkT |
|
|
|
|
|
||
Средняя скорость vср = ∞∫vF(v)dv = |
8kT . |
|
|
|||||
0 |
|
|
πm |
|
|
|
||
Средняя квадратичная скорость vср.кв. |
= |
3kT . |
||||||
|
|
|
|
|
|
|
|
m |
Наивероятнейшей называется скорость при которой функция рас- |
||||||||
пределения имеет максимум: |
|
|
|
|
|
|
|
|
vвер = |
|
|
2kT . |
|||||
|
|
|
|
|
m |
|
|
|
Методика и порядок измерений
Внимательно рассмотрите рисунок 4.4 и зарисуйте необходимое в свой конспект лабораторной работы.
Внимательно рассмотрите изображение на экране монитора компьютера. Обратите внимание на систему частиц, движущихся в замкнутом объеме слева во внутреннем окне. Они абсолютно упруго сталкиваются друг с другом и со стенками сосуда. Их количество около 100 и данная система является хорошей «механической» моделью идеального газа.
98
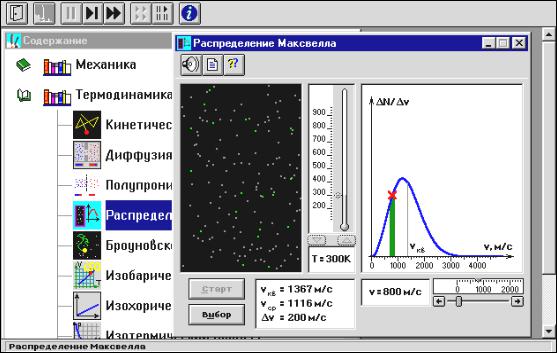
Рис. 4.4
В процессе исследований можно останавливать движение всех молекул (при нажатии кнопки « » вверху) и получать как бы «мгновенные фотографии», на которых выделяются более ярким свечением частицы (точки), скорости которых лежат в заданном диапазоне вблизи заданной скорости v (т.е., имеющие скорости от v до v +dv ). Для продолжения наблюдения движения частиц надо нажать кнопку « ». Запишите в тетрадь значение ∆v , указанное на экране.
Порядок выполнения работы:
1.Нажмите кнопки « », «СТАРТ» и «ВЫБОР» и установите температуру T1 , указанную в таблице 4.4 для вашей группы. Запишите для нее значение наивероятнейшей скорости.
2.Установите скорость выделенной группы молекул вблизи минимального заданного в таблице 4.5 значения.
3.Нажмите клавишу « » и подсчитайте на «мгновенной фотографии» количество молекул ∆N , скорости которых лежат в заданном диапазоне ∆v вблизи заданной скорости молекул v (они более яркие). Результат запишите в таблицу 4.5.
4.Нажмите кнопку « » и через 10-20 секунд получите еще одну мгновенную фотографию (нажав кнопку « »). Подсчитайте количество частиц с заданной скоростью. Результат запишите в таблицу 4.5.
5.Повторите еще 3 раза измерения для данной скорости и результаты запишите в таблицу 4.5.
99
6.Измените скорость до значения, указанного в таблице 4.5, и сделайте по 5 измерений (как в пункте 4) для каждой скорости.
7.Установите (как в пункте 1) вторую температуру T2 из таблицы 4.4. Запишите для нее значение наивероятнейшей скорости.
8.Повторите измерения (по пунктам 2, 3, 4, 5), записывая результат в таблицу 4.6, аналогичную таблице 4.5.
Таблица 4.4. Примерные значения температуры
Группа |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
T1 |
160 |
200 |
260 |
300 |
360 |
400 |
460 |
500 |
T2 |
700 |
740 |
760 |
800 |
840 |
860 |
900 |
960 |
Таблицы 4.5, 4.6. Результаты измерений при T = ___ К v , км/с 0,5 1,0 1,5 2,0 2,5 3,0 3,5
∆N1
∆N2
∆N3
∆N4
∆N5
∆Nср
9.Вычислите и запишите в таблицы средние значения количества частиц ∆Nср , скорости которых лежат в данном диапазоне от v до v + dv .
10.Постройте на одном рисунке графики экспериментальных и теоретических зависимостей ∆Nср (v). Теоретические зависимости можно
срисовать с экрана монитора компьютера, подобрав соответствующий масштаб по вертикальной оси ординат.
11.Для каждой температуры определите экспериментальное значение наивероятнейшей скорости молекул v .
12.Постройте график зависимости квадрата наивероятнейшей скорости от температуры vвер2 (Т). По данному графику определите значение
массы молекулы
m = 2k ∆(T ) .
∆(vвер2 )
13.Подберите газ, масса молекулы которого достаточно близка к изме-
ренной массе молекулы. |
|
|
|
|
|
|
|
|
Неон |
|
|
Газ |
Водород |
Гелий |
Азот |
Кислород |
|
Масса молекулы 10-27 кг |
3.32 |
6.64 |
33.2 |
46.5 |
53.12 |
14.Запишите ответы и проанализируйте ответы и графики.
100
