
методичка по молекулярке
.pdfЛАБОРАТОРНАЯ РАБОТА №3
ВЯЗКОСТЬ ЖИДКОСТИ В ДИАПАЗОНЕ ТЕМПЕРАТУР
Цели работы:
1.Ознакомление с особенностями явлений переноса в жидкости.
2.Определение коэффициента вязкости жидкости методом капиллярного вискозиметра.
3.Изучение температурной зависимости коэффициента вязкости жидкостей.
Теория метода
Явления переноса в газах определяются длиной свободного пробега молекул λ. Именно поэтому выражения для всех коэффициентов переноса содержат в качестве множителя λ. Но в жидкости, как и в плотных газах, понятие о λ теряет смысл. В жидкости среднее расстояние между молекулами такого же порядка, что и размеры самих молекул, поэтому перемещение частиц в объеме жидкости крайне затруднено, так что «свободного» пробега у молекул нет. Молекулы жидкости могут лишь совершать малые колебания около положений равновесия в пределах, ограниченных межмолекулярными расстояниями.
Детальная картина теплового движения молекул в жидкости впервые дана Френкелем. Согласно Френкелю молекула в жидкости в течение некоторого времени колеблется около положения равновесия, затем под воздействием окружающих частиц при возникновении благоприятных условий (благодаря флуктуациям плотности ρ) скачком меняет положение рав-
новесия, перемещаясь на расстояние порядка размера самих молекул. Поэтому это положение равновесия, в котором частицы жидкости совершают малые колебания, получило название временного положения равновесия.
Таким образом, молекулы жидкости как бы делятся на две группы: одна из них газоподобна и совершает беспорядочное перемещение («кочующие» молекулы), другая – находящиеся в колебательном движении («оседлые» молекулы). Между «оседлыми» и «кочующими» молекулами существует динамическое равновесие. При увеличении температуры возрастает доля «кочующих» молекул. Это означает, что колеблющаяся молекула в результате флуктуации может чаще, чем при низкой температуре, получить от соседних молекул избыточную энергию, достаточную для того, чтобы перейти скачком на новое положение равновесия – «оседлой жизни». В этом положении частица проведет некоторое время, пока снова не получит нужную для скачка энергию и т.д. Такие колебания, сменяющиеся скачками, – и есть тепловое движение молекул жидкости. Число ежесекундных активированных скачков молекул ξ тем больше, чем боль-
61
ше частота колебаний ν, чем меньше энергия активации скачков ε и чем выше температура T , то есть
|
|
ε |
|
|
ξ = 2νk1 exp |
− |
|
|
, |
|
||||
|
|
kT |
|
|
где k1 учитывает тот факт, что для скачка молекул, кроме энергии активации скачка ε, нужна еще флуктуация плотности ρ.
По Френкелю, время «оседлой» жизни молекул τ ≈ 1ξ , и связано с пе-
риодом их колебаний τ0 |
соотношением: |
|
ξ |
, где ξ |
- энергия ак- |
|
τ = τ0 exp |
|
|
||||
|
||||||
|
|
kT |
|
|
||
тивации скачков, т.е. энергия, которую нужно сообщить «оседлой» частице для ее перехода через потенциальный барьер в соседнее положение равновесия. Несмотря на наличие «оседлых» частиц, в плотных газах и жидкостях со временем все частицы участвуют в неупорядоченном тепловом перемещении, вследствие чего в жидкостях возникает термическое давление, которое по своей природе тождественно давлению идеального газа.
Естественно, что разбиение частиц жидкости на «кочующие» и «оседлые» лишь искусственный прием, сделанный Френкелем в целях упрощения рассмотрения теории кинетических явлений в жидкостях. На самом деле все молекулы «кочуют» и одновременно ведут «оседлый» образ жизни. Более того, как показали исследования, время «оседлой» жизни и скачков при определенных температурах одного порядка величины (10-9-10-11с).
Как часто происходят молекулярные скачки? Сколько времени проходит между скачками? Это зависит от свойств молекул, от сил взаимодействия между ними, от плотности жидкости. Хотя силы взаимодействия между молекулами жидкости имеют очень сложный характер, но все же некоторые соображения о движении частиц и определяемом их явлениях переноса можно высказать.
Очевидно, что диффузия в жидкостях протекает тем быстрее, чем меньше время «оседлой» жизни τ частиц жидкости, то есть чем больше число ежесекундных скачков ξ . Следовательно, диффузия в жидкостях
определяется «кочующими» молекулами. Причем, чем интенсивнее «кочуют» частицы жидкости, тем быстрее диффузия, тем больше перенос массы через некоторую площадку, перпендикулярную градиенту концентрации частиц данного сорта, за единицу времени. Сказанное означает, что
коэффициент диффузии |
|
1 |
, следовательно, |
D = D0 |
|
|
ε |
и диффу- |
|
D ~ ξ ~ |
τ |
exp |
− |
|
|
||||
|
|||||||||
|
|
|
|
|
|
kT |
|
||
зия происходит более интенсивно при более высоких температурах, поскольку с ростом температуры увеличивается число ежесекундных скачков («кочующих» молекул).
62

Реальная жидкость обладает вязкостью (внутренним трением). Сила
внутреннего трения F выражается формулой Ньютона: |
F = −η |
∂V |
∆S , где |
|
∂x |
||||
|
|
|
∂∂Vx - градиент скорости течения жидкости, ∆S - площадь соприкосновения
слоев жидкости, η- коэффициент внутреннего трения жидкости. Благодаря вязкости движение жидкости, как и движение газа, носит ламинарный характер. Сила F есть ни что иное, как сила трения между слоями жидкости, движущимися с различными скоростями, действующая касательно на площадь поверхности, разделяющей два соседних слоя жидкости. Коэффициент вязкости η равен касательной силе, действующей на единицу площади при градиенте скорости, равном единице.
Внутреннее трение является причиной того, что для протекания жидкости (газа) через трубу требуется некоторая разность давлений, чтобы скорость течения имела некоторое данное значение, эта разность давлений должна быть тем больше, чем больше коэффициент внутреннего трения η, то есть вязкость жидкости. Очевидно, что чем больше время «оседлой» жизни молекул, тем больше вязкость, т.е. тем меньше текучесть жидкости. С увеличением числа ξ увеличивается текучесть жидкости, т.е. уменьшается вязкость.
Каков механизм внутреннего трения в жидкостях? Можно ли считать, что он такой же, как и в газах, то есть сводится ли к переносу молекулами количества движения благодаря их хаотическому движению и столкновениям? В поисках ответа на этот вопрос мы станем на правильный путь, если учтем, что молекулы жидкости участвуют, главным образом, в колебательном движении и только время от времени совершают скачки на расстояния, не превышающие диаметра молекулы. В результате молекулы длительное время остаются в одном и том же слое. Следовательно, перенос импульса движения слоев жидкости осуществляется «оседлыми» молекулами. Время «оседлой» жизни молекул τ возрастает с уменьшением температуры, что приводит к увеличению вязкости, т.е. к уменьшению текучести жидкости. Этот результат находится в соответствии с опытными фактами. Поскольку внутреннее трение в жидкостях обусловлено молекулами, ведущими «оседлый» образ жизни на соседних слоях, механизм внутреннего трения в жидкостях иной, чем в газах. А именно, перенос импульса в жидкостях «оседлыми» молекулами, находящимися в соседних слоях, может осуществляться только за счет сил притяжения между ними, результирующая которых и дает силу сцепления – внутреннего трения между слоями.
Таким образом, такие простые рассуждения привели Френкеля к выводу о том, что коэффициент внутреннего трения жидкости η ~ 1ξ ~ τ, т.е.
63
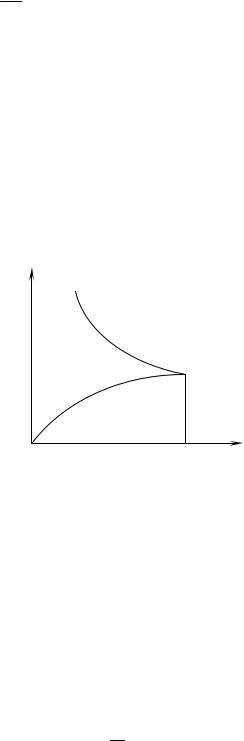
ηжидкости, меняется с температурой по закону:
η= A(T )exp ε .
kT
Первый множитель при повышении температуры T увеличивается, а второй – уменьшается. Однако первый множитель меняется с температурой гораздо медленнее, чем второй. Поэтому в не слишком широком интервале температур можно считать его постоянным и принять
|
ε |
. Эта формула называется формулой Френкеля-Андраде. Со- |
|
η = A exp |
|
|
|
|
|||
kT |
|
||
гласно этой формуле вязкость жидкости при повышении температуры уменьшается экспоненциально. Экспериментальные исследования действительно приводят к такому результату, однако только в небольшом интервале температур, что еще раз свидетельствует о приближенном харак-
тере формулы Френкеля-Андраде. |
η |
В широкой температурной |
|
области экспоненциальной зависимости |
|
не наблюдается. В общем виде |
|
температурная зависимость вязкости |
|
для вещества в жидком и газообразном |
K |
|
|
состоянии выразится так, как показано |
|
||
|
|
||
на рис.3.1. Обе кривые сливаются в |
|
|
|
точке, соответствующей критической |
|
|
|
температуре. |
характер температурной |
Tc |
T |
Разный |
Рис. 3.1 |
|
|
зависимости |
η газов и жидкостей есть |
|
|
следствие различия механизма внутреннего трения в газах и жидкостях: если в газах внутреннее трение обусловлено переносом количества движения молекулами главным образом из-за их перехода из одного слоя в другой и столкновений друг с другом, благодаря их хаотическому движению, то в жидкостях – действием межмолекулярных сил, то есть движущийся слой жидкости увлекает соседние слои в основном за счет сил сцепления между слоями как результирующая всех сил притяжения между молекулами, сидящими на соседних слоях.
Таким образом, с ростом температуры текучесть жидкости η−1 возрастает, а вязкость падает, и, как показал Френкель, вязкость жидкости об-
ратно пропорциональна коэффициенту диффузии: η ~ D1 , а в газах, как мы
видели, ηГ ~ DГ , причем D ≈ (10−4 ÷10−5 )DГ .
Бачинский еще в 1912 году пришел к выводу о том, что попытки различных исследователей аналитически выразить зависимость η от T оказа-
лись безуспешными из-за неудачного выбора независимой переменной. При выборе переменной, по мнению Бачинского, надо исходить из того,
64
что вязкость обусловлена межмолекулярными силами, а эти силы зависят от расстояния между молекулами. Следовательно, η должна быть функцией межмолекулярного расстояния. Среднее же расстояние между молекулами вещества находится в простом соотношении с его молярным объемом. Поэтому внутреннее трение в жидкости должно определятся величиной ее молярного объема. На этом основании Бачинский предложил фор-
мулу: η = VB −b , где V - молярный объем, b - постоянная, равная постоян-
ной в уравнении Ван-дер-Ваальса, характеризующая недоступную для молекул долю молярного объема, а B - постоянная Бачинского, различная для разных газов. При нагревании жидкость «разрыхляется» и возрастает ее свободный молярный объем, вследствие чего вязкость жидкости уменьшается.
При проверке формулы Бачинского ее удобно привести к виду: V = b + Bη .
Если теперь по оси абсцисс откладывать η1 , а по оси ординат – молярный
объем V , то в случае справедливости формулы Бачинского должна получится прямая линия.
Проверка этой формулы Бачинским показала, что она оправдывается в весьма широком интервале температур для очень многих жидкостей. Такое изучение вязкости жидкости позволяет экспериментально определить постоянную Ван-дер-Ваальса b и Бачинского B .
Определение коэффициента вязкости методом капиллярного вискозиметра
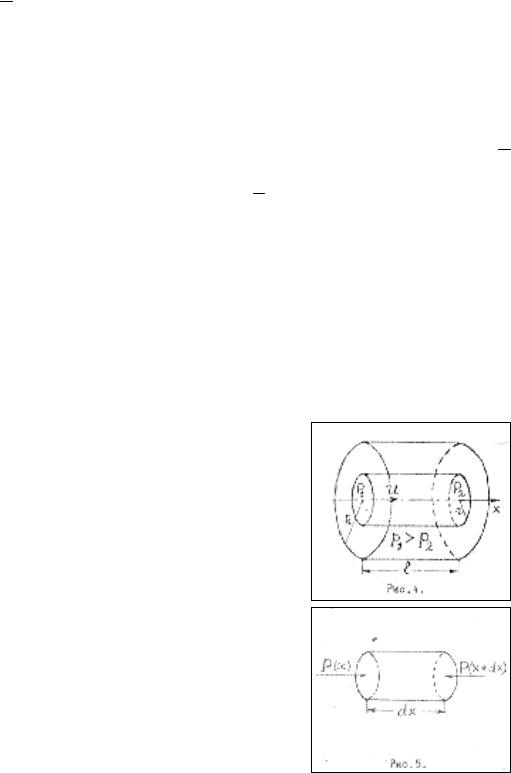
Пусть вязкая несжимаемая жидкость течет вдоль прямолинейной цилиндрической трубы (ламинарное течение) (рис.3.2). Если выделить бесконечно узкую трубку тока, то из условия не сжимаемости следует, что скорость течения ϑ будет одна и та же вдоль всей трубки. Но она, конечно, меняется с изменением расстояния r от оси трубки. Таким образом, ϑ является
функцией радиуса r , то есть ϑ = ϑ(r). Примем ось трубки за ось х,
направленную в сторону течения жидкости. Выделим в трубке произвольную бесконечно короткую цилиндрическую часть длины ∂х и радиуса r (рис.3.3). На ее боковую поверхность в направлении движения действует касательная сила внутреннего трения.
65
∂F = 2πrη∂∂ϑr ∂x .
Кроме того, на основание цилиндра в том же направлении действует сила разности давлений:
∂F1 = πr 2 [p(x)− p(x +∂x)]= πr 2 ∂∂px ∂x .
При стационарном течении сумма этих двух сил должна обращаться в нуль, а потому:
2η∂∂ϑr = r ∂∂px .
Скорость ϑ(r), а с ней и ∂∂ϑr , не меняется с изменением x . Поэтому должна быть постоянной и производная ∂∂pх , причем эта производная
должна быть равна |
p2 − p1 |
, где |
p1 – давление на входе трубы, |
p2 – на вы- |
|||||||
|
|||||||||||
|
|
|
l |
|
|
|
|
|
|
|
|
ходе, |
а l - длина трубы. |
В результате |
приходим |
к |
уравнению: |
||||||
∂ϑ = − |
(p1 − p2 ) |
r . Интегрируя, имеем: ϑ = |
p1 − p2 |
(R2 −r 2 )= − ∆p |
R2 −r 2 |
, где ∆p - |
|||||
|
|
|
|||||||||
∂r |
2ηl |
|
4ηl |
l |
4η |
|
l |
||||
градиент давления. Течение жидкости происходит против градиента давления. Следовательно, при r = 0 , то есть на оси трубы, скорость жидкости
максимальная ϑ0 = (p1 − p2 )R2 , а при удалении от оси трубы скорость тече-
4ηl
ния жидкости ϑ меняется по параболическому закону.
Подсчитаем расход жидкости, то есть количество жидкости, ежесекундно протекающее через поперечное сечение трубы. Масса жидкости, протекающая за 1с через кольцевую площадку с внутренним радиусом r и внешним r + dr , равна: dQ = 2πrdrρϑ. Подставляя сюда выражение для ϑ, и, интегрируя, находим искомый расход жидкости:
Q = ∫R dQ = πρ |
p1 − p2 |
R4 , |
|||
8ηl |
|||||
0 |
|
|
|
||
тогда |
|
|
|
|
|
∆V = Q |
= |
πR4 ∆p |
, |
||
ρ |
|
|
8η l |
|
|
за время ∆t
∆V / = ∆V∆t .
Если экспериментально определить ∆V / и ∆р, то по этой формуле (формуле Пуазейля) можно определить вязкость жидкости
η= |
πR4 |
∆p . |
(1) |
|
8∆V / |
||||
|
l |
|
Эта формула используется в методе капиллярного вискозиметра.
66

Экспериментальная установка
Прежде чем приступить к работе, необходимо изучить устройство лабораторного комплекса ЛКТ, более подробно модуль 0,5 «Автоклавмонометр», приведенный в паспорте установки ЛКТ-2. Основная часть автоклава – труба 1 с верхней и нижней полостями, соединенными круглым каналом диаметром 6мм. На трубе имеется нагревательная обмотка 2. В трубу ввернут датчик температуры 3. Полость автоклава соединена шлангом 4 с мерной трубкой 5, расположенной вдоль линейки 6, по которой отсчитываются координаты характерных точек прибора и уровня жидкости.
Координаты характерных уровней автоклава по шкале линейки: нижний край трубы h1=10мм, верхний край нижней полости h2=25мм, нижний край канала h3=30мм, верхний край канала h4=95мм, нижний торец длинного капилляра h5=100мм, верхний край трубы h6=130мм.
Площадь сечения мерной трубки S=95,03мм2, сечение верхней расширительной полости автоклава S’=6,16см2.
Схема измерения вязкости приведена на рисунке, помещенном в описании прибора ЛКТ-2. В автоклав (модуль 0.5) ввернут капиллярвискозиметр и залита жидкость до уровня h0 так, что капилляр погружен в
нее полностью. Отсасывая воздух из полости, втягивают жидкость в полость, при этом ее уровень в измерительной трубке опускается на 5-10 см ниже заданного начального уровня отчета h1 .
Пусть ∆h = h0 − h - смещение уровня жидкости в мерной трубке от равновесного положения. Перепад давлений на концах капилляра:
|
|
|
S |
|
|
∆p = ρg(h |
− h) 1 |
+ |
|
. |
(1а) |
|
|||||
0 |
|
|
S / |
|
|
Скорость протекания жидкости через капилляр диаметром d и длиной L из формулы Пуазейля определяется выражением:
∂V |
= |
|
πd 4 |
∆p . |
(2) |
|
∂t |
128Lη |
|||||
|
|
|
||||
С другой стороны:
∂∂Vt = Sdh∂t .
Приравняв выражения (2) и (3) получим дифференциальное уравнение:
∂h |
= |
|
πd 4 |
∆p , |
|
∂t |
128SLη |
||||
|
|
||||
решение которого имеет вид:
h −h0 = const exp −τt ,
где τ- постоянная времени, определяемая соотношением:
τ = η |
|
|
128SL |
|
|
|
|
4 |
|
|
S |
||
|
|
|
||||
|
πd |
|
ρg 1 |
+ |
|
|
|
|
|||||
|
|
|
|
|
S / |
|
(3)
(4)
(5)
(6)
67
Из (5) следует, что уровень жидкости в мерной трубке приближается к равновесному положению по экспоненциальному закону.
Измерив время ∆t прохождения жидкостью расстояния между уровнями h1 иh2 , найдем согласно формуле (5) постоянную времени процесса
τ = |
|
∆t |
. |
||
|
|
∆h1 |
|
||
|
|
|
|||
|
|
|
|
|
|
|
|
∆h |
|
||
|
ln |
|
|
|
|
|
|
2 |
|
|
|
Тогда вязкость жидкости определится выражением
η= τ |
πd 4ρg(1+ S / S′) . |
(7) |
|
128 S L |
|
Порядок выполнения работы:
Перед началом эксперимента лаборант должен залить в автоклав воду до уровня h0 = h4 +10мм =105мм по шкале линейки (при этом капилляр
будет погружен в жидкость полностью) и ввернуть капилляр-вискозиметр
вверхнюю часть автоклава.
1.Зарегистрируйте уровень h0 жидкости в мерной трубке. Соедините
штуцеры капилляр-вискозиметра с двумя кранами блока №2. К одному из кранов присоедините шланг резиновой трубки, второй кран перекройте.
2.Отсасывая грушей воздух из верхней полости автоклава, добейтесь опускания жидкости в мерной трубке на уровень 10мм и перекройте кран,
ккоторому подключена груша.
3.Откройте второй кран и определите с помощью секундомера интервал времени ∆t , в течение которого жидкость пройдет расстояние от уровня h1 до выбранного конечного уровня h2 .
4.Познакомьтесь с измерительной системой ИСТ-3 для изменения и измерения температуры жидкости.
5.Проведите вышеуказанные измерения при различных температурах и полученные результаты внесите в таблицу 3.4.
6.По формуле (7) рассчитайте коэффициент вязкости при данной температуре. Постройте график зависимости коэффициента вязкости от температуры. Оцените погрешность определения η.
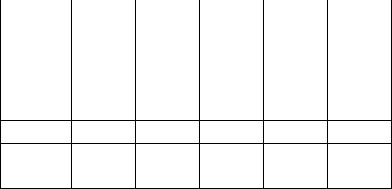
Таблица 3.4.Результаты эксперимента
T0C |
20 |
27 |
47 |
67 |
87 |
h0 , мм |
|
|
|
|
|
h1 , мм |
|
|
|
|
|
h2 , мм |
|
|
|
|
|
∆t , с |
|
|
|
|
|
τ,с
η, ×10-4
Па·с
68
ЛАБОРАТОРНАЯ РАБОТА №4
ДИФФУЗИЯ ГАЗА В ВОЗДУХЕ
Цели работы:
1.Ознакомление с методами изучения свойств тел, связанных с тепловым движением молекул.
2.Исследование явления диффузии в газах и определение коэффициента диффузии.
Теория метода
Все материальные тела состоят из обособленных малых частиц (атомов, молекул), взаимодействующих между собой по определенным законам и соответствующим образом движущихся. Сами атомы и молекулы можно представить различными моделями в зависимости от обстоятельств и характера рассматриваемых явлений. В одних случаях их можно считать материальными точками, в других – абсолютно твердыми материальными телами, в-третьих, – необходимо принять во внимание их внутреннюю структуру и внутреннее движение. Таким образом, любое тело представляет собой систему многих частиц, наиболее простой моделью, которой является идеальный газ. По определению, это газ, состоящий из материальных частиц с конечной массой, между которыми отсутствуют силы, действующие на расстоянии, и которые сталкиваются между собой по закону соударения абсолютно твердых шаров. Законы, описывающие поведение идеального газа, достаточно хорошо описывают поведение и свойства реальных газов при нормальных или не сильно отличающихся от них условиях.
Систему многих частиц можно рассматривать без детального знания механизма их движения, пользуясь только макроскопическими параметрами, т.е. величинами, характеризующими систему в целом, но не имеющими смысла в применении к отдельным частицам. К таким величинам относятся, например, давление и температура. При этом теория строится на некоторых общих положениях и законах (к таким относятся, например, закон сохранения энергии), справедливых всегда, независимо от характера движения частиц и типа взаимодействия между ними. Метод, использующий такой подход, называется термодинамическим.
Другой метод называется статистическим и основан на том, что для описания системы многих частиц информация о ней должна иметь обобщенный характер и относиться не к отдельным частицам, а ко всему их множеству. В этом методе теория истолковывает свойства тел через суммарный результат действия огромного числа частиц, пользуясь лишь такими величинами, которые характеризуют движение совокупности частиц, не интересуясь при этом движением их в отдельности. Для идеально-
69
го газа, например, используют такие величины, как средняя длина свободного пробега молекул, среднее число их столкновений, средняя квадратичная скорость молекул и т.д.
Статистический и термодинамический методы изучения свойств тел, в основе которых лежат молекулярные явления, дополняют друг друга. Термодинамический метод характеризуется своей общностью и позволяет изучать явление без знания их внутренних процессов и механизмов. Статистический метод дает возможность понять суть явлений и увязать поведение тела в целом с поведением и свойствами составляющих его молекул.
Рассмотрим кинематические характеристики молекулярного движения в газах.
σ = πd 2 |
(1) |
называется эффективным сечением молекулы или сечением столкнове-
ний. Среднее расстояние, которое проходит молекула между двумя последовательными столкновениями, называется средней длиной свободного пробега. Средняя длина свободного пробега и связанная с ней частота столкновений (среднее число столкновений, испытываемых молекулой за единицу времени) являются главными характеристиками столкновений молекул в газе.
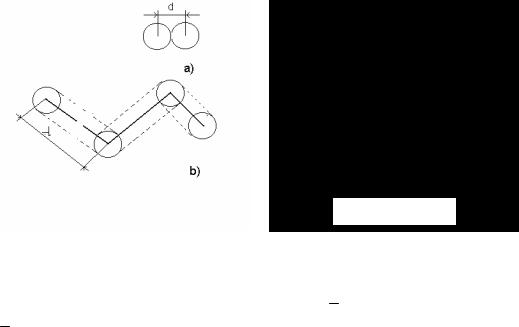
Величина средней длины свободного пробега молекул взаимосвязана с величиной эффективного диаметра. Для выявления этой взаимосвязи рассчитаем частоту столкновений, испытываемых молекулой газа. Будем считать газ идеальным. Тогда его молекулы при столкновениях ведут себя как абсолютно упругие шары диаметром d . Проследим за движением одной из молекул, предположив вначале, что все остальные молекулы застыли неподвижно на своих местах. Движущаяся молекула, столкнувшись об одну из неподвижных молекул, будет лететь прямолинейно, пока не столкнется с какой-нибудь другой неподвижной молекулой. Это столкновение произойдет в том случае, если центр неподвижной молекулы окажется расположенным от прямой, вдоль которой летит молекула, на расстоянии не большем, чем эффективный диаметр молекулы. В результате столкновения молекула изменит направление своего движения, после чего неко-
торое время опять будет двигаться прямолинейно, пока на её пути не встретится молекула, центр которой будет находиться в пределах цилиндра с радиусом основания d . (Рис.3.4b).
При средней скорости движения молекулы ϑ за время τ она проходит путь ϑτ. Число происходящих за это время соударений с неподвижными молекулами равно количеству молекул, центры которых попадают
70
