
методичка по молекулярке
.pdf
Обозначим через T1 абсолютную температуру окружающего воздуха, через p1 - давление газа внутри сосуда, соответствующее показанию ма-
нометра h1 , тогда ясно, что: |
|
p1 = p0 + h1 , |
(3.1) |
где p0 - атмосферное давление (конечно, при этом h1 и p0 |
должны быть вы- |
ражены в одинаковых единицах). Эти два параметра T1 и |
p1 характеризуют |
состояние газа, которое мы назовем первым состоянием газа (состояние 1: T1 ,
p1 ).
Если теперь быстро открыть кран, то воздух в сосуде будет быстро расширяться, пока давление его не сделается равным p0 , этот процесс бу-
дет близок к адиабатическому, и при этом воздух охладится до температуры T2 , это будет вторым состоянием газа (состояние 2: T2 , p0 ). Если сразу
после сравнивания уровней жидкости в манометре снова закрыть кран, то давление внутри сосуда начнет нарастать вследствие того, что охладившийся при расширении воздух в сосуде снова станет нагреваться за счет теплообмена через теплопроводящие стенки сосуда с окружающей средой. Возрастание давления прекратится, когда температура воздуха в сосуде сравняется с внешней температурой T1 . При этом давление воздуха в бал-
лоне будет p2 . Это будет третьим состоянием газа (состояние 3: T1 , |
p2 ). |
Обозначим показания манометра через h2 . Тогда очевидно: |
|
p2 = p0 + h2 . |
(3.2) |
Так как переход от состояния 2 к состоянию 3 произошел без изме- |
|
нения объема, то мы вправе применить для этого процесса закон гейлюссака:
|
p2 |
= |
p0 |
. |
(3.3) |
|
|
|
|||
|
Т1 |
Т2 |
|
||
К процессу адиабатического расширения, т.е. К переходу воздуха из |
|||||
состояния 1 к состоянию 2, может быть применен закон пуассона, (т.к. Он почти адиабатический), который удобно написать в следующем виде:
pγ−1 |
= |
pγ−1 |
, |
|
1 |
0 |
|||
Т1γ |
Т2γ |
|||
|
|
Где γ отношение удельных теплоемкостей газа при постоянном давлении
и постоянном объемеCp . Подставляя сюда значения p1 из уравнения (3.1)
CV
и преобразовав получим:
|
+ h1 |
γ−1 |
|
γ |
|||
|
p0 |
|
= |
T1 |
|
||
|
|
|
|||||
|
p |
0 |
|
T |
|
||
|
|
|
2 |
|
|||
Или
21
|
|
|
|
|
|
h1 |
γ−1 |
|
T1 −T |
γ |
|
|
|
|
|
|
+ |
|
|
|
|||
|
|
|
|
P |
T |
||||||
|
|
|
|
1 |
|
= |
+1 . |
||||
|
h1 |
|
|
|
0 |
|
|
2 |
|
||
Так как |
и |
T1 −T2 |
- величины малые по сравнению с единицей, то |
||||||||
|
|||||||||||
|
p |
0 |
|
T |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
||
разлагая оба двучлена по биному ньютона и ограничиваясь членами первого порядка малости, получим:
|
|
|
|
1+ (γ −1) |
h1 |
|
=1+ γT1 −T2 . |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
p |
0 |
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
Откуда: |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||||
|
|
T1 −T2 |
|
|
γ −1 |
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
p |
|
|
|
= |
h . |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
0 |
|
T |
|
|
|
|
|
|
γ |
1 |
|
|
|
|
|
|||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Но выражение, стоящее в левой части уравнения, есть ничто иное, |
|||||||||||||||||||||||
как h2 . Действительно, подставим в уравнение (3.3) значение |
p2 из урав- |
||||||||||||||||||||||
нения |
|
|
(3.2) и разрешим |
|
его |
|
|
относительно |
h2 . |
|
Тогда |
получим: |
|||||||||||
h = p |
0 |
|
T1 −T2 |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2 |
|
T2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
γ −1 |
|
|
|
|
||
Следовательно, можно |
|
написать, что |
h = |
h . |
Откуда оконча- |
||||||||||||||||||
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
γ |
1 |
|
|
|
тельно получим: |
|
|
|
|
|
|
|
|
h1 |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
γ = |
|
|
|
|
. |
|
|
|
|
|
|
(3.4) |
||||
|
|
|
|
|
|
|
h |
−h |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
||||
Порядок выполнения работы
1.Закройте кран в и при помощи насоса нагнетите воздух в сосуд. Когда разность уровней воды в манометре достигает 15-20см (для этого надо сделать приблизительно 3-4 качка) прекратите нагнетать воздух.
2.После этого, когда давление установится, произведите первый отсчет разности уровней в манометре h1 . Поворотом крана в соедините сосуд а с атмосферой, затем снова изолируйте его от атмосферы, закрыв кран. Рекомендуется закрывать кран тотчас же после прекращения шипения, создаваемого выходящим воздухом. При этом давление в баллоне равно атмосферному p0 (уровни жидкости в манометре равны).
3.После установления давления в закрытом сосуде произведите второй отсчет разности уровней в манометре h2 .
4.Опыт повторите не менее 10 раз, измеряя в каждом случае величины h1 и h2 . Результаты измерений занесите в таблицу.
22
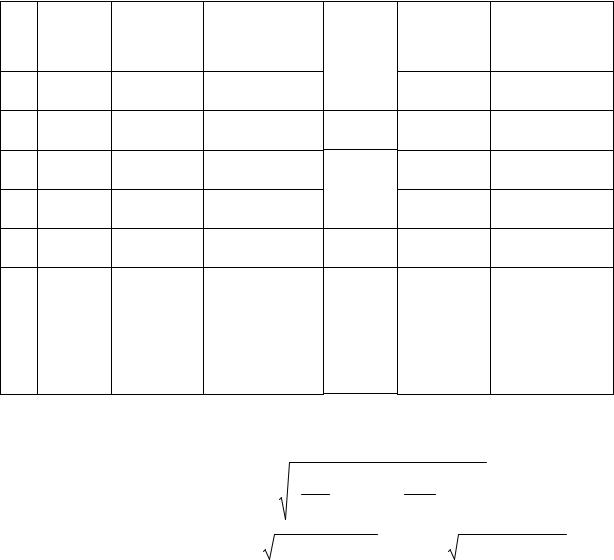
Таблица 1.2. Результаты эксперимента
№ |
h1 |
, мм |
|
−h, мм |
( |
|
−h)2 |
, мм2 |
h2 |
, мм |
|
− h, мм ( |
|
− h)2 |
, мм2 |
|
h |
||||||||||||||||
h |
h |
h |
||||||||||||||
|
|
1 |
1 |
|
|
2 |
2 |
|
||||||||
1
2
3
…
10
|
|
|
|
10 |
|
|
|
|
|
|
|
|
10 |
|
|
|
|
- |
|
|
- |
∑( |
|
|
−hi )2 |
= |
|
|
= |
- |
∑( |
|
|
−hi )2 |
= |
h1 = |
h1 |
h2 |
h2 |
||||||||||||||
|
|
|
|
i=1 |
|
|
|
|
|
|
i=1 |
|
|
||||
5.Вычислите относительные и абсолютные ошибки по методике обработки результатов косвенных измерений
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
∂γ |
2 |
|
∂γ |
2 |
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|||||||||||
|
γ = |
|
|
|
|
|
|
|
|
|
; ∆γ = |
|
|
|
|
|
|
|
|
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
h 1−h2 |
|
∂h1 |
∆h1 |
+ |
∂h 2 |
∆h 2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
γ = γ ± ∆γ, |
ε |
γ |
= ∆γ |
, |
∆h = ∆h2 |
|
+ ∆h2 |
, ∆h = ∆h2 |
|
+ ∆h2 . |
|||||||||||
|
|
|
|
|
γ |
|
|
1 |
1сл |
|
1сист |
|
2 |
2сл |
2сист |
||||||
23
ЛАБОРАТОРНАЯ РАБОТА №4
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ВНУТРЕННЕГО ТРЕНИЯ И ДЛИНЫ СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ ВОЗДУХА
Приборы и принадлежности: капилляр, аспиратор, жидкостный манометр, сообщающийся сосуд к аспиратору, секундомер.
Цели работы:
1.Изучение основ механики газов;
2.Экспериментальное определение коэффициента внутреннего трения и длины свободного пробега молекул воздуха.
Теория метода
При ламинарном и стационарном течении жидкости или газа количество вещества (газа) V , прошедшего через цилиндрическую трубку длиной l и радиуса r за время τ, выражается формулой Пуазейля:
|
πr4 |
|
|
V = |
|
∆pτ, |
(4.1) |
|
|||
|
8ηl |
|
|
где ∆p - разность давлений на концах цилиндрической трубки или капилляра, η - коэффициент внутреннего трения (вязкости).
В формуле (4.1) все величины, кроме η, непосредственно измеряемы. В работе эта формула используется для вычисления коэффициента вязкости воздуха.
Коэффициент вязкости связан со средней длиной свободного пробега молекул газа λ выражением
η = 1 |
|
|
vρ, |
(4.2) |
||
λ |
||||||
|
3 |
|
|
|
|
|
где ρ - плотность газа, v - среднеарифметическая скорость. |
|
|||||
Из закона Максвелла можно получить выражение для средней ариф- |
||||||
метической скорости в виде: |
|
|
|
|
|
|
v = |
8RT , |
(4.3) |
||||
|
|
πµ |
|
|||
где T - температура газа, R - универсальная газовая постоянная, |
µ - мо- |
|||||
лярная масса газа. |
|
|
|
|
|
|
Из уравнения Менделеева-Клапейрона следует |
|
|||||
ρ = |
µp |
, |
(4.4) |
|||
|
||||||
|
|
RT |
|
|||
где p - давление газа.
24
Используя формулы (4.2)-(4.4), можно вычислить λ, если предварительно по формуле (4.1) опытно определить коэффициент внутреннего трения газа:
λ = |
1.86η |
RT . |
(4.5) |
|
p |
µ |
|
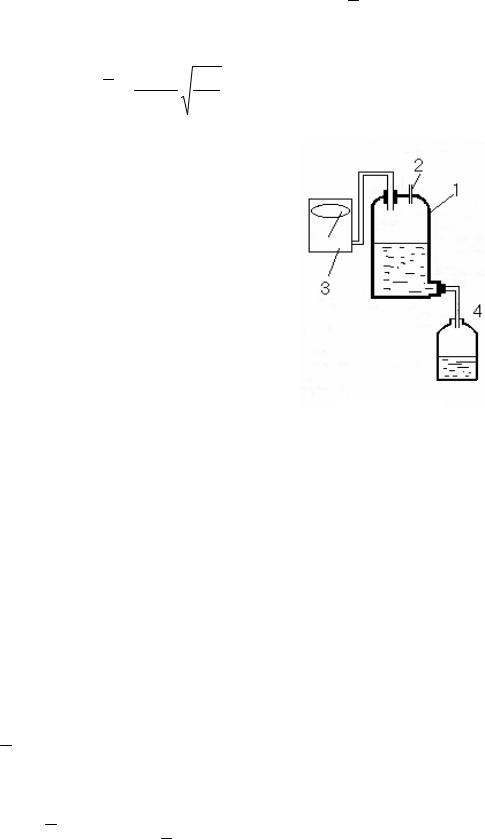
Описание установки
В работе определяется коэффициент вязкости
воздуха |
(µ = µвоз. ) при атмосферном давлении |
p = pатм |
и комнатной температуре Т =Ткомн. . Для |
этого применяется установка, изображенная на рисунке 4.1. При выливании воды из аспиратора 1 давление в нем понижается и через капилляр 2 засасывается воздух. Вследствие внутреннего трения давление на концах капилляра одинаковое. Разность давления измеряется манометром 3. Из формулы Пуазейлядля η получаетсявыражение:
η = |
πr4 |
∆pτ |
, |
(4.6) |
Рис. 4.1 |
8Vl
где r - радиус капилляра, l - длина капилляра, τ
- время вытекания воды из аспиратора, V - объем вытекшей из аспиратора воды за время τ; r и l в работе известны; V измеряется по делениям, нанесенным на аспираторе; τ измеряется секундомером.
Порядок выполнения работы
1.Определите атмосферное давление по барометру, по термометру - температуру в лаборатории. Выпишите значения радиуса и длины капилляра.
2.Аспиратор наполните водой.
3.Начните выпускать воду из аспиратора.
4.Выждав, пока установится стационарное течение жидкости (при этом на манометре ∆p постоянно), включите секундомер.
5.Определите время вытекания 1-1,5л воды, вычислите по формулам (4.5)
и (4.6) η и λ.
6.Измерения проведите не менее пяти раз. По результатам измерений и вычислений подсчитайте погрешности. Окончательный результат запишите в виде: λ = λ ±∆λ, ελ = ∆λλ 100%; η = η± ∆η, εη = ∆ηη 100%.
25
ЛАБОРАТОРНАЯ РАБОТА №5
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ДИФФУЗИИ ПАРОВ ВОДЫ В ВОЗДУХЕ МЕТОДОМ ГОРИЗОНТАЛЬНОЙ ТРУБКИ
Приборы и принадлежности: стеклянная трубка диаметром меньше 1мм, микроскоп "МИР-2", секундомер, жидкость.
Цели работы:
1.Изучение явлений переноса в газах;
2.Экспериментальное определение коэффициента диффузии паров воды в воздухе.
Теория метода
Известно, что скорость испарения жидкости при Τ = const зависит от диффузии паров жидкости в воздухе. Зная изменение массы жидкости вследствие испарения за какой-то промежуток времени, мы можем определить коэффициент диффузии па-
ров жидкости в воздухе. Для этого запишем уравнение Фика:
|
|
|
|
|
|
|
|
Г = |
N |
|
= −D ∆n |
. |
(5.1) |
||||||||||
|
|
|
|
|
|
|
S∆t |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆l |
|
|
|||||||
|
|
|
|
Разделим обе части уравнения (1) на число Авогадро N A : |
|||||||||||||||||||
|
|
|
|
|
|
|
|
N |
|
= D |
|
|
∆n |
|
, |
(5.2) |
|||||||
|
|
|
|
|
|
|
|
NAS∆t |
NA∆l |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
но |
|
|
N |
= ν - число молей водяного пара, а |
∆n |
= ∆ν |
, где n - концентрация |
||||||||||||||||
|
|
|
|
|
|||||||||||||||||||
|
|
|
NA |
|
|
|
|
|
|
|
|
|
|
|
|
NA |
V |
|
|||||
молекул водяного пара. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
Учтя это, запишем выражение (5.2) в следующем виде: |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
ν |
|
= −D |
|
∆ν |
. |
|
(5.3) |
|||||||
|
|
|
|
|
|
|
|
|
S∆t |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
V∆l |
|
|
|||||||||
|
|
|
|
Умножим обе части выражения (5.3) на массу моля µ водяного пара: |
|||||||||||||||||||
|
µν |
|
= −D µ∆ν , или |
M |
= −D ∆ρ , где ρ = |
µν = |
M - |
плотность пара, отсю- |
|||||||||||||||
|
S∆t |
|
S∆t |
||||||||||||||||||||
|
|
|
V∆l |
∆l |
|
|
|
|
V |
V |
|
||||||||||||
да |
|
|
|
|
|
M = −D ∆ρ S∆t |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
(5.4) |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∆l |
|
|
|||||||
26

масса паров воды, переносимая за счет диффузии через площадку S (поперечное сечение трубы) за время ∆t . Эта масса равна массе воды, испарившейся за время ∆t . Поэтому М = ρЖ∆xS , тогдавыражение(5.4) запишется так:
ρЖ∆xS = −D ∆∆ρl S∆t .
Откуда коэффициент диффузии:
D = |
ρЖ∆x |
. |
||
|
||||
|
− |
∆ρ |
∆t |
|
|
∆l |
|||
|
|
|
|
|
Найдем значение градиента плотности ∆∆ρt паров воды:
− ∆∆ρl = ρ2 l−ρ1 .
Подставим его в выражение (5.5). Тогда окончательно:
D = |
ρЖ∆xl |
, |
||
(ρ |
2 |
−ρ )∆t |
||
|
|
1 |
|
|
где ρЖ - плотность жидкости при комнатной температуре,
(5.5)
(5.6)
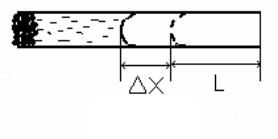
∆х - расстоя-
ние, на которое перемещается уровень жидкости вследствие испарения и диффузии за время ∆t (см. рисунок 5.1), l - расстояние от открытого конца стеклянной трубки до уровня жидкости в начале опыта (т.е. до включения секундомера), ρ2 - плотность насыщенного пара при точке росы, т.е.
абсолютная влажность, а ρ1 - плотность насыщенного пара при комнатной температуре.
Порядок выполнения работы
1.Установите трубку горизонтально, предварительно заполнив ее исследуемой жидкостью. Заполнять ее следует следующим образом: опустить одним концом в сосуд с жидкостью и дождаться момента, когда трубка
заполнится до уровня, расположенного от другого конца трубки на расстоянии l =1−1,5см (см. рисунок 5.1).
2.С помощью микроскопа измерьте точно это расстояние l.
3.Включите секундомер. Секундомер выключите тогда, когда будет заметно значительное смещение уровня жидкости (на расстояние ∆х).
4.Абсолютную влажность ρ2 определите при помощи психрометра.
5.Плотность насыщенного пара при комнатной температуре ρ1 определяется по таблице.
6.Плотность исследуемой жидкости ρЖ находится по таблице при комнатной температуре.
27

ЛАБОРАТОРНАЯ РАБОТА №6
ОПРЕДЕЛЕНИЕ КРИТИЧЕСКОЙ ТЕМПЕРАТУРЫ ЭТИЛОВОГО ЭФИРА
Приборы и принадлежности: запаянная стеклянная ампула с эфиром, нагреватель, автотрансформатор, термопара, милливольтметр.
Цели работы:
1.Изучение основ теории критических явлений;
2.Изучение свойств реальных газов;
3.Экспериментальное определение критической температуры этилового эфира.
Теория метода
Для каждого вещества существует состояние, называемое критическим. Вещество находится в критическом состоянии только в том случае, если его объем, давление и температура равны критическим значениям этих величин. Каждое чистое вещество имеет определенные значения критических параметров. Так, например, этиловый эфир проходит через кри-
тическое состояние при давлении p = 35,5атм, температуре Tкр =193,80 С.
В критическом состоянии плотности жидкости и насыщенного пара равны, коэффициент поверхностного натяжения и удельная теплота перехода в пар становятся равными нулю.
Критической температурой вещества называется температура, при которой и выше которой невозможно существование равновесной двухфазной системы жидкость - пар. В настоящее время понятие о критическом состоянии вещества продолжает развиваться и уточняться.
Представление об изменении состояния вещества можно иллюстрировать семейством экспериментальных изотерм, представленных на рисунке 6.1. Изотерма ZKM выражает зависимость давления от объема при критической температу-
28
ре и называется критической. Точки, лежащие внутри параболы NKP, соответствуют двухфазным состояниям вещества (жидкость - насыщенный пар). При давлениях и объемах, которым соответствуют точки ветви параболы КСР (за исключением точки К), вещество будет находиться в состоянии насыщенного пара.
При давлениях и объемах, соответствующих точкам ветви параболы KBN (за исключением точки К) и точкам слева от этой ветви и ниже участка KZ критической изотермы, вещество будет находиться в жидком состоянии. Точки, расположенные справа от ветви параболы КСР и ниже участка критической изотермы КМ, соответствуют состояниям ненасыщенного или перегретого пара. Точка К называется критической точкой. Она соответствует критическому состоянию вещества. Следует подчеркнуть, что критическое состояние является одним из бесчисленного множества состояний при критической температуре. Ему соответствуют критические параметры pкр , Tкр , Vкр . Любая точка критической изотермы, за ис-
ключением точки К, соответствует состоянию вещества при критической температуре, но не критическому состоянию.
В точке К удельный объем (объем единицы массы) жидкости равен удельному объему насыщенного пара, следовательно, равны и их плотности, следовательно, в критическом состоянии вещества исчезает всякая разница между жидкостью и паром, т.е. в критическом состоянии жидкость и пар становятся по своим свойствам тождественными. Однако, правильнее говорить не о жидкости и не о паре, поскольку в критическом состоянии нет ни жидкости, ни пара, а об особом состоянии вещества, в котором оно обладает рядом особых свойств, присущих веществу только в критическом состоянии. Наглядно критическое состояние вещества можно представить как насыщенный пар вещества, в котором взвешено огромное количество мельчайших частиц жидкой фазы данного вещества. Наблюдать переход вещества через критическое состояние можно при нагревании жидкости в запаянной стеклянной ампуле, если перед запаиванием ампулы удалить из нее воздух (путем кипячения налитой жидкости) и обеспечить равенство объема ампулы и критического объема массы вещества, залитого в ампулу.
Описание установки
В данной работе проводится наблюдение за прохождением этилового эфира в запаянной стеклянной ампуле через критическое состояние и находится среднее значение температур исчезновения и появления мениска. Это среднее значение можно принять за значение критической температуры. При этом всегда нужно помнить о том, что данный метод пригоден лишь для получения приближенных значений критических температур. Схема экспериментальной установки дана на рисунке 6.2. Запаянная стеклянная ампула А с эфиром в защитном кожухе помещена на электриче-
29
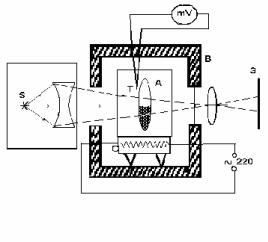
скую печь С. Напряжение на электропечь подается из сети переменного тока и может меняться с помощью автотрансформатора.
Температура этилового эфира измеряется термопарой Т, которая касается ампулы на уровне мениска. В цепь термопары включается милливольтметр. По графику градуировки термопары находят критическую температуру, соответствующую зафиксированному показанию милливольтметра. В передней и задней стенках защитного кожуха В имеют-
ся застекленные окна для наблюдения за ампулой в процессе нагрева. Убедившись, что экспериментальная установка в порядке, включают
автотрансформатор при нулевом положении указателя в сеть переменного тока. Затем подают напряжение.
Начиная с температуры 1700 С, непрерывно наблюдают за положением и видом мениска в ампуле. Определив температуру исчезновения мениска, устанавливают указатель автотрансформатора на нуль и наблюдают за явлениями в ампуле. Определяют температуру появления мениска в ампуле по соответствующему показанию милливольтметра.
Снова подают на нагреватель напряжение и повторяют наблюдения. Замечание. После включения нагревателя не разрешается открывать крышку кожуха. Давление этилового эфира в ампуле при нагревании по-
вышается и при критической температуре достигает 35,5атм.
Порядок выполнения работы
1.Определите температуру исчезновения и появления мениска в ампуле (три раза). Обработайте результаты измерений.
2.Определите критическую температуру этилового эфира (три раза), наблюдая за прохождением этилового эфира через критическое состояние (по наблюдению появления густого тумана). Обработайте результаты измерений.
3.Сравните приближенные значения критической температуры, полученные двумя методами между собой и с ее табличным значением. Выразите разницу в процентах.
4.Оцените среднюю абсолютную и среднюю относительную ошибки измерений критической температуры.
5.Оценить погрешность измерения критической температуры, обусловленную приборной погрешностью.
Внимание. Не превышайте показания милливольтметра деления "40".
30
