
6 курс / Медицинская реабилитация, ЛФК, Спортивная медицина / O'Brajen_B_Mikrososudistaya_vosstanovitel'naya_xirurgiya_Medicina
.pdfClodius L., Wirth W. A new experimental model for chronic lymphoedema of the extremities (with clinical considerations). Chirurgia Plastica (Berl) 2, 115, ff, 1974.
Cockett A. T. K., Goodwin W. E. Chyluria: Attempted surgical treatment by lymphaticvenous anastomosis.. Journal of Urology, 1962, 88, 566— 568.
Danese C, Georgalas-Bertakis M., Morales L. A model of chronic post-sur gical 'lymphoedema in dogs limbs. Surgery, 1968, 64, 814—820.
Degni M. Personal communication, 1975.
.Dobson J. In John Hunter, 1969, pp. 311. Edinburgh & London: E & S Livingstone.
Drinker С, K. The Lymphatic System... Stanford University, California; Stanford University Press, 1942.
Edwards J. M., Kinmonth J. B. Lymphovenous shunts in man. British Jour nal of Surgery, 1969, 56, 699.
Firica A., Ray A., Murat J. Les anastomoses lymphoveineuses etude experimentale. Lyon Chirurgical, 1969, 65, 384—389..
Gilbert A., O'Brien B. McC, Vorrath J. W., Sykes P. J., Baxter, Thelma J.
Lymphaticovenous |
anastomosis by microvascular technique. British |
||
Journal of Plastic Surgery. In Press, 1976. |
|
||
Handley W. S. Lymphangioplasty. Lancet, i, 1908, 783—785. |
|
||
Kinmonth |
J. B. The |
Lymphatics: Diseases, Lymphography and Surgery. |
|
Baltimore: Williams & Wilkins, 1972. |
|
||
Laine J. B.., Howard J. M. Experimental lymphaticovenous |
anastomosis |
||
Surgical Forum, 1963, 14, 111—112. |
|
||
Mistilis S. |
P., Skyring |
A. P. Intestinal lymphangiectasia. Therapeutic ef |
|
fect of lymphovenous anastomosis. American Journal of Medicine, 1966, |
|||
40, 634—641. |
|
|
|
Neyazaki Т., Kupic E. A., Marshall W. H., Abram H. L. Collateral lympha- tico-venous communications after experimental obstruction of the tho racic duct. Radiology, 1965, 85, 423—432.
Nielubowicz J., Olszewski W. Surgical lymphaticovenous shunts in patients with secondary lymphoedema British Journal of Surgery, 1968, 55, 440-442.
Ohara I., Taneichi N. Lymphaticovenous anastomosis in a case with prima
ry lymphoedema tarda. Angiology, 1973, 24, 668—674. |
|
|||
Pentecost B. L., Burn J. I., Davies A. J., Calnan J. S. A |
quantitative study |
|||
of lymphovenous communications in the dog. British Journal of Sur |
||||
gery, 1966, 53, 630—634. |
|
|
|
|
Politowski M., |
Bartkowski S., Dynowski J. |
Treatment |
of |
lymphoedema of |
the limbs |
by lymphatic-venous fistula. |
Surgery, |
1969, 66, 639—643. |
|
Rivero O. R„ Calnan J. S., Reis N. D., Mercurius Taylor L. Experimental peripheral lymphovenous communications. British Journal of Plastic Surgery, 1967, 20, 124—133.
Rouviere H., Valette G. Physiologie du Systeme Lymphatique. Paris: Masson, 1973.
Rusznyak I., Foldi M., Szabo G. Lymphatics and Lymph Circulation. London: Pergamon Press, 1967.
Sedlacek J. Lymphovenous shunt as supplementary treatment of elephantia sis of lower Limbs. Acta Chirurgia Plastica, 1969, 11, 157—162.
Stoll B. A., Andrew J. T. Radiation-induced peripheral neuropathy. British Medical Journal, 1966, i, 834—837.
Stone E. ]., Hugo N. E. Lymphoedema. Surgery, Gynaecology and Obstet rics, 1972, 135, 625-631.
Threefoot S. A., Kossover M. F. Lymphaticovenous communication in man. Archives of Internal Medicine, 1966, 117, 213—223.
Yamada Y. Studies on lymphatic venous anastomosis in lymphoedema Nagoya Journal of Medical Science, 1969, 32, 1—21.
14. МИКРОСОСУДИСТАЯ СВОБОДНАЯ ПЕРЕСАДКА КОСТЕЙ И СУСТАВОВ
МИКРОСОСУДИСТАЯ СВОБОДНАЯ ПЕРЕСАДКА КОСТИ
Микрососудистый свободный костный трансплантат за бирается полностью со своего места и одномоментно пересажи вается на отдаленное место с обеспечением жизнеспособности за счет формирования микрососудистых анастомозов. Свобод ный костный трансплантат, в отличие от микрососудистого трансплантата, не имеет достаточного кровоснабжения и вслед ствие неадекватной реваскуляризации множество костных клеток погибает, приводя к значительному рассасыванию трансплантата. Выживают немногие поверхностные клетки, получающие питание из окружающих тканей и этим поддер живающие свою остеогенную способность.
В экспериментальных условиях были успешно пересажены трансплантаты из ребер и болынеберцовой кости с наложением микрососудистых анастомозов. В клинической практике для реконструкции с успехом применялись ребра и малоберцовая кость во многих случаях, а недавно был пересажен трансплан тат из гребня подвздошной кости в сочетании с микрососуди стым свободным паховым лоскутом (O'Brien et al., 1976) и зад ний сегмент ребра с покрывающей его кожей (Buncke, 1975).
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Микрососудистый свободный трансплантат из ребра
Микрососудистый реберный трансплантат был исполь зован для замещения дефекта нижней челюсти у собак (McCullough, Fredrickson, 1973; Ostrup, Fredrickson, 1974). Брали задний сегмент IX ребра вместе с межреберной мышцей и плев рой. У 10 собак задние межреберные сосуды были анастомозированы с сосудами языка, при этом у 8 был получен хороший результат. Из 6 контрольных животных, которым производи лась пересадка без микрососудистых анастомозов, только у одного реберный трансплантат остался жизнеспособным. Эти результаты оценивались не только на основании общеклиниче ских и патологоанатомических данных, но также на основании рентгенологических, гистологических и радиоизотопных иссле-
21* |
323 |

Рис. 14.1А. Изолированный сегмент болынеберцовой кости собаки на питающих сосудах.
дований. Эти реберные трансплантаты перфузировали, хотя перфузия считается необязательной при пересадках других тканей.
МсКее (1975) в конце 60-х годов выполнил большую экспе риментальную работу по пересадке микрососудистых костных трансплантатов, но она до сих пор не опубликована.
Была показана возможность замещения лучевой кости у собаки с помощью микрососудистого реберного трансплантата (Hayhurst, 1974). Ребро было смоделировано наподобие нор мальной лучевой кости. Проходимость микрососудистых ана стомозов подтверждалась ангиографически.
Микрососудистый свободный трансплантат из болынеберцовой кости
У собак производили ортотопическую пересадку боль ших сегментов болынеберцовой кости с наложением микросо судистых анастомозов, используя передние большеберцовые сосуды (Haw et al., 1976).
Малоберцовая кость собак не подходит в качестве донор ской, так как она имеет непостоянную систему кровоснабжения.
Т е х н и к а о п е р а ц и и (рис. 14.1)
У собак средней массы проводили обезболивание внут ривенным введением нембутала. Брили кожу в области таза и конечностей и обрабатывали йодом. На всех этапах соблюдали
324

Рис. 14.1В. Тот же сегмент большеберцовой кости, полностью мобили зованный на сосудистой ножке. Ножка затем была пересечена.
Рис. 14.1С. Костный трансплантат пересажен ортотопически и укреплен с помощью металлической пластинки. Отчетливо видно отверстие в костном трансплантате, расположенное справа от места остеотомии.
строгую хирургическую асептику. Делали разрез, проходящий от головки малоберцовой кости по наружному краю большебер цовой кости вниз до того места, где болынеберцовую кость пересекает большая подкожная вена. Краниальную болынебер цовую мышцу (передняя большеберцовая у людей) отсекали вверху от ее прикрепления к кости, а последующее выделение облегчали посредством пересечения сухожилия длинного раз-
325

Рис. 14.1D. Питающие сосуды костного трансплантата анастомозиро-
Рис. 14.1Е. Отверстие для шурупа в костном трансплантате заполнено кровью, что свидетельствует о восстановлении кровообращения в транс плантате.
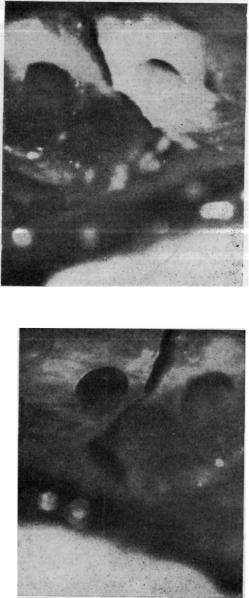
Рис. 14.IF. На питающие сосуды наложен сосуди стый зажим, и сразу ис чезла кровь из отвер стия в трансплантате.
Рис. 14.1G. При снятии со судистого зажима правое отверстие для шурупа в костном трансплантате
вновь заполнилось кровью.
гиоателя пальцев. Затем весь мышечный массив оттягивали кнаружи. Обнажали краниальную болынеберцовую артерию и сопровождающие ее вены, которые располагались на длинном разгибателе пальцев. В большинстве случаев (80%) эта арте рия отдает ветвь — артерию питающую кость, на уровне бугор-
327
ка большеберцовой кости и ее сопровождает питающая кость вена. В остальных 20% случаев питающая кость артерия отходит от каудальной большеберцовой артерии, проходя рядом с большеберцовой костью по нижней поверхности длинного сгибателя большого пальца. Здесь она идет вместе с питающей кость веной, которая всегда впадает в вену, сопровождающую краниальную большеберцовую артерию. Под микроскопом эти сосуды осторожно отделяли от нижней поверхности длинного сгибателя большого пальца. Если питающая артерия отходила от краниальной большеберцовой артерии, то с помощью бипо лярного коагулятора пересекали все ветви этой артерии и вет ви сопровождающей ее вены, сохраняя самые проксимальные мышечные артериальные и венозные ветки. Пересекали между двумя лигатурами ствол артерии рядом с питающей кость ветвью и крупный венозный ствол ниже от места впадения питающей кость вены. Это не нарушает питание мышц, так как здесь имеется достаточное окольное кровообращение. Когда длинная питающая кость артерия отходила от каудальной большеберцо вой артерии, то с венами поступали, как описано выше. Но в этом случае не трогали ветви краниальной большеберцовой артерии, кроме одной, которую в последующем анастомозировали с питающей кость артерией для восстановления кровооб
ращения. После |
этого |
укладывали по наружной поверхности |
|
большеберцовой |
кости |
компрессионную |
пластинку Бегби |
(Bagby) с шестью отверстиями, придав ей |
соответствующую |
||
форму. В кости просверливали отверстия в соответствии с от верстиями в пластинке, чтобы облегчить фиксацию костей со сдавленней. Чтобы надежнее сохранить питающие сосуды, костный сегмент длиной 4,5 см пересекали на 2 см ниже от места вхождения в него питающих сосудов и удаляли. Длин ный сгибатель большого пальца отсекали от кости. Кровообра щение в костномозговом канале определяли по наличию крово течения из концов костного фрагмента. Сосудистую ножку пережимали мягким зажимом и пересекали, что позволяло пол ностью удалить костный сегмент. Если длинная питающая артерия отходила от каудальной большеберцовой артерии, то ее коагулировали как можно проксимальнее, а затем пересека ли. После этого костный сегмент вновь укладывали на место и прочно укрепляли пластинкой с шурупами. В костном сегмен те, лишенном кровоснабжения, просверливали небольшое от верстие. Такое же отверстие делали в прилежащей нормальной кости. Отмечалось отсутствие кровообращения внутри костно мозгового канала костного трансплантата. Производили сшива ние краниальной большеберцовой вены монолитным нейлоном 10—0 на конической игле BV2, после чего восстанавливали артериальный кровоток, восстанавливая микрососудистым швом краниальную большеберцовую артерию. В тех случаях, где питающая артерия отходила от каудальной болынеберцо-
328

вой артерии, ее прямо сшивали с подходящей ветвью краниаль ной болынеберцовой артерии, применяя металлизированные нити диаметром 19 мкм. Восстановление кровообращения под-
Т а б л и ц а 14.1А
Трансплантация болынеберцовой кости собаки
тверждали посредством прямого наблюдения за пульсирующим кровотоком из отверстий, предварительно просверленных на концах кости. После остановки кровотечения с помощью хро мированного кетгута подшивали мышцы к их прикреплению на болыпеберцовой кости и тщательно сшивали сухожилие длин ного разгибателя пальцев. Глубокую фасцию умышленно не зашивали, но мышцы подшивали к надкостнице, укрывая ими пластинку. Зашивали кожу и конечность иммобилизировали на шине с мягкой подкладкой сроком на 2 нед до полного зажив ления раны. В течение 5 дней после операции вводили анти биотики.
Результаты
Эти результаты, основанные на данных рентгенологи ческого и радиоизотопного исследований (рис. 14.2 А), были сравнены с результатами, полученными при пересадке костных
Т а б л и ц а 14.Т В
329

Рис. 14.2А (i) Успешная ортотопическая пересадка сегмента болъшеберцовой кости через 6 нед. Имеется более выраженная костная мозоль, чем обычно.
(ii) Ангиограмма левой большеберцовой кости, показывающая проходи мую питающую артерию. Область анастомозов и вхождение артерии в кость отмечены стрелками.
(Ш) Справа показана успешно реваскуляризованный костный транс плантат через 5 мес. Пластинка удалена. Слева показан контрольный костный трансплантат без наложения микрососудистых анастомозов че рез 3 мес после операции. Отмечается небольшое его рассасывание,
(iv)Справа сросшийся реваскуляризированный костный трансплантат через 5 мес, слева инфицированный, несросшийся контрольный кост ный трансплантат без микрососудистых анастомозов,
(v)Через 3 нед после операции отмечается недостаточность кровооб ращения в ортотопическом костном трансплантате левой большеберцо вой кости. На заднем плане видна тень малоберцовой кости. Имеется реактивная гиперемия кости по обе стороны от бессосудистого сегмента.

Рис. 14.2В (i) Срез нор мальной болыпеберцовой кости собаки. Окраска гематоксилин-эозином.
Рис. 14.2В (ii) Биоптат, взятый через 12 нед по сле успешной пересадки микрососудистого сво бодного костного транс плантата у собаки. Все лакуны без исключения содержат жизнеспособ ные остеоциты. Окраска гематоксилин-эозином.
Рис. 14.2В (Ш) Биоптат, взятый через 12 нед по сле неудачной пересад ки микрососудистого свободного транспланта та большеберцовой ко сти у собаки. Лакуны не содержат жизнеспособ ных остеоцитов. Окраска гематоксилин-эозином.
(vi) Сканирование костей технецием-полифосфатом. Через месяц на левой ноге имеется недостаточное кровоснабжение костного трансплан тата. Отчетливо заметен дефект. Через 4 мес на правой ноге отчетливо виден удовлетворительно кровоснабжающийся трансплантат.
