
- •Введение
- •Человеческой культуры
- •1. 1. Иерархия уровней культуры
- •1. 2. Иерархия естественных наук
- •1. 3. Уровни и формы научного познания
- •1. 4. Универсальный принцип естествознания — принцип дополнительности Бора
- •2. Основные этапы развития естествознания
- •2.1 Античная натурфилософия
- •2.2 Средние века и эпоха возрождения
- •2.3. Новое время
- •3. Особенности механики Ньютона
- •3.1 Ньютон и естествознание в его время
- •3.2 Механика Ньютона
- •3.3 Силы в природе
- •3.4 Законы сохранения
- •3.5 Механическая картина мира
- •4. Классическая физика
- •4.1 Учение о теплоте и электричестве
- •5. Неклассическая физика.
- •5.1 Атомизм, периодический закон.
- •5.2 Биологическая эволюция
- •6. Термодинамика
- •6.1 Микроскопические и макроскопические переменные
- •6.2 Калорические параметры состояния и функции процесса
- •6.3 Уравнение состояния
- •6.4 Основы молекулярно – кинетической теории
- •6.5 Теплоемкость
- •6.6 Второе начало термодинамики
- •6.7 Третье начало термодинамики
- •7. Физика полей
- •7.1. Определение понятия поля
- •7.2 Законы Фарадея — Максвелла для электромагнетизма
- •7.3 Электромагнитное поле
- •7.4 Гравитационное поле
- •7.5 Электромагнитная картина мира
- •8 Теория относительности Эйнштейна
- •8.1 Постулаты Эйнштейна в сто
- •8.2 Принцип относительности Галилея
- •8.3 Преобразования Лоренца
- •8.4 Постулаты ото
- •8.5 Основные итоги основ теории относительности
- •9. Колебания и волны
- •9.1 Корпускулярная и континуальная концепции описания природы
- •9.2 Колебания
- •9.3 Волновые процессы
- •9.4 Корпускулярно волновой дуализм излучения частиц
- •9.5 Принцип неопределенности Гейзенберга
- •9.6 Виртуальные частицы и состояния
6.5 Теплоемкость
При
реализации термодинамических процессов
для их анализа вводится понятие
теплоемкости
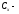 это
количество тепла, которое необходимо
подвести к системе по какому-либо
процессу для того, чтобы изменить ее
температуру на 1 К.
это
количество тепла, которое необходимо
подвести к системе по какому-либо
процессу для того, чтобы изменить ее
температуру на 1 К.
Тогда
средняя теплоемкость процесса, если к
системе подведена теплота в количестве
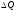 ,
а ее температура изменилась на
,
а ее температура изменилась на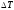 будет равна
будет равна
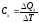 ,
,
где индекс x указывает на характер реализуемого процесса.
Для расчета истинной теплоемкости необходимо перейти к предельному соотношению
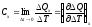
Чаще используют удельную теплоемкость
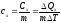
Особую
роль в термодинамике играют теплоемкости
изохорного
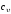 и изобарного
и изобарного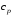 процессов, связь между которыми
устанавливается уравнением Майера
процессов, связь между которыми
устанавливается уравнением Майера

где
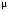 –
молярная масса газа.
–
молярная масса газа.
Их отношение, как известно, определяет показатель степени в адиабатном процессе изменения состояния газа, протекающем без теплообмена с окружающей средой
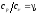
а само уравнение имеет вид
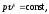
где
р
– давление, Па;
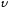 – удельный объем, м3/кг.
– удельный объем, м3/кг.
Мольная изохорная теплоемкость может быть найдена из элементарных соображений в процессе анализа уравнения первого начала.
Запишем его
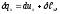
где
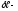 работа
в процессе,
работа
в процессе, .
.
Для
изохорного процесса
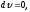 тогда
тогда
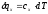 или
или
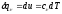
Откуда после подстановки в уравнение первого начала получим
 ,
,
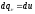
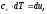 а
следовательно
а
следовательно
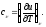
Для систем из реальных веществ необходимо учитывать силу взаимодействия молекул – частиц, из которых они состоят и наличие у молекул собственного объема. Уравнений, описывающих состояние реальных веществ много, но все они описывают поведение систем приближенно. Лучше всего качественно описывает поведение реальных веществ уравнение Ван – дер – Вальса
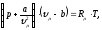
где
а,
b
– константы Ван – дер – Вальса;
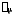 –
объем моля. Константыа,
b
для реальных веществ определяются
опытным путем.
–
объем моля. Константыа,
b
для реальных веществ определяются
опытным путем.
Поправка
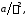 учитывающая наличие сил межмолекулярного
взаимодействия может быть ассоциирована
с наличием внутреннего давления в
газовых системах.
учитывающая наличие сил межмолекулярного
взаимодействия может быть ассоциирована
с наличием внутреннего давления в
газовых системах.
Константа b – поправка, учитывающая наличие конечного объема у молекул газа. Поправку b можно вычислить. Допуская, что молекулы сферы, она будет равна
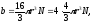
где
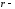 радиус молекулы,
радиус молекулы,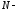 число молекул.
число молекул.
Поправка равна примерно утвержденному собственному объему всех молекул
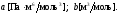
6.6 Второе начало термодинамики
Рис.
6.5
Схема
тепловой машины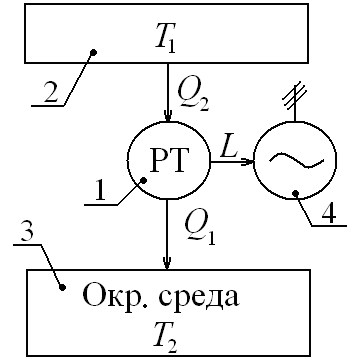
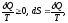
где
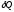 – бесконечно малое количество теплоты,
в котором абсолютная температура
выступала как интегрирующий делитель.
Где знак равенства справедлив для
обратимых процессов, а неравенства для
необратимых. Это привело к необходимости
введения нового калорического параметра
состояния, получившего название энтропии
S.
Циркуляция от дифференциала dS
по замкнутому контуру для обратимых
процессов оказалась равной нулю.
– бесконечно малое количество теплоты,
в котором абсолютная температура
выступала как интегрирующий делитель.
Где знак равенства справедлив для
обратимых процессов, а неравенства для
необратимых. Это привело к необходимости
введения нового калорического параметра
состояния, получившего название энтропии
S.
Циркуляция от дифференциала dS
по замкнутому контуру для обратимых
процессов оказалась равной нулю.
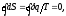
что подтверждает наличие свойств термодинамического параметра. Первая формулировка Второго начала была дана Р. Клаузиусом: невозможен процесс при котором теплота переходила бы самопроизвольно от более холодных к более нагретым телам.
В формулировке У. Томсона: невозможны такие процессы, единственным результатом которых явилось бы отнятие тепла от некоторого тела и превращение его полностью в работу.
Как мы уже отмечали в тепловой машине, циклически воспроизводящей работу, для этого вводится компенсационный процесс отвода энергии в холодильник (окружающую среду).
Понятие энтропии гораздо шире меры рассеяния энергии при протекании реальных необратимых процессов. В статистической физике энтропию S рассматривают как меру вероятности существования некоторого состояния термодинамической системы
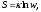
где
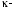 постоянная Больцмана;w
– вероятность состояния системы.
постоянная Больцмана;w
– вероятность состояния системы.
Если воспользоваться понятием энтропии, то второе начало может быть сформулировано в виде: В замкнутой макроскопической системе энтропия при любом реальном процессе возрастает или остается неизменной.
Энтропия ограниченной изолированной системы стремится к максимуму, который достигается в состоянии равновесия системы. Все необратимые самопроизвольные процессы идут в направлении установления равновесия. Таким образом, Второе начало обосновывает понятие термодинамической стреле времени. Второй закон термодинамики справедлив для макроскопических систем, имеющих большую совокупность элементарных частиц атомов и молекул, и подчеркивает появление новых системных свойств кооперативного взаимодействия, не присущих к свойствам составляющих элементов, подчеркивая положение философии о переходе количества в новое качество.
Закон возрастания энтропии носит статистический характер, обосновывая стремление макроскопических систем к переходу в более вероятное состояние.
Максимально вероятным является положение равновесия, т.е. равновесное состояние. При его нарушении появляются градиенты параметров, описывающих состояние системы: температуры, плотности, концентрации и т. д.
При этом возникают потоки (тепла, вещества), которые стремятся вернуть систему в исходное равновесное состояние. Процессы перераспределения субстанции, энергии принято называть процессами переноса: теплообмена, массообмена. К ним относятся теплопроводность и диффузия.
Тепловой поток за счет теплопроводности направлен от более нагретых элементов системы к менее нагретым и рассчитывается по закону Фурье:
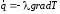 ,
,
где
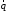 – вектор теплового потока, Вт/м2;
– вектор теплового потока, Вт/м2;
 – теплопроводность, Вт/(м·К);gradТ
– градиент
температуры, К/м
– теплопроводность, Вт/(м·К);gradТ
– градиент
температуры, К/м
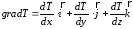 .
.
Аналогично и при диффузии, поток массы вещества направлен от элементов системы, имеющих большую концентрацию к ее элементам с меньшей концентрации и определяется законом Фика:
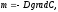
где
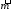 – вектор потока массы,D
– диффузия, С
– концентрация.
– вектор потока массы,D
– диффузия, С
– концентрация.
Стремления ограниченных замкнутых термодинамических систем к равновесию вызвало появление гипотезы о «Тепловой смерти» Вселенной. С точки зрения современной теории тяготения она несостоятельна, ибо однородное изотермическое распределение вещества не является наиболее вероятным, а, следовательно, не соответствует максимуму энтропии. Вселенная нестационарна и расширяется. Почти однородное вначале вещество в дальнейшем под действием сил тяготения распадается на отдельные космические объекты галактики, звездные системы и т.д. Все эти процессы идут с ростом энтропии и не нарушают законы термодинамики.
