
- •Введение
- •Человеческой культуры
- •1. 1. Иерархия уровней культуры
- •1. 2. Иерархия естественных наук
- •1. 3. Уровни и формы научного познания
- •1. 4. Универсальный принцип естествознания — принцип дополнительности Бора
- •2. Основные этапы развития естествознания
- •2.1 Античная натурфилософия
- •2.2 Средние века и эпоха возрождения
- •2.3. Новое время
- •3. Особенности механики Ньютона
- •3.1 Ньютон и естествознание в его время
- •3.2 Механика Ньютона
- •3.3 Силы в природе
- •3.4 Законы сохранения
- •3.5 Механическая картина мира
- •4. Классическая физика
- •4.1 Учение о теплоте и электричестве
- •5. Неклассическая физика.
- •5.1 Атомизм, периодический закон.
- •5.2 Биологическая эволюция
- •6. Термодинамика
- •6.1 Микроскопические и макроскопические переменные
- •6.2 Калорические параметры состояния и функции процесса
- •6.3 Уравнение состояния
- •6.4 Основы молекулярно – кинетической теории
- •6.5 Теплоемкость
- •6.6 Второе начало термодинамики
- •6.7 Третье начало термодинамики
- •7. Физика полей
- •7.1. Определение понятия поля
- •7.2 Законы Фарадея — Максвелла для электромагнетизма
- •7.3 Электромагнитное поле
- •7.4 Гравитационное поле
- •7.5 Электромагнитная картина мира
- •8 Теория относительности Эйнштейна
- •8.1 Постулаты Эйнштейна в сто
- •8.2 Принцип относительности Галилея
- •8.3 Преобразования Лоренца
- •8.4 Постулаты ото
- •8.5 Основные итоги основ теории относительности
- •9. Колебания и волны
- •9.1 Корпускулярная и континуальная концепции описания природы
- •9.2 Колебания
- •9.3 Волновые процессы
- •9.4 Корпускулярно волновой дуализм излучения частиц
- •9.5 Принцип неопределенности Гейзенберга
- •9.6 Виртуальные частицы и состояния
6.2 Калорические параметры состояния и функции процесса
Параметром состояния системы является его полная энергия Епол, измеряемая в Дж. Если из нее вычесть кинетическую энергию системы как движущегося материального объекта, а также потенциальную энергию во внешнем поле тяготения Епот, то оставшаяся часть будет составлять внутреннюю энергию системы U (Дж).
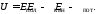
Таким образом, под внутренней понимается энергия, сосредоточенная именно внутри системы: кинетическая энергия перемещения частиц, из которых она состоит, потенциальная энергия их взаимодействия, энергия химических связей, внутримолекулярная, внутриатомная и внутриядерная энергия. Мерой передачи энергии между телами на макроуровне служит работа, а на микроуровне – теплота. Внутренняя энергия системы может быть изменена за счет отдельного или совокупного воздействия на систему через теплоту или работу, которые формулируются в виде закона сохранения энергии или первого начала термодинамики
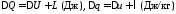
или в дифференциальной форме применительно к 1 кг вещества в системе
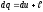 (Дж/кг).
(Дж/кг).
Впервые первое начало в окончательном виде было сформулировано Ю. Майером и Дж. Джоулем.
Количество теплоты, подведенное к системе, затрачивается на изменение ее внутренней энергии и на совершение работы расширения.
6.3 Уравнение состояния
Если термодинамическую систему предоставить самой себе, то через некоторое время она приходит в равновесное состояние, когда в каждой точке ее объема физические параметры: ее – давление, температура, плотность и другие будут одинаковыми. В таком положении значения, характеризующие ее физическую сущность параметров, связаны между собой уравнением состояния

Рис.
6.2. Круговой процесс
или
цикл
Рис.
6.1. К определению понятия
термодинамического
процесса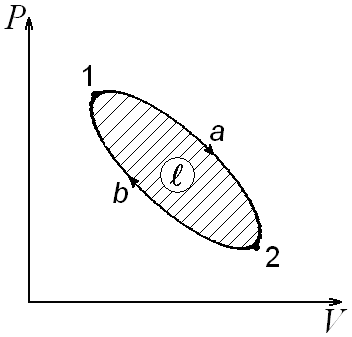
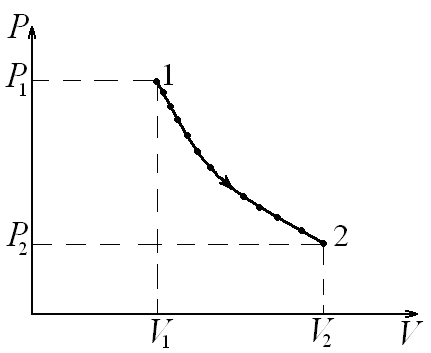
Круговой процесс или цикл позволяет сделать предположение о возможности создания тепловой установки. Для того чтобы процесс был термодинамически обратим необходимо, чтобы он прошел через ряд равновесных состояний, но природа такого не допускает. Ибо в этом случае процессы должны протекать бесконечно медленно, что для техники не имеет практического значения. Анализ многочисленных опытов позволил для идеального газа на основе молекулярно-кинетической теории записать уравнение состояния, известное как уравнение Клапейрона – Менделеева
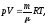
где
р
– давление, Па;
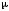 – молярная масса, кг/моль;V
– объем системы, м3;
Т
– абсолютная температура, К; R=8,314
Дж/моль·К – универсальная газовая
постоянная.
– молярная масса, кг/моль;V
– объем системы, м3;
Т
– абсолютная температура, К; R=8,314
Дж/моль·К – универсальная газовая
постоянная.
6.4 Основы молекулярно – кинетической теории
Это уравнение справедливо для идеального газа. Реальные газы, поведение которых при сравнительно низком давлении u, относительно высокой температуры (Т>273 К) Менделеева принято называть совершенным газом. Температура газа, отражающая величину внутренней энергии идеализированной термодинамической газовой системы, может также связана со среднеквадратичной скоростью перемещения молекул в их хаотическом тепловом движении.
Воспользуемся основным уравнением молекулярно-кинетической теории
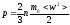
Учитывая,
что концентрация
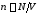 есть
отношение числа молекул к объему,
перепишем последнее выражение
есть
отношение числа молекул к объему,
перепишем последнее выражение
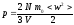
или
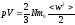
Для
одного моля
 числу
Авогадро, а объем
числу
Авогадро, а объем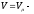 равен
объему одного моля
равен
объему одного моля
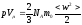
Воспользуемся уравнением состояния, записанным для одного моля
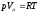
После подстановки и деления обеих частей уравнения на их универсальную газовую постоянную получим выражение
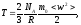
которое можно привести к виду
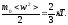
Последнее выражение связывает температуру со средне кинетической энергией теплового движения молекулы.
Величина
 –
константа Больцмана равна отношению
–
константа Больцмана равна отношению
 .
.
Модель идеального газа предполагает, что молекула состоит из одного атома, а у такой молекулы имеются лишь три степени свободы поступательного движения.
Рис.
6.3 Степени свободы молекулы идеального
газа.
i=3
поступательные.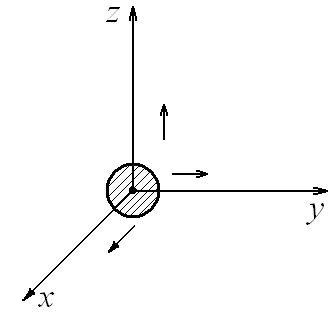
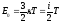 ,
,
так
как
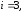 гдеi
–
число степеней свободы.
гдеi
–
число степеней свободы.
В представленном анализе молекулярно-кинетических представлений ограничимся лишь поступательными и вращательными степенями свободы, пренебрегая колебательными, учет которых целесообразен при достаточно высокой температуре. Геометрически модель двухатомного газа может быть представлена в виде гантели (рисунок 11.4). Такая молекула имеет уже 5 степеней свободы, и ее энергия будет определяться величиной
Рис.
6.4 Степени свободы двухатомной молекулы:
i=5
– 2- вращательных и 3 - поступательных
степени свободы.

Для трех и многоатомных молекул добавляется еще одна вращательная степень свободы и ее энергия в этом случае равна
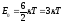
Энергия одного поля может быть найдена как произведения
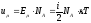
или
вводя обратную замену
 ,
получим
,
получим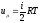 .
.
