
4.3. Технологические принципы
Основные цели эндомикрохирургии ХСГ следующие: 1) полное удаление агрессивной среды из патологической полости (полостей); 2) улучшение биомеханических условий существования головного мозга за счет устранения его деформаций и повышения мобилизации по отношению к стенкам патологической полости и поверхности твердой мозговой оболочки.
Анализ внутриполостной морфологической ситуации, появление высокояркостных осветителей, глубокое залегание и сфероидность медиального контура ХСГ, наличие высокоразрешающих тон-
ких ригидных эндоскопических трубок позволяют в настоящее время существенно пересмотреть технологическую тактику эндоскопического лечения ХСГ. В этих условиях становится логичным использование именно ригидных эндоскопов, так как отпадает необходимость обеспечения параболических траекторий внутриполостного доступа, выполнимых только с помощью гибких эндоскопов. Предварительная стереотопографическая проработка ригидно-эндоскопического доступа в полость ХСГ показала, что вполне достаточно одного отверстия диаметром до 25—35 мм для динамичного позиционирования как эндоскопической трубки с небольшим угловым смещением плоскости объектива, так и вводимых наряду с эндоскопом микроинструментов. Описываемые бипортальные, три- и полипортальные доступы в хирургии ХСГ [2] часто можно считать избыточными. Однако по аналогии с данной терминологией предлагаемую нами технологию мы обозначаем как монопортальное ригидно-эндоскопическое удаление ХСГ.
Технология монопортального ригидно-эндоскопического удаления ХСГ1. Операцию выполняют в по-ложении больного на спине с отведенной в сторону головой; при двусторонних процессах голова центрирована, что предусматривает возможность одновременного вскрытия твердой мозговой оболочки и внешней мембраны ХСГ. Методом выбора проведения анестезии является интубационный наркоз с возможностью режима вспомогательной вентиляции легких. После линейного разреза мягких тканей отверстие в черепе формируют преимущественно корончатой фрезой, обычно в эпицентре объемного очага.
Особенности рассечения твердой мозговой оболочки и их обоснование. Формирование оптимального топографического варианта разреза оболочки предусматривает обеспечение максимальной площади обнажения наружной мембраны ХСГ при минимальной общей протяженности рассечения твердой оболочки без се отслоения от краев костного отверстия, а также надежного герметичного ушивания оболочки в условиях прохождения через ее разрез дренажной трубки. Среди рациональных способов рассечения твердой мозговой оболочки рассмотрим 3 основных (рис. 4-1, а—в): равноконечный крестообразный (а), полулунный окаймляющий (б) и ламбдавидный равноугольный, но эксцентричный с формированием одного удлинен-
1
Особенности выполнения костного доступа
и технологии использования
гибких эндоскопов подробно изложены
в нашей 4 главе 2 тома данного руководства.
106
Эндомикронейрохирургическая технология удаления хронических субдуральных гематом
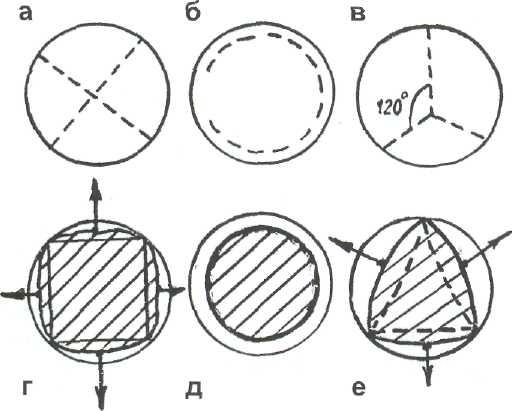
Рис. 4-1. Сравнительная оценка способов рассечения твердой мозговой оболочки при трефинационпом доступе к ХСГ. а—в — соотношение формы и длины разреза оболочки: а — равноконечный крестообразный разрез (апроксимирован-ная протяженность разреза = 2d); б — подковообразный разрез (протяженность = 3 d); в — ламбдавидный равноугольный (120 град) эксцентричный разрез с 1 удлиненным лучом (протяженность — 1,3 d). d — диаметр трефинапионпого отверстия; г—е — соотношения формы разреза и площади обнажаемой наружной мембраны ХСГ (г, е — при оттягивании листков твердой мозговой оболочки провизорными лигатурами).
ного луча (в). Протяженность разреза оболочки в первом случае апроксимированно составляет 2 d (d — диаметр костного отверстия), во втором — 3 d, а в третьем — 1,3 d (размер удлиненного луча в два раза превышает размеры остальных). Площадь обнажаемой наружной мембраны ХСГ примерно одинакова (рис. 4-1, г — е), причем при линейных способах рассечения (г, е) площадь может быть расширена за оттягивания листков твердой мозговой оболочки провизорными лигатурами. Наибольшие возможности атравматичного растягивания листков имеются в зоне удлиненного луча разреза (рис. 4-1 е). Данный вариант разреза позволяет герметизировать оболочку вокруг дренажа швами, накладываемыми в этой же зоне удлиненного луча. Все это позволяет считать оптимальным ламбда-видное равноугольное (120 град) эксцентричное рассечение твердой мозговой оболочки при эндоскопическом доступе к ХСГ.
Введение эндоскопической трубки и ее позиционирование (рис. 4-2). Аксиальное введение эндоскопической трубки проводят перпендикулярно поверхности свода черепа. При этом даже неглубокое вхождение торца эндоскопа в полость ХСГ обеспечивает панорамность ее обзора (рис. 4-2 а),


учитывая хорошую освещенность и наличие автофокусирования объектива эндоскопа. Азимутальные и ротационные перемещения эндоскопической трубки (рис. 4-2 б, в) повышают детализацию об-
зора, особенно полюсных передне-задних и кон-векситально — базальных краеобразующих отделов ХСГ. Основным стереотопографическим ориентиром в базальных отделах является контур малого
107
Клиническое руководство по черепно-мозговой травме
 крыла
клиновидной кости (см. рис. 4-3 г),
разделяющего
переднюю и среднюю черепные ямки,
лобную
и височную доли мозга. В конвекситалъных
отделах
проекцию торца эндоскопа можно
определить
при необходимости по феномену внутренней
трансиллюминации
черепа.
крыла
клиновидной кости (см. рис. 4-3 г),
разделяющего
переднюю и среднюю черепные ямки,
лобную
и височную доли мозга. В конвекситалъных
отделах
проекцию торца эндоскопа можно
определить
при необходимости по феномену внутренней
трансиллюминации
черепа.
Эндомикрохирургические действия. Отверстие диаметром 25 мм позволяет безопасно и маневрен-но проводить микроинструменты под эндоскопическим наведением на объект действий, При этом взаимоположение эндоскопической трубки и стержня (в том числе и параболически изогнутого) микроинструмента носит перекрещивающийся характер, а рабочая часть оказывается в поле зрения объектива (рис. 4-2 б, в). Саму специфику эндо-микрохирургических манипуляций следует рассматривать со стратегической позиции, в соответствии
с которой после удаления (излития) жидкостной части гематомы сохраняется патологический ее «каркас». Это обусловливает, с одной стороны, улучшение визуального контроля выполнения микрохирургических приемов в полости ХСГ, а, с другой стороны, необходимость использования действий, направленных на устранение стенок этого каркаса. Всю совокупность используемых приемов можно свести в 4 группы: внутриполостные, межмембранные, чрезмембранные и подмембранные действия.
Внутриполостные действия (рис. 4-3 а — в). Они направлены на удаление пристеночных сгустков распадающейся крови. Анализ эндоскопической оценки состояния полостей ХСГ позволил выделить некоторые закономерности расположения сгустков. Характерно их скопление в базальных и заднепо-

Рис. 4-3 Внутриполостные действия — аспирационно-эндоскопическое удаление крупных пристеночных сгустков, а — обнаружение сгустков, свисающих в полость ХСГ; б, в — этапы аспирации сгустка. Его краеобразующий контур «армирован» фибриновыми отложениями; г — очищение наружной мембраны от свежих кровяных наслоений после удаления сгустков. Стрелкой отмечено малое крыло клиновидной кости.
108
Эндомикронейрохирургическая технология удаления хронических субдуральных гематом
люсных
отделах полости ХСГ. Это безусловно
следует
связывать с процессом постуралъной
седиментации.
Менее очевидно, что скопления сгустков
обнаруживаются возле перемычек,
стягивающих мембраны ХСГ. Создается
впечатление, что дополнительные
мембраны, трабекулы, спайки,
пиально-дуральные
сосуды либо способствуют образованию
сгустков
(локальное депонирование), либо
препятствуют
их фибринолизу. Последнее положение
подтверждают
визуальные данные структуры крупных
пристеночных
сгустков: краеобразующий контур
свисающего
в полость ХСГ сгустка армирован
фибри-новыми
наложениями и в процессе аспирации
различные
по глубине участки сгустка имеют
неодинаковую
окраску (рис. 4-3 в). Промеры толщины
сгустков
просто и надежно обеспечиваются с
помощью эндоскопического
диссектора путем перфорации шкалированным
выпрямленным микрорычагом его рабочего
органа; пространственные пределы
сгустков определяют, смещая микрорычаг
по нормали к оси
инструмента (по поверхности сгустка).
На основании
представленных оценок можно выделить
предварительные
критерии для эндоскопического удаления
пристеночных сгустков ХСГ: 1)
сгустки,свисающие
в полость удаленной жидкой части при
наличии
явной деформации рельефа краеобразующе-го
контура сгустка; 2) толщина сгустка
более 5—7 мм
в зоне радиусом более 1 см; 3) тампонирование
сгустками
зоны малого крыла клиновидной кости
(необнаружение
характерного рельефа крыла при ба-зальном
обзоре полости ХСГ).
Техника эндоскопического внепроекционного удаления сгустков проста (рис. 4-3): осуществляется эндоскопическое наведение конца трубки отсоса на сгусток, последовательная аспирация сгустков по всей их глубине до внутренней поверхности
наружной мембраны, при этом оптимальным инструментом является микроотсос с изогнутым под углом 45 град кончиком трубки. Ротационные перемещения такой трубки позволяют быстро удалить массу сгустков без азимутальной ее переориентации, что снижают риск травматизации окружающих структур. При появлении свежей «кровяной росы* на мембране ХСГ возможна направленная аппликация полосок сержицеля. Завершающий эндоскопический осмотр повышает надежность контроля гемостаза.
Межмембранные действия (рис. 4-4, 5). В отличие от гиперваскуляризированной наружной мембраны, внутренняя является бессосудистой и действия на ней предусматривают безопасную мобилизацию деформированного полушария мозга для обеспечения его расправления как в центральных отделах экска-вациии (межмембранные сращения), так и в краевых отделах (зона стыка наружной и внутренней мембран). Мембранно-трабекулярные сращения и даже дополнительные межкапсулярные мембраны до операции на КТ определяются далеко не всегда и выявляются только в процессе эндоскопической ревизии. При этом действия на мембранных образованиях состоят в их перфорации с последующей фенестрацией с помощью либо изогнутых браншей микропинцета, либо с помощью специального раз-дувного микробаллончика. Удаляют депонированную жидкую кровь и сгустки при их обнаружении. Трабе-кулярные перемычки целесообразно последовательно иссекать в случаях, если они деформируют медиальную поверхность полости ХСГ или находятся в области скопления сгустков крови.
Меж мембранные действия на сосудистых образованиях (рис. 4-5) предусматривают рассечение пиально-дуральных сосудов, окутанных соедини-

Рис. 4-4. Межмембранные действия — эндомикрохирургичеекая перфорация, фенестрация и рассечение дополнительных мембранных образований и трабекулярных структур, а — фенестрация межкапсул я рной мембраны в полости ХСГ с удалением депонированной жидкой крови; б — по вхождении эндоскопа через мембранное отверстие определяются 2 аркады, разделенные малым крылом клиновидной кости, заполненные рыхлыми сгустками; в — множественные трабекулярные перемычки между внутренней и наружной мембранами ХСГ перед их рассечением.
109
Клиническое руководство по черепно-мозговой травме
 тельнотканным
слоем, как мантия моллюсков продолжающимся
как на поверхность наружной, так и
внутренней мембран ХСГ. Поэтому
сосудистые структуры
походят на трабекулярные тяжи,
пира-мидообразно
подтягивающие участки коры полушария
большого мозга. Рассекать такие тяжи
необходимо
только с использованием биполярной
высокочастотной
коагуляции (рис. 4-5 в, г). Следует отметить,
что подобные сосудистые структуры как
тельнотканным
слоем, как мантия моллюсков продолжающимся
как на поверхность наружной, так и
внутренней мембран ХСГ. Поэтому
сосудистые структуры
походят на трабекулярные тяжи,
пира-мидообразно
подтягивающие участки коры полушария
большого мозга. Рассекать такие тяжи
необходимо
только с использованием биполярной
высокочастотной
коагуляции (рис. 4-5 в, г). Следует отметить,
что подобные сосудистые структуры как
правило хорошо прослеживаются на предоперационных КТ и МРТ (рис. 4-5 а).
Чрезмембранные действия (рис. 4-6). Они направлены на разобщение париетального и висцерального листков капсулы ХСГ в переходных полюсных зонах полости. Эти зоны определяются по конвергенции поверхностей внутренней и наружной мембран. Действия проводят с целью повышения подвижности полушария в области крепления его

Рис. 4-5. Межмембранные действия на сосудистых образованиях.
а, б — эндофотография крупной межмембранной (пиально-дуральной) вены, подтягивающей внутреннюю мембрану и покрывающий участок мозга к наружной мембране, что отчетливо коррелирует с данными МРТ ; в, г — стадии внепроекционного подведения биполярного коагуляционного пинцета с изогнутыми браншами, коагуляция венозного сосуда; д — после пересечения вены отмечается отхождение внутренней мембраны и участка связанного с ней коры мозга.
Вена походит на соединительнотканный тяж, так как снаружи окутана реактивной оболочкой, переходящей как на наружную, так и на внутреннюю мембраны.
110
Эндомикронейрохирургическая технология удаления хронических субдуралъных гематом


вместе с внутренней мембраной ко внутренней поверхности черепа. Технология состоит в рассечении и тракционном подтягивании участков внутренней мембраны в околополюсных зонах конвекситальных и базальных отделов полости ХСГ.
Подмембранные действия (рис. 4-6 в). Их целью является микросепаровка внутренней мембраны ХСГ от арахноидальной оболочки для мобилизации этой мембраны и более быстрого ее смыкания с наружной мембраной с устранением «каркаса» полости бывшей ХСГ. Выполняются подобные действия после микрохирургической фенестрации внутренней мембраны с оттягиванием ее краев. Однако наиболее эффективно и безопасно отсепа-ровка осуществляется с помощью торца тонкого гибкого эндоскопа, работающего как диссектор. Степень рациональности чрезмембранных и под-мембранных действий требует дальнейшей дискуссии, по мере накопления данных о динамике послеоперационной морфологии ХСГ.
Завершение вмешательства и послеоперационное ведение больного. Эндоскопический контроль гемостаза — важный элемент завершающего этапа операции, предопределяющий надежность ее выполнения. Герметизация полости удаленной ХСГ при установке дренажной системы — ключевой элемент завершающего этапа операции. Ушивание разреза твердой мозговой оболочки минимальной протяженности, нивелирование складок этой оболочки в области прохождения дренажной трубки во избежание образования околодренажных щелей или их микротампонирование адгезивными материалами — факторы снижения вероятности разгерметизации полости ХСГ и проникновения в нее воздуха. Технические приемы и средства подробнее описаны ниже при рассмотрении вопроса профилактики напряженной пневмоцефалии.
Важным условием завершающего этапа операции и ведения ближайшего послеоперационного периода — поддержание в заполненном жидкостью состоянии как дренируемой полости, так просвета дренажной трубки и приемного резервуара. Формирование такой временной биогидростатической системы с постепенным уменьшением системного давления обеспечивает тенденцию скорейшего сокращения и исчезновения патологической «каркасной» полости ХСГ. При этом дополнительное введение жидкости через дренаж перед завершением ушивания твердой оболочки — прием для вытеснения внутриполостного воздуха.
Из двух вариантов организации дренирования: форсированной инстилляции с активной аспирацией полости ХСГ или только дозированной аспирации однократно введенной жидкости на завершающем этапе вполне достаточным является последний, так как именно в условиях направленного удаления пристеночных сгустков и депонированной жидкой крови не требуется отсроченного вымывания агрессивной среды. Пережатие дренажа при смене приемника является непреложным приемом.
Значимым компонентом ведения больного в ближайшем послеоперационном периоде является церебральная регидратация с использованием гипоос-мотического 5 % раствора альбумина. Двух—трехкратное введение препарата по 100—200 мл способствует активизации «фармакологической и биофизической мобилизации» сдавленного полушария мозга.
