
Лекции Физика / Лекция 13.б-1
.pdf
11
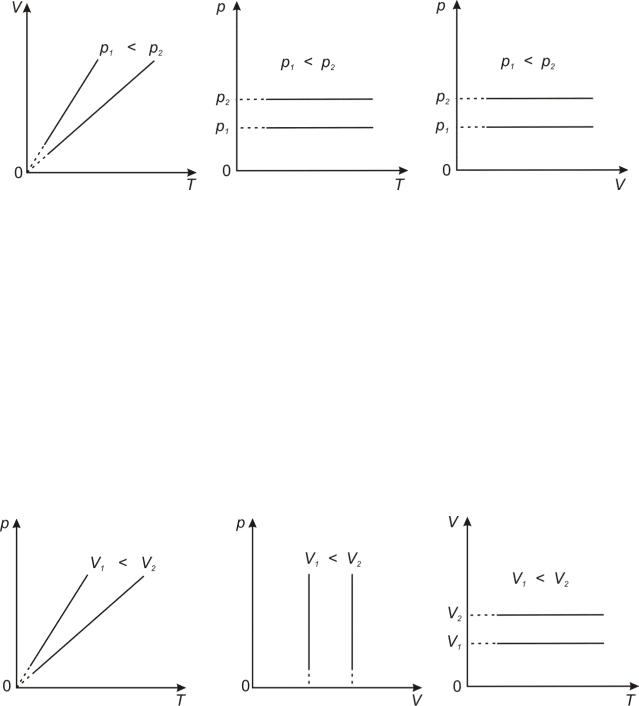
Графически изотермический процесс изображается кривой, называемой изо- термой. Изотермы в координатах (р, V) представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс (рис.3).
Диаграммы (графики) изотермического процесса:
Рис.3 Рис.4 Рис.5
2) Термодинамический процесс, протекающий при постоянной температуре (p=const), называется изобарным.
На основании наблюдений французский ученый Гей-Люссак установил
(1802 г.) закон – закон Гей-Люссака:
Относительное изменение объема газа данной массы при постоянном давлении прямо пропорционально изменению температуры t:
|
|
|
|
|
V − V0 |
= α t |
, |
(13.12) |
|
|
|
|
|||||
|
|
|
|
|
V0 |
|
|
|
где α - температурный коэффициент объемного расширения, |
|
|||||||
V |
- объем газа при t |
0 |
= 0O C , |
|
||||
0 |
|
|
|
|
|
|
|
|
V – |
объем газа при температуре t. |
|
||||||
Температурный коэффициент α численно равен относительному изменению объема газа при изменении его температуры на 1O C .
Измеряя объем газа при двух опорных точках, напр. 0 и 100 O C , можно
найти α : |
|
|
|
|
|
||
|
α = |
V100 − V0 |
|
(при условии, что p |
= p |
0 |
). |
|
|||||||
|
100O C ×V |
|
100 |
|
|
||
|
0 |
|
|
|
|
|
|
Опыт показывает, что при малых плотностях температурный коэффициент объемного расширения α одинаков для всех газов:
α ≈ 1 ( O C −1 ).
273
12
Это означает, что газы изменяют свой объем примерно на 1 того объема, ко273
торый каждый из газов занимал при 0 O C , если его температура меняется на
1O C .
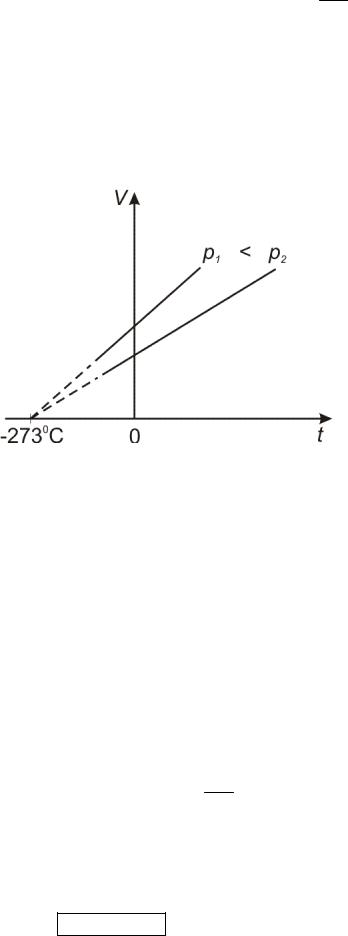
Уравнение (13.12) можно записать в другой форме:
V = V0 (1 + αt) |
, |
(13.13) |
откуда следует, что объем газа определенной массы при p=const меняется линейно при изменении температуры (рис.5).
Рис.6
При увеличении температуры объем газа неограниченно возрастает. Не существует никакого предела для роста температуры. Напротив, низкие температуры имеют предел. Согласно закону Гей-Люссака при понижении температуры объем стремится к нулю. Предельную температуру, при которой объем идеального газа становится равным нулю, принимают за абсолютный нуль температуры. Однако объем реальных газов при абсолютном нуле температуры, согласно современным представлениям термодинамики, обращаться в нуль не может. Имеет ли смысл тогда это предельное значение температуры? Имеет, так как практически можно приблизить свойства реального газа к свойствам идеального. Для этого надо брать всё более разреженный газ, так чтобы его плотность ρ → 0 . У такого газа действительно объем с понижением температуры будет стремиться к предельному, близкому к нулю значению.
В (13.13): приравняем V=0 , учтем α ≈ 1 O C −1 , откуда
|
|
273 |
||
0 = V (1 + |
1 |
t) t = −273 O C - значение абсолютного нуля по шкале Цельсия. |
||
|
||||
0 |
273 |
|
|
|
|
|
|
|
|
Английский ученый Кельвин ввел абсолютную шкалу температур:
T = 273,15 + t , 1O C = 1К .
13 |
|
|
|||
Закон Гей-Люссака в термодинамической шкале температур: |
|
||||
|
|
V |
= Const |
. |
(13.14) |
|
|||||
|
|
T |
|
|
|
Зависимость объема газа от температуры графически изображается прямой линией – изобарой (рис.7, 8, 9).
Диаграммы (графики) изобарного процесса:
Рис.7 |
Рис.8 |
Рис.9 |
3) Термодинамический процесс, протекающий при постоянном объеме, называется изохорным.
Подчиняется закону Шарля:
Для данной массы газа при постоянном объеме давление газа прямо пропорционально абсолютной температуре:
p |
= Const |
|
. |
(13.15) |
|
p = Const ×T |
|||||
|
|||||
T |
|
|
|
||
|
|
|
|||
Зависимость давления газа от температуры графически изображается прямой линией – изохорой (рис.10, 11, 12).
Диаграммы (графики) изохорного процесса:
Рис.10 |
Рис.11 |
Рис.12 |

14
В общем виде уравнением состояния идеального газа называется урав-
нение, устанавливающее связь между всеми пятью параметрами, характеризующими состояние газа (m, M, p, V, T ).
Если масса газа в процессах, происходящих с ним, остается постоянной (т.е. m = const ), то уравнение состояния идеального газа можно получить из законов Бойля-Мариотта и Гей-Люссака. Проделаем это.
Пусть газ из начального состояния 1 с параметрами: p1, V1, T1 (T1 - температура окружающего воздуха) переходит в конечное состояние 2 с параметрами: p2, V2, T2. Начальное и конечное состояния газа выбраны произвольно. Найдем связь между всеми этими величинами.
Переведем газ из состояния 1 в состояние 2 с помощью двух процессов: изобарного и изотермического. Сначала с помощью нагрева до температуры T2 увеличим объем газа так, чтобы давление p1 оставалось постоянным (изобарный процесс). Это состояние газа обозначим 1’ с параметрами: p1, V ′ , T2. Графически этот переход изобразится прямой 1-1’. Затем изотермически при температуре T2 переведем газ в конечное состояние 2, медленно уменьшая объем сосуда. Графически это изобразится участком гиперболы 1’-2 (рис.13).
Рис.13
|
V1 |
|
T1 |
|
′ |
|
|
Согласно закону Гей-Люссака: V ′ = |
T2 |
, откуда выразим объем V |
: |
||||
|
|||||||
V ′ = V1T2 . T1
По закону Бойля-Мариотта:
p1V ′ = p2V2 .
Подставим (13.16) в (13.17) и получим:
p1V1 = p2V2 при m = const T1 T2
или в общем виде:
(13.16)
(13.17)

15 |
|
||||
|
|
|
|
|
|
|
|
pV |
= const |
- уравнение состояния идеального газа для m = const , |
(13.18) |
|
|
|
|||
|
|
T |
|
|
|
называемое уравнением Клапейрона. {Б.П. Клапейрон (1799-1864) – |
француз- |
||||
ский физик, в течение 10 лет работал в России.} |
|
||||
Теперь определим, чему равна постоянная в уравнении Клапейрона. Мы
знаем, что при нормальных |
|
условиях (T0 = 273,15 К, p0 = 101325 Па) объем |
|||||||||||||
1моля любого газа один и тот же: VM 0 = 0,0224 |
м3 |
, |
|
|
|
|
|||||||||
моль |
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
VM - объем 1-го моля газа при давлении p и температуре T. |
|
|
|
||||||||||||
Согласно уравнению Клапейрона можно записать: |
|
|
|
|
|
||||||||||
|
pV |
p0VM |
0 |
|
101325 × 0,0224 |
|
|
Н × м3 |
Дж |
|
|
||||
const = |
M |
= |
|
= |
|
|
|
|
|
|
= 8,31 |
|
|
, |
|
|
T0 |
|
|
|
|
|
|
|
моль× |
|
|||||
|
T |
|
|
273 |
|
м2 × моль × К |
К |
||||||||
{1Па = 1 Н , 1Дж = 1Н × м}
м2 Эту постоянную называют универсальной газовой постоянной:
|
R = 8,31 |
Дж |
|
. |
|||
|
|
||||||
|
|
|
моль× |
К |
|
||
Итак, для 1-го моля идеального газа получаем: |
|||||||
|
|
pVM = RT |
. |
(13.19) |
|||
Пусть теперь ν - произвольное число молей,
ν = m , где m – масса газа, M – его молярная масса.
M
Объем V этого количества вещества при тех же значениях давления и температуры равен:
V =νVM = m VM . M
Умножим обе части уравнения (13.19) на ν = m , тогда получим:
M
pV = m RT - уравнение состояния идеального газа в общем виде, (13.20)
M
называемое уравнением Клапейрона-Менделеева.
В такой форме уравнение состояния было впервые записано великим русским ученым Д.И. Менделеевым.
Уравнение состояния Клапейрона-Менделеева может служить не только для расчета параметров состояния газа, занимающего ограниченный объем ка- кого-либо сосуда. Используя это уравнение, можно достаточно хорошо описать природу наиболее распространенных во Вселенной небесных тел – звезд, типичным представителем которых является Солнце. Солнце, как и многие звезды, представляет собой огромный газовый шар, находящийся в равновесии в собственном поле тяготения.

16
Основное уравнение молекулярно-кинетической теории идеального газа
Вычислим с помощью молекулярно-кинетической теории давление газа. Давление газа объясняется взаимодействием молекул газа со стенками сосуда, которое происходит при соударении с ней.
Давление равно средней силе удара молекул газа о единицу площади стенки со-
суда, в котором находится газ: p = F .
S
Пусть одноатомный идеальный газ находится в прямоугольном сосуде с твердыми стенками. Газ и сосуд имеют одинаковые температуры, т.е. находятся в состоянии теплового равновесия. Будем считать, что число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие ( υR = υR′ ). При этом условии кинетическая энергия молекул в результа-
те столкновения не меняется, т.е. в среднем кинетическая энергия отраженных стенкой молекул будет равна кинетической энергии падающих молекул.
Цель: Вычислим давление газа на стенку сосуда, имеющую площадь S и расположенную перпендикулярно оси x (рис.14).
Рис.14
1 шаг: Определим изменение импульса молекулы при упругом ударе о стенку. Считая, все направления движения молекул равновероятными, можно используя II закон Ньютона выразить силу, действующую со стороны стенки на одну молекулу газа при соударении с этой стенкой.
Изменение проекции импульса молекулы на ось x равно:
′ |
|
|
|
|
|
|
||
px = −m0υ x − m0υ x = −2m0υ x , |
|
|
|
R′ |
|
|
||
где m0 - масса молекулы, υx - проекция скорости на ось x, ( |
|
R |
|
= |
|
|
). Это есть |
|
|
|
|
|
|||||
|
υx |
|
|
υ x |
|
|||
импульс, переданный стенке одной молекулой при упругом соударении.
17
По закону Ньютона × D = DR × D = - υ
II : F t p Fст t 2m0 x .
По III закону Ньютона: Fст = -Fмол ,
где, Fст - сила, действующая со стороны стенки на одну молекулу, Fмол - сила, действующая со стороны молекулы на стенку, тогда:
Fмол × Dt = 2m0υ x . |
(13.21) |
2 шаг: Число молекул, столкнувшихся со стенкой в объеме V со скоростями, проекция υx которых положительна, будет:
Dz = n ×υ x × Dt × S , |
(13.22) |
где n – концентрация молекул в объеме V =υ x × Dt × S со скоростями υx |
> 0 . |
Необходимо, однако, учитывать, что реально молекулы движутся к площадке под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется.
3шаг: Импульс, переданный стенке всеми молекулами со скоростями
υx > 0 будет:
F × Dt = Dz × 2m υ |
= 2m υ 2nDtS . |
(13.23) |
0 x |
0 x |
|
4 шаг: Импульс средней силы, действующий на стенку со стороны всех молекул, будет:
|
|
× Dt = 2m0 SDt ∑ niυix2 . |
(13.24) |
F |
|||
|
|
υix >0 |
|
Мы знаем определение, что средний квадрат проекции скорости на ось x опре-
деляется:
|
|
|
|
n υ 2 |
|
|
υ x |
2 = ∑ |
|
||||
i ix |
, |
(13.25) |
||||
|
||||||
|
|
|
υix |
n |
|
|
где суммирование осуществляется по всем проекциям скоростей, как положительным, так и отрицательным. Но положительные значения проекций скоростей встречаются так же часто, как и отрицательные, поэтому:
∑ n υ 2 |
|
|
|
1 |
|
|
2 = |
1 |
|
|
|
|
|
|
||||||||||
= |
∑ n υ |
|
n υ |
2 . |
(13.26) |
|||||||||||||||||||
|
|
|||||||||||||||||||||||
|
i |
ix |
|
|
|
2 υix |
i |
ix |
2 |
|
|
|
x |
|
||||||||||
υix >0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Подставляя (13.26) в (13.24), получаем средний импульс силы: |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
× Dt = m |
S Dt n υ |
2 . |
|
|
|
(13.27) |
||||||||||||||||
F |
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
0 |
|
|
|
|
|
x |
|
|
|
|||||||||
Отсюда получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
= m |
0 |
n υ |
2 . |
|
|
|
|
|
|
|
(13.28) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
S |
|
|
x |
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
Учтем, что
18
υ x 2 = υ y 2 = υ z 2 = 1 υ 2 , 3
то есть средний квадрат проекции скорости равен 1 среднего квадрата самой
3
скорости. Множитель 1 появляется вследствие трехмерности пространства и, 3
значит, существования трех проекций у любого вектора. Тогда в окончательном виде получаем выражение
p = |
1 |
|
|
|
|
||
m n |
υ 2 |
|
, |
(13.29) |
|||
|
|||||||
3 |
0 |
|
|
|
|
||
|
|
|
|
|
|||
которое называется основным уравнением молекулярно-кинетической тео-
рии идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Таким образом, давление идеального газа пропорционально произведению мас- сы молекулы на концентрацию молекул и средний квадрат их скорости.
Здесь ещё раз обращаем своё внимание, что средняя квадратичная скорость определяется:
|
|
|
|
|
|
1 |
N |
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
υкв |
= υ 2 = |
∑υi2 , |
||||
|
|
||||||
|
|
|
|
|
|
N i =1 |
|
где N – число молекул в объеме V.
Значимость уравнения (13.29) заключается в том, что оно связывает макропараметр (давление p), характеризующий состояние совокупности огромного числа частиц с микропараметрами (масса и скорость молекулы), характеризующими состояние каждой отдельной молекулы.
Так как средняя кинетическая энергия поступательного движения моле-
|
|
|
m υ |
2 |
|
|
|
|
|
|
|
|
кулы равна Eкин = |
|
|
|
|
|
|
|
|
||||
0 |
|
, то уравнение (13.29) |
можно переписать в виде: |
|||||||||
2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p = |
2 |
n |
|
кин |
. |
(13.30) |
|
|
|
|
|
E |
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
3 |
|
|
|
|
|
|
Таким образом, давление идеального газа пропорционально средней кинетиче- ской энергии молекул.
Теперь докажем, что температура есть мера средней кинетической энергии молекул. Умножим выражение (13.30) на молярный объем Vм и учтем, что
nVм = N A , тогда
pVм = |
2 |
N A |
|
кин . |
(13.31) |
|
E |
||||||
|
||||||
3 |
|
|
|
|
||
Помним, что уравнение состояния идеального газа для 1 моля имеет вид:

|
|
|
|
|
|
|
|
|
|
19 |
|
|
|
|
||||
|
|
|
|
|
|
pVм = RT . |
(13.32) |
|||||||||||
Приравниваем выражения (13.31) и (13.32) и получаем уравнение: |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
кин |
= |
3 |
kТ |
. |
(13.33) |
|||||
|
|
|
|
|
|
E |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|||
Отношение универсальной газовой постоянной R к постоянной Авогадро N A |
||||||||||||||||||
одинаково для всех веществ. Оно называется |
|
|
||||||||||||||||
|
|
R |
|
= k - постоянная Больцмана |
||||||||||||||
|
|
|
|
|||||||||||||||
|
N A |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
и равно |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
8,31 |
|
|
Дж |
|
|
|
|
|
|
|
|
|
|||
k = |
|
моль× К |
|
|
= 1,38 ×10− 23 |
Дж |
. |
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
−1 |
|
|||||||||||||
6,02 ×10 |
23 |
моль |
|
|
К |
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
Таким образом, средняя кинетическая энергия хаотического поступательного движения молекул идеального газа пропорциональна его абсолютной темпера- туре и зависит только от неё, т.е. температура есть количественная мера энергии теплового движения молекул.
При одинаковой температуре средние кинетические энергии молекул любого газа одинаковы. При T = 0 К: Eкин = 0 , и поступательное движение молекул газа прекращается, однако анализ различных процессов показывает, что T = 0 К – недостижимая температура.
Подставляя (13.33) в уравнение (13.30), получим следующий вид этого
уравнения: |
|
p = n k T . |
(13.34) |
Таким образом, при одинаковых давлениях и температурах концентрация мо- лекул у всех газов одинаковая.
