
Лекции Физика / Лекция 15.б-1
.pdf
1
Лекция № 15
Основы термодинамики.
Внутренняя энергия идеального газа. Степени свободы молекул. Закон равнораспределения энергии по степеням свободы молекул. Количество теплоты и работа.
Равновесные состояния и процессы. Теплоемкость идеального газа при постоянном давлении и объеме. Уравнение Майера. Первый закон термодинамики и его применение к изопроцессам.
Под внутренней энергией любой термодинамической системы (или тела) понимается сумма кинетической энергии хаотического движения частиц, из которых состоит эта система, и потенциальной энергии их взаимодействия между собой:
U = Eкин + Eпот .
Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Для идеального газа внутренняя энергия представляет собой среднюю кинетическую энергию всех атомов: U = Eкин .
Одноатомный газ – это газ, состоящий из отдельных атомов, а не молекул. {Пример: инертные газы (элементы VIII группы периодической системы Менделеева) – гелий, неон, аргон и др.} Можно получить одноатомный (атомарный) – водород, кислород и т.д. Однако такие газы будут неустойчивыми, так как при столкновениях атомов образуются молекулыНайдем2, внутреннююО2 и др. энергию идеального одноатомного газа массой m.
Для этого среднюю кинетическую энергию одного атома |
|
|
= |
3 |
kТ нужно |
|||||||||||||||||
E |
кин |
|||||||||||||||||||||
|
||||||||||||||||||||||
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
||
умножить на число атомов N = |
|
|
N А, тогда получаем: |
|
|
|
||||||||||||||||
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
||||||
|
|
кин × N = U = |
3 |
× |
R |
Т × |
m |
N А, |
|
|
|
|||||||||||
E |
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
2 |
|
N A M |
|
|
|
|||||||||||||||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
U = |
3 |
|
m |
RT . |
|
|
|
|
|
|
(15.1) |
||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
2M
Вклассической МКТ атомы и молекулы рассматриваются как очень маленькие абсолютно твердые тела (материальные точки). Представление
2
о молекулах как о материальных точках оправдывается только для одно-
атомных газов. В случае многоатомных газов нужно рассматривать молеку-
лы как сложные системы, способные вращаться как целое, причем атомы в них могут совершать колебания вблизи своих положений равновесия.
Общее число степеней свободы молекулы при этом увеличивается. {Вспомним, что числом степеней свободы механической системы
называется количество независимых параметров, с помощью которых может быть задано положение системы. Так, положение материальной точки в пространстве определяется заданием значений трех ее координат. В соответствии с этим материальная точка имеет три степени свободы.}
Число степеней свободы молекулы i - это количество независимых пе-
ременных (координат), полностью определяющих положение молекулы в пространстве.
Число степеней свободы для различных моделей молекул:
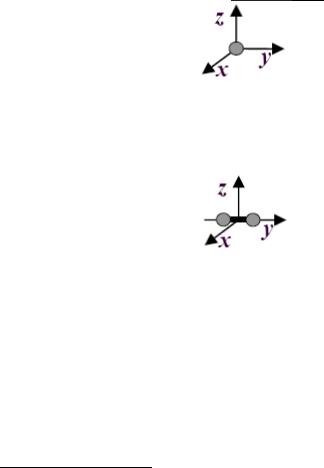
1) Атом (рис.1) – имеет 3 степени свободы, так как может совершать только поступательное движение по трем независимым взаимно перпендикулярным направлениям: i = iпост = 3 .
Рис.1
Одноатомный газ: He, Ar и др.
2) Двухатомная молекула (жесткая связь) (рис.2).
|
Рис.2 |
|
В этом случае 3 степени |
свободы соответствуют |
её поступательному |
движению ( iпост = 3 ), и |
2 степени свободы |
соответствуют её |
вращательному движению ( iвращ = 2 ) вокруг двух осей:
∙относительно оси симметрии (линии, соединяющей центры атомов в молекуле);
∙относительно оси, перпендикулярной оси симметрии.
Поэтому i = iпост + iвращ = 5 .
Двухатомный газ: О2, N2, воздух.
3)Двухатомная молекула (нежесткая связь) (рис.3).
Вреальных молекулах нет жесткой связи между атомами в молекуле, поэтому необходимо учитывать также степени свободы колебательного дви-

3
жения атомов внутри молекулы.
|
|
Рис.3 |
|
|
В этом случае: |
|
|
|
|
i |
= 3 |
|
|
|
пост |
|
|
|
|
|
× iколеб = 7 , |
|||
iвращ = 2 i = iпост + iвращ + 2 |
||||
i |
= 1 |
|
|
|
|
|
|
||
колеб |
|
|
|
|
где i — сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы.
4) Многоатомная молекула (жесткая связь) (рис.4).
Рис.4
Многоатомный газ имеет молекулы, состоящие из трех и более жестко связанных между собой материальных точек. Такая молекула, как любое абсолютно твердое тело, имеет 6 степеней свободы - 3 поступательных и 3 вращательных (молекула может совершать вращения вокруг трех взаимно перпендикулярных осей):
iпост = 3 = + = iвращ = 3 i iпост iвращ 6 .
Многоатомный газ: двуокись углерода СО2, двуокись серы SO2, метан СН4, аммиак NH3 и др.
От числа степеней свободы молекул зависит внутренняя энергия газа. Энергия молекул, состоящих из некоторого числа атомов, не жестко связанных друг с другом, будет теперь складываться из энергии поступательного движения, вращательной энергии и энергии колебаний:
E= Eпост + Eвращ + Eколеб .
Встатистической физике существует и доказан закон Больцмана о равно-
мерном распределении энергии по степеням свободы. Согласно этому зако-
ну: для системы, находящейся в состоянии термодинамического равнове-
сия, на каждую поступательную и вращательную степени свободы приходит-
ся в среднем кинетическая энергия, равная 1 kT , а на каждую колебатель-
2
ную степень свободы приходится энергия, в два раза большая, чем на по-
4
ступательные или вращательные степени свободы: kT .
{Колебательная степень “ обладает” вдвое большей энергией потому, что на нее приходится не только кинетическая энергия (как в случае поступательного и вращательного движений), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковы.}
Поэтому, средняя энергия молекулы определяется:
|
|
= |
i |
kT |
, |
(15.2) |
|
E |
|||||||
|
|
||||||
2 |
|
|
|
||||
где i - сумма числа поступательных, вращательных и удвоенного числа колебательных степеней свободы молекулы: i = iпост + iвращ + 2 × iколеб .
Внутренняя энергия произвольного идеального газа определяется: |
|
||||||||||||||
|
|
|
|
× N = |
i |
|
m |
N AkT = |
|
i |
|
m |
RT |
. |
(15.3) |
|
U = |
E |
|||||||||||||
|
|
2 M |
|
|
|||||||||||
|
|
|
|
|
|
|
2 M |
|
|
||||||
Видим, что внутренняя энергия идеального газа прямо пропорциональна его абсолютной температуре, от объема она не зависит.
Работа и количество теплоты. Первое начало термодинамики
Внутренняя энергия системы может изменяться за счет энергии, сообщаемой системе извне. Эта энергия может сообщаться системе посредством двух процессов: либо за счет работы, производимой внешними силами над системой, либо за счет передачи ей тепла.
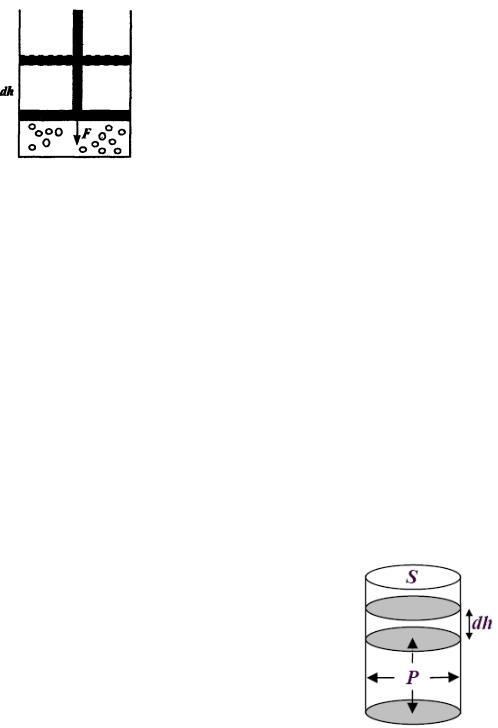
Рассмотрим газ, сжимаемый в сосуде поршнем под действием силы
F (рис.5).
Рис.5
Пусть под действием этой силы поршень переместился на расстояние dh, сжав газ. Работа силы на пути dh:
dA = Fdh.
Разделив величину силы на площадь поршня, получим давление p, а умножив на S, получим изменение объема газа dV . Таким образом, производимая над газом работа
dA= PdV. |
(15.4) |
Такую же по величине работу совершает газ при расширении, перемещая поршень. При этом dV положительно, если газ расширяется, и от-
5
рицательно при сжатии газа. Соответственно работа dA положительна или отрицательна: в первом случае система производит работу сама, во втором
—внешние силы производят работу над системой.
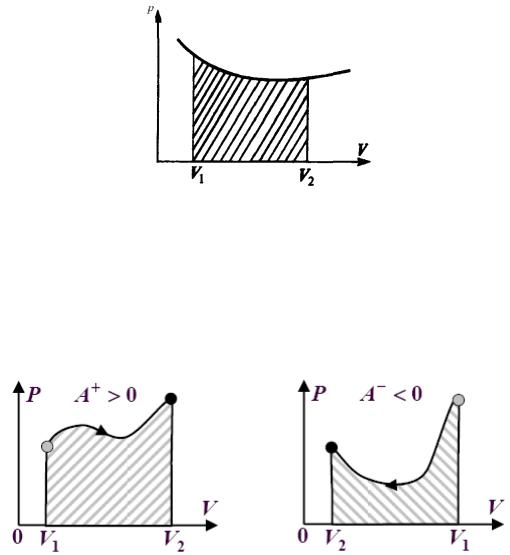
Графически процесс изменения состояния газа при его расширении или сжатии изображается на кривой p, V участком 1-2 на рис.6.
Рис.6
Полная работа, совершаемая газом, при расширении от V1 до V2:
V2 |
|
A = ∫ pdV . |
(15.5) |
V1 |
|
Эта работа численно равна заштрихованной площади, заключенной под кривой p(V) – см. рис.7 (а, б).
а) |
б) |
|
Рис.7 |
Рассмотрим способы передачи телу тепла. При соприкосновении тел или при взаимодействии тел через излучение, изменение внутренней энергии происходит за счет передачи энергии хаотически движущихся частиц одного тела частицам другого.
Процесс изменения внутренней энергии системы, происходящий без совершения работы (простым нагреванием) называется процессом
теплопередачи (или процессом теплообмена). |
|
|
|
Основной характеристикой является количество теплоты Q – |
это |
||
мера изменения внутренней энергии вещества при теплопередаче: |
Q = |
U |
. |
Теплота измеряется в тех же единицах, что и энергия: |
|
|
|

6
СИ: [Q] = 1 Дж.
Внесистемная единица измерения: [Q] = 1кал, 1кал = 4,2 Дж.
Связь между переданным теплом, изменением внутренней энергии системы и произведенной работой выражается уравнением:
Q = U + A′ |
, |
(15.6) |
которое представляет собой закон сохранения энергии применительно к термодинамическим процессам. Он получил название первого начала термодинамики (или I закона ТД): количество теплоты, сообщаемое системе, расходуется на изменение внутренней энергии этой системы и на совершение ею работы против внешних сил.
Или:
Изменение внутренней энергии системы при переходе её из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного
системе, и не зависит от способа, которым осуществляется этот переход:
U = U 2 − U1 = Q − A′ .
Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из 1-го состояния во 2-ое изменение внутренней энергии будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой A′ , совершенной системой против внешних сил. { A′ = − A}
Запись I начала ТД в дифференциальной форме:
|
|
′ |
= dU + pdV |
|
(15.6*) |
|
|
δQ = dU + δA |
|
||
где δQ - элементарное |
|
|
|
||
количество теплоты, |
|
|
|||
′ |
- элементарная работа, |
|
|
|
|
δA |
|
|
|
||
dU |
- (полный дифференциал) |
приращение |
внутренней энергии |
||
системы в ходе данного элементарного процесса, так как внутренняя энергия U - однозначная функция состояния этой системы. Это означает, что приращение внутренней энергии при переходе системы из одного состояния в другое, всегда равно разности значений внутренней энергии в конечном и начальном состояниях независимо от пути, по которому совершался переход, т.е. независимо от характера процесса, приведшего к переходу системы из одного состояния в другое.
δQ и δA нельзя рассматривать как приращение величин Q и A, так как совершенная системой работа и количество полученной системой теплоты зависят от пути перехода системы из одного состояния в другое.
Следовательно, ни Q, ни A не являются функциями состояния, поэтому нельзя говорить о запасе теплоты или работы, которым обладает система в различI началоых с стоянияхТД иногда. формулируется следующим образом:
Невозможен вечный двигатель (“ перпетуум мобиле”) первого рода.
Вечный двигатель 1-го рода – это периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия.

7
{Вечный двигатель представляет собой систему, совершающую
многократно некий круговой процесс (цикл).} |
|
|
Если |
система периодически возвращается в |
первоначальное |
состояние, |
то изменение ее внутренней энергии U = 0 . |
Тогда согласно I |
закону ТД: A′ = Q , отсюда и следует вторая формулировка I закона ТД.
Теплоемкость.
Теплоемкость идеального газа при постоянном давлении и объеме. Уравнение Майера. Применение I закона термодинамики к изопроцессам.
Для характеристики тепловых свойств различных веществ и тел, участвующих в теплообмене, вводятся следующие физические величины:
1) Теплоемкость тела (C) – это количество теплоты, при получении которого температура данного тела повышается на один градус. Согласно этому определению:
|
C = δQ |
, |
(15.7) |
|
dT |
|
|
δQ - количество теплоты, сообщение которого повышает температуру тела |
|||
на dT. |
|
||
СИ: [С] = 1 Дж/К |
|
||
2) Удельная теплоемкость вещества (с) – |
это количество теплоты, |
||
необходимое для нагревания единицы массы вещества на 1 К или градус:
|
|
|
c = |
δQ |
|
. |
|
|
(15.8) |
||
СИ: [С] = 1 Дж / кг × К |
mdT |
||||||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
||||
3) Молярная теплоемкость вещества ( Cμ ) – |
это количество теплоты, |
||||||||||
необходимое для нагревания 1 моля вещества на 1 К или градус: |
|||||||||||
|
|
|
Cμ |
= |
δQ |
|
, |
(15.9) |
|||
|
|
|
|
||||||||
|
|
|
|
νdT |
|
|
|||||
где ν = |
m |
количество вещества. |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||||
|
M |
|
|
|
|
|
|
|
|||
СИ: [С] = 1 Дж / моль× К |
|
|
|
|
|
|
|
||||
Cμ = M ×c - связь между удельной и молярной теплоемкостями.
Различают теплоемкости (удельную и молярную) при постоянном объеме ( cV и CV ) и постоянном давлении ( c p и C p ), если в процессе
нагревания вещества его объем или давление поддерживаются
постоянными1) Молярная. |
теплоемкость при постоянном объеме. |
|
||
|
|
|
|
|
Запишем I н. ТД: |
δQ = dU + pdV , |
|
||
|
|
(*) |
||
из определения (15.9) выразим количество теплоты:
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δQ =νCμ dT , |
|
|
(15.20) |
|||||||
тогда (*) примет вид: |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
νCμ dT = dU + pdV . |
(15.21) |
|||||||||
Учтем, что U = |
i |
|
m |
RT =ν ×U μ , |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
i |
|
2 M |
|
|
|
|
|
|
|
|
|
|||||||
где U μ = |
RT - внутренняя энергия 1 моль идеального газа, |
|
|||||||||||||||||
|
|
||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V =ν ×Vμ , где Vμ - молярный объем. |
|
|
|
|
|
|
|
||||||||||||
Тогда уравнение (15.21) для 1 моля газа примет вид: |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
Cμ dT = dU μ + pdVμ . |
(15.22) |
|||||||||
Если нагревание |
|
|
|
|
|
|
|
|
|
dVμ = 0 , то |
|||||||||
тела происходит при V = Const , т. е. |
|||||||||||||||||||
работа равна нулю. Из уравнения (15.22) следует: CV dT = dU μ |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
C |
= |
|
dU μ |
, |
|
(15.23) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
V |
|
|
dT |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
то есть теплоемкость CV равна изменению внутренней энергии 1 моль газа |
|||||||||||||||||||
при повышении его температуры на 1 К. |
|
|
|
||||||||||||||||
Поскольку dU μ = |
i |
RdT , то из (15.23) следует, что |
|
||||||||||||||||
|
|
||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
C |
= |
i |
R |
. |
|
|
(15.24) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
V |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эта формула определяет теплоемкость 1 моля идеального газа, называемую молярной.
2) Молярная теплоемкость при постоянном давлении.
При нагревании газа при p = Const его объем меняется, сообщенное телу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы, то есть
δQ = dU + pdV . |
|
||||||
Для 1 моля газа теплоемкость CP = |
δQ |
при p = Const буде равна: |
|
||||
|
|
|
|||||
|
νdT |
|
|
|
|||
CP = |
dU μ |
+ |
pdVμ |
. |
(15.25) |
||
|
|
||||||
|
dT |
dT |
|
||||
Из уравнения Менделеева-Клапейрона следует: pdVμ = RdT . Учитывая это и выражение (15.23), уравнение (15.25) примет вид:
Итак, CP > CV . Это |
CP = CV + R |
- уравнение Майера. |
(15.26) |
объясняется тем, что при нагревании газа при |
|||
постоянном давлении требуется дополнительное количество теплоты на совершение работы расширения газа.
Учитывая (15.24), из уравнения Майера получим:
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
R |
i |
|
|
|
|
CP = i |
|
+ R = |
|
+1 R |
. |
(15.27) |
|
|
|||||
2 |
2 |
|
|
|
||
Для идеального одноатомного газа: CV = 3 R , CP = 5 R . 2 2
Отношение γ = CP представляет собой величину, характерную для
CV
каждого газа и определяемую числом степеней свободы молекул газа. Измере-
ние теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.
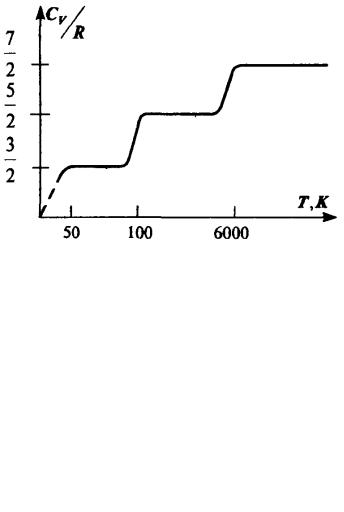
Формулы (15.24), (15.27) для теплоемкости идеального газа приблизительно верно описывают эксперимент, причем, в основном, для одноатомных газов. Согласно полученным формулам теплоемкость не должна зависеть от температуры. На самом деле наблюдается картина, изображенная на рис.8, полученная опытным путем для двухатомного газа водорода.
Рис.8
На участке 1 газ ведет себя как система частиц, обладающих лишь поступательными степенями свободы, на участке 2 возбуждается движение, связанное с вращательными степенями свободы и, наконец, на участке 3 появляются две колебательные степени свободы. Ступеньки на кривой хорошо согласуются с формулой (15.24), однако между ними теплоемкость растет с температурой, что соответствует как бы нецелому переменному числу степеней свободы. Такое поведение теплоемкости указывает на недостаточность используемого нами представления об
идеальном газе для описания реальных свойств вещества.
Равновесные процессы в идеальном газе
Если макроскопические параметры системы имеют одинаковые значения во всем объеме, занимаемом системой, и не изменяются с течением времени, то состояние системы является равновесным. Последовательный переход системы из одного равновесного состояния в другое, совершаемый
10
достаточно медленно, так, что в любой заданный момент времени систему можно характеризовать определенными равновесными значениями термодинамических параметров: давления, температуры или объема, называ-
ется равновесным процессом.
Равновесный процесс представляет собой приближенную модель реального термодинамического процесса. Рассмотрим, например, сжатие газа поршнем в закрытом сосуде. Если поршень вдвигать достаточно быстро, то давление поршня на газ не будет успевать распространяться по всему объему, занятому газом. Давление газа на поршень в каждый момент времени будет больше, чем давление газа на стенки сосуда. Состояние газа в этом случае нельзя характеризовать определенной величиной давления, оно будет существенно неравновесным. Со временем давление перераспределится по всему объему, и состояние газа станет равновесным с новым значением давления. Время установления нового состояния равновесия газа определяется его плотностью и температурой. Процесс установления термодинамического равновесия в системе носит название
релаксационного процесса, а время установления равновесия — времени ре-
лаксацииВ случае. , когда газ под действием поршня сжимается достаточно медленно, давление успевает равномерно распределиться по всему объему, и в газе в любой заданный момент времени устанавливается равновесие. Таким образом, при медленном движении поршня газ проходит последовательно через ряд равновесных состояний, и процесс термодинамически равновесный. Для того чтобы процесс был равновесным, очевидно, необходимо, чтобы время релаксации в системе было меньше времени, в течение которого система подвергается внешнему возмущению.
Применение I закона термодинамики к изопроцессам
Рассмотрим ряд равновесных процессов в идеальном газе, имеющих важное значение в термодинамике. При равновесных процессах термодинамические параметры p, V и T в каждый момент времени связаны между собой уравнением состояния.
1) Изотермический процесс.
При изотермическом процессе температура газа остается постоянной в течение всего процесса. Уравнение состояния газа в этом случае имеет
вид: |
p =ν |
RT |
. |
|
|
||
|
|
V |
|
При заданной температуре состояние газа изображается точкой на плоскости, где по осям отложены давление и объем. Последовательность таких точек образует кривую, представляющую изотермический процесс. В случае изотермического процесса кривая является гиперболой и называется изотермой. Разным температурам газа соответствуют различныеПосколькуизотермытемпература. газа остается постоянной dT = 0, при термодинамическом процессе не изменяется внутренняя энергия газа, dU = 0. Из I начала ТД следует, что все подводимое в систему количество теплоты расходуется только на совершение механической работы против внешних сил:
