
Лекции Физика / Лекция 16.б-1
.pdf
1
Лекция № 16
Адиабатические процессы в газах. Уравнение адиабаты. Политропические процессы.
Обратимые и необратимые процессы. Циклические процессы. Цикл Карно. Коэффициент полезного действия тепловых машин.
Второе начало термодинамики.Энтропия как функция состояния системы. Статистический смысл энтропии. Третье начало термодинамики.
Адиабатический процесс – процесс, протекающий в системе без теплообмена с окружающей средой, т. е. δQ = 0 .
Из I начала термодинамики для адиабатического процесса следует, что
0 = dU + δA′ ,
откуда dU = - pdV или DU = A ,
т. е. изменение внутренней энергии системы происходит только за счет совершения работы.
Выразим изменение внутренней энергии через теплоемкость при постоянном объеме согласно формуле:
dU =ν ×CV dT .
Тогда
ν ×CV dT = - pdV . |
(16.1) |
|
|
|
|
Отсюда следует, что при адиабатическом расширении газа dV > 0, dT < 0, и газ охлаждается, внутренняя энергия уменьшается. При адиабатическом сжатии газа, наоборот, происходит его нагревание и соответственно увеличение внутренней энергии.
Работа при адиабатическом процессе пропорциональна изменению температур газа в начальном и конечном состояниях:
V2 |
T2 |
|
A = ∫ pdV = −νCV ∫ dT =νCV (T1 − T2 ). |
(16.2) |
|
V1 |
T1 |
|
Получим уравнение, описывающее адиабатический процесс. |
|
|
Для этого разделим выражение (16.1) соответственно на правую и левую |
||
части уравнения состояния ν × RT = pV |
и проинтегрируем полученное соотно- |
|
шение по параметрам начального и конечного состояния газа:
C |
Т2 |
dT |
|
|
V2 |
dV |
|
|||||
V |
|
∫ |
|
|
|
= − ∫ |
|
|
|
, |
||
R |
|
T |
V |
|||||||||
Т |
|
|
|
V |
|
|||||||
|
1 |
|
|
1 |
|
|
|
|
|
|||
− ln |
T2 |
= |
|
R |
ln |
V2 |
. |
(16.3) |
||||
T1 |
|
|
||||||||||
|
|
|
|
CV |
V1 |
|
||||||
Воспользуемся связью между CP и CV в виде уравнения Майера: R = CP - CV и
вводя определенную ранее характерную для газа величину γ = CP , получим:
CV
2
− ln T2 = (γ −1)ln V2
|
|
T1 |
|
|
|
|
|
|
|
V1 |
||
|
|
|
T |
|
|
V |
1−γ |
|||||
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
ln |
|
|
|
|
|
|||||||
|
= ln |
|
|
|||||||||
|
|
|
T1 |
|
|
V1 |
|
|||||
откуда по свойству логарифма: |
|
|
|
|
|
|
|
|
|
|
(1−γ ) |
|
T |
|
= |
V |
2 |
|
|
||||||
|
|
2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||||||
|
T1 |
|
|
|
|
|
|
|
|
|||
|
|
|
V1 |
|
|
|||||||
или |
|
|
|
γ −1 = T V γ −1, |
||||||||
T V |
||||||||||||
|
1 |
1 |
|
|
|
2 |
2 |
|
||||
,
, |
(16.4) |
то есть
TV γ −1 = const . |
(16.5) |
Учитывая, что T ~ pV окончательное соотношение между давлением и объемом идеального газа при адиабатическом процессе примет вид:
PVγ = const, |
(16.6) |
где γ = CP - называется показателем адиабаты. Полученное уравнение (16.6)
CV
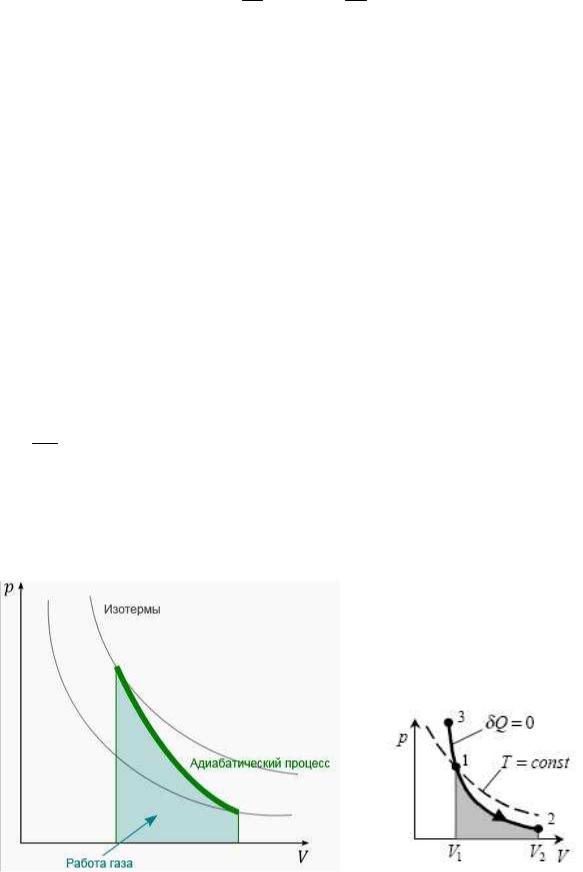
называется уравнением Пуассона (уравнением адиабаты). На плоскости p, V
адиабатический процесс изображается кривой, называемой адиабатой. Поскольку γ > 1, то на графике адиабата спадает более круто, чем изотерма
(рис.1).
Рис.1

3
Диаграммы (графики) адиабатного процесса:
Рис.2 |
Рис.3 |
Рис.4 |
|||
Как следует из прошлой лекции: γ = |
CP |
= |
i + 2 |
. |
|
CV |
|
|
|||
|
|
i |
|
||
Для одноатомных газов i = 3, γ = 1,67 ; для двухатомных газов i = 5, γ = 1,4 .
Эти значения хорошо подтверждаются экспериментом.
Конечно, нельзя окружить систему оболочкой, абсолютно исключающей теплообмен. Но в ряде случаев реальные процессы очень близки к адиабатным. Существуют оболочки, обладающие малой теплопроводностью, например двойные стенки с вакуумом между ними. Так изготовляются термосы.
Процесс можно считать адиабатным даже без теплоизолирующей оболочки, если он происходит достаточно быстро, то есть так чтобы за время процесса не происходило заметного теплообмена между системой и окружающими телами.
Адиабатические процессы широко используются в технике. Нагревание воздуха при быстром сжатии нашло применение в двигателях Дизеля.
Адиабатические процессы играют немалую роль в природе. Охлаждение газа при адиабатном расширении происходит в грандиозных масштабах в атмосфере Земли. Нагретый воздух поднимается вверх и расширяется, так как атмосферное давление падает с высотой. Это расширение сопровождается значительным охлаждением. В результате водяные пары конденсируются и образуются облака.
Политропические процессы
Все указанные процессы можно рассматривать как частные случаи общего более сложного процесса – политропического процесса. Процесс, в котором теплоемкость остается постоянной (C = const ) называется политропическим.
Изохорный, изотермический, изобарный и адиабатические процессы – это частные случаи политропного процесса, при котором давление и объем связаны уравнением
PV n = const - уравнение политропы, |
(16.7) |
где коэффициент n = C − CP называется показателем политропы.
C − CV

4
При n = 0 ( C = CP ) уравнение (16.7) описывает изобару, при n = 1 ( C = ∞ ) - изотерму,
при n = γ ( C = 0 ) - адиабату, при n = ∞ ( C = Cv ) - изохору.
Реальный неидеализированный процесс соответствует промежуточным значениям показателя степени n в уравнении (16.7).
Политропа – график зависимости между параметрами состояния при C = const . В координатах p, V – гипербола; занимает промежуточное положение между изотермой и адиабатой (рис.5).
Рис.5
Обратимые и необратимые процессы
Качественной особенностью систем большого числа частиц по сравнению с чисто механическими системами является необратимый характер термодинамических процессов. Если рассматривать движение тела как механический процесс, в результате которого происходит изменение его координат и скоростей, то очевидно, что в механике без учета сил трения все процессы обратимы. Обратимость механического процесса означает, что если изменить направление процесса на обратное, то тело, обладающее определенными значениями координат и скорости в конечном состояний, будет проходить последовательность тех же состояний, которую оно проходило при первоначальном направлении процесса, но в обратном порядке, и в конце процесса окажется опять в состоянии с начальными значениями координат и скорости. Таково, например, упругое столкновение шаров, которое может происходить как в прямом, так и в обратном направлениях. Этот факт — прямое следствие второго закона Ньютона, сохраняющего постоянной полную механическую энергию системы. Запишем его в форме:
R
dp = R F .
dt
Второй закон Ньютона представляет собой уравнения движения тела.

5
Решив эти уравнения относительно координат и импульса как функций времени, можно определить с достоверностью их значения в любой последующий момент времени, если известны значения этих величин в начальный момент: r (0) и p(0). С такой же достоверностью можно, пользуясь уравнениями Ньютона, проследить за движением тела в обратном направлении. Если заменить в законе Ньютона t на (- t) и p на (- p), то уравнения движения не изменятся. Это означает, что если известны координаты и скорости тела в конечном состоянии, можно определить их значения в любой заданный момент в прошлом. Таким образом, задание начальных или конечных условий полностью определяет поведение механической системы в будущем или в прошлом.
Иная ситуация возникает в системах, состоящих из большого числа частиц. Каждая частица в отдельности, конечно, по-прежнему подчиняется уравнениям движения в форме второго закона Ньютона. Отличие состоит в том, что в системе большого числа частиц каждая отдельная частица испытывает большое число последовательных столкновений с другими частицами. Поскольку столкновения имеют случайный характер и изменяют координаты и скорости данной частицы непредсказуемым образом, то информацию о состоянии данной частицы по прошествии некоторого времени в системе большого числа частиц можно теперь определить не с достоверностью, как в механике, а только с некоторой вероятностью. Поскольку всякий термодинамический процесс включает в себя множество независимых случайных событий, то для того, чтобы он мог происходить в обратном направлении, необходимо, чтобы реализовалась вся эта случайная последовательность событий в обратном порядке. Поскольку вероятность нескольких независимых событий есть произведение вероятностей каждого из событий, то суммарная вероятность обратного процесса оказывается ничтожно малой, практически равной нулю. В качестве примера такого процесса укажем на процесс передачи тепла от более нагретого тела менее нагретому. Обратный этому процесс, как известно, сам по себе никогда не реализуется на практике. Таким образом, физическая причина необратимости термодинамических процессов заключается в случайном характере столкнове-
ний частиц, который создает неопределенность в |
|
начальных условиях к уравнениям движения |
|
частиц. |
|
Реальный термодинамический процесс всегда |
|
необратим. Тем не менее, в термодинамике говорят |
|
об обратимом процессе как о некоторой |
|
идеализированной схеме процесса. Рассмотрим |
|
некоторый равновесный процесс, совершаемый |
|
системой под влиянием внешнего воздействия так, |
|
что система последовательно проходит через ряд |
|
равновесных состояний из начального в конечное. |
Рис.6 |
Если ту же последовательность состояний можно реализовать в обратном порядке и при этом не изменить состояния окружающих тел, то процесс будет об-
ратимым (рис.6).
При этом каждая из частиц системы вовсе не вернется в свое исходное
6
состояние, важно только, что средние, равновесные характеристики системы
примут свои начальные значения, а это происходит при обратимом процессе благодаря неразличимости или тождественности частиц системы.
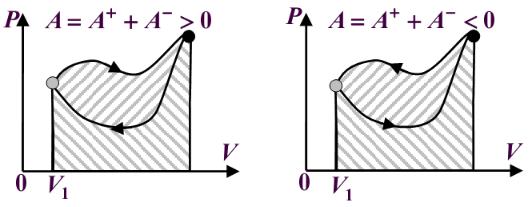
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На диаграмме состояний цикл изображается замкнутой кривой (рис.7(а, б)).
(а) |
(б) |
Рис.7 На графиках стрелками указаны направления процессов. При увеличении объе-
ма системы работа газа положительна, при уменьшении - отрицательна. В циклических (замкнутых) процессах при возвращении в исходное состояние знак общей работы зависит от направления процесса. Если при этом совершается положительная работа, цикл называется прямым (по часовой стрелке, рис. 7(а)), а если отрицательная - обратным (против часовой стрелки, рис. 7(б)).
Тепловые двигатели
Термодинамика как наука развилась в начале XIX века из необходимости объяснить работу тепловых машин. Термодинамические расчеты необходимы при конструировании любых машин, способных производить работу. Тепловой двигатель (или тепловая машина) – это устройство, которое превращает внутреннюю энергию топлива в механическую энергию (работу). Примеры: паровой, турбинный, двигатель внутреннего сгорания, двигатель Дизеля.
Принцип действия тепловых двигателей
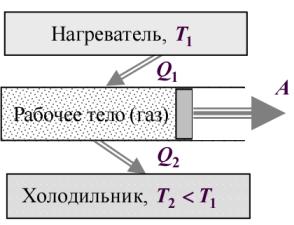
Тепловой двигатель состоит (рис.8) из нагревателя (котел, камера сгорания), рабочего тела (газ, пар) и охладителя рабочего тела (теплообменник, атмосфера). Охладителем, в конечном счете, служит окружающая среда.
Тепловой двигатель работает по принципу замкнутого цикла, совершая круговой процесс. В ходе прямого цикла рабочее тело, получив от нагревателя количество теплоты Q1, расширяется от объема V1 до объема V2. Согласно первому закону термодинамики, это количество теплоты расходуется на нагревание рабочего тела и на совершение механической работы:
7
Q1 = U2 - U1 + A12, |
(16.8) |
где (U2 - U1) — изменение внутренней энергии рабочего тела при переходе из состояния 1 в состояние 2. При обратном цикле над газом производится работа: газ сжимается и передает охладителю количество теплоты:
- Q2 = U1 - U2 + A21. |
(16.9) |
Складывая оба уравнения, получим Q1 - Q2 = A12 + A21 =A, где А — |
полная рабо- |
та, совершенная тепловой машиной за один цикл. |
|
Рис.8
Отношение полезной работы, совершенной машиной, к количеству полученного тепла составляет КПД тепловой машины:
η = |
A |
= |
Q1 − Q2 |
|
. |
(16.10) |
|
Q1 |
Q1 |
||||||
|
|
|
|
||||
Понятно, что КПД машины всегда меньше единицы, поскольку не все количество полученного тепла переходит в полезную работу.
В реальных тепловых машинах КПД, очевидно, еще меньше, так как часть тепла теряется безвозвратно в процессе работы машины. Для получения максимального КПД следует рассмотреть рабочий цикл, образованный обратимыми процессами. Этому требованию отвечает цикл Карно (см. рис.9), впервые рассмотренный французским ученым Сади Карно в 1824г.
В качестве рабочего тела в цикле Карно рассматривается идеальный газ. Цикл Карно состоит из последовательных расширения и сжатия газа, причем каждый из процессов совершается сначала изотермически, а затем адиабатически. При прямом цикле тело по-прежнему сначала получает тепло, а затем отдает его. Достоинство цикла Карно состоит в том, что все процессы обратимы, и, следовательно, КПД такой машины будет максимальным.

8
Рис.9
Пусть газ расширяется изотермически, переходя из состояния 1 в состояние 2 (рис.9). При изотермическом процессе внутренняя энергия газа не изменяется, и количество полученного тепла Q1 равно работе А12 (по формуле
(15.28) из Лекции №15):
Q = νRT ln |
V2 |
. |
(16.11) |
|
|
||||
1 |
1 |
V1 |
|
|
|
|
|
||
На участке 2-3 газ расширяется адиабатически. На участке 3-4 он сжимается опять изотермически, для чего охладителю должно быть отдано тепло Q2. Работа на участке 3-4 равна ( − Q2 ), причем
− Q |
= A |
=νRT ln |
V4 |
. |
(16.12) |
|
|
||||||
2 |
34 |
2 |
V3 |
|
||
|
|
|
|
|||
На участке 4-1 газ адиабатически сжимается, возвращаясь к исходному состоянию. Воспользуемся уравнением адиабаты в виде
TV γ −1 = const .
Для процессов 2-3 и 4-1 цикла Карно отсюда следует:
T V |
γ −1 |
= T V |
γ −1 |
, |
(16.13) |
||
1 |
|
2 |
2 |
3 |
|
|
|
T V |
γ −1 |
= T V |
γ −1 . |
(16.14) |
|||
1 |
1 |
2 |
|
4 |
|
|
|
Разделив первое уравнение на второе, получим
V2 = V3 .
V1 V4
После подстановки этого выражения в (16.12) найдем:
Q − Q |
= νR(T − T ) ln |
V2 |
. |
(16.15) |
||
|
||||||
1 |
2 |
1 |
2 |
V1 |
|
|
|
|
|
|
|
||
Подставляя (16.15) в формулу (16.10), получим выражение для КПД цикла Карно:
ηmax = |
Q1 − Q2 |
= |
T1 − T2 |
|
. |
(16.16) |
|
Q1 |
T1 |
||||||
|
|
|
|
||||
9
Из формулы (16.16) следует, что КПД тепловой машины определяется только разностью температур нагревателя и холодильника. КПД не зависит ни от свойств рабочего тела, используемого в машине, ни от свойств самой машины. Полученный результат показывает, что при T1 = T2 КПД машины равен нулю, т.е. машина не совершает работы. Работа максимальна (η = 1) при T2 = 0 К, то есть машина тем выгоднее, чем ниже температура охладителя.
Реальный КПД:
а) у карбюраторного двигателя внутреннего сгорания – порядка 30%; б) у дизельного двигателя – порядка 40%.
Обобщим выше сказанное следующими утверждениями:
1)КПД цикла Карно не зависит от рода рабочего тела.
2)КПД определяется только разницей температур нагревателя и холодильника.
3)КПД не может быть 100% даже у идеальной тепловой машины, так как при этом температура холодильника должна быть T2 = 0 К, что запрещено законами квантовой механики и третьим законом термодинамики.
4)Невозможно создать вечный двигатель второго рода, работающий в тепловом равновесии без перепада температур, т.е. при T1 = T2, так как в этом случае
ηmax = 0 .
5) Тепловые двигатели повышают энтропию замкнутой системы.
{Понятие “ энтропия” и третий закон термодинамики рассмотрим далее в данной лекции.}
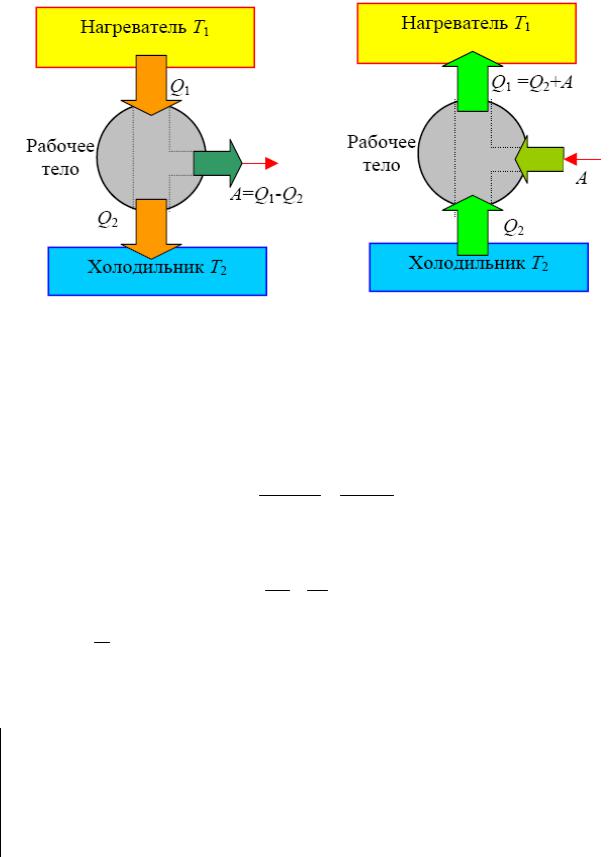
Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине: от термостата с более низкой температурой T2 за цикл отнимается количество теплоты Q2 и отдается термостату с более высокой температурой T1 > T2. При этом Q = Q1 − Q2 = A или Q1 = Q2 + A.
Количество теплоты Q1, отданное системой термостату T1, больше количества теплоты Q2, полученного от термостата T2 на величину работы, совершенной над системой.
Эффективность холодильной машины характеризует холодильный коэффициент η′ — отношение отнятой от термостата с более низкой температурой количества теплоты Q2 к работе A, которая затрачивается на приведение холодильной машины в действие:
η '= |
Q2 |
= |
Q2 |
. |
(16.17) |
|
|
||||
|
A |
Q1 − Q2 |
|
||
На рис.10 представлены для наглядности принципиальные схемы теплового двигателя и холодильной машины.
10
Тепловой двигатель |
Холодильная машина |
Рис.10
Энтропия
Мы уже убедились, что КПД необратимого кругового процесса всегда меньше, чем КПД при обратимом цикле. Этот результат можно сформулировать в следующем виде:
Q1 − Q2 £ T1 − T2 .
Q1 T1
Знак равенства соответствует случаю обратимых процессов. Отсюда нетрудно получить соотношение, которое играет важную роль в термодинамике:
Q2 - Q1 ³ 0 . (16.18)
T2 T1
Величина Q называется энтропией. Она, как видно из полученного соотноше-
T
ния, остается неизменной при обратимом процессе и возрастает, если термодинамический процесс необратим. Энтропия — важная термодинамическая характеристика системы, такая же, как, например, внутренняя энергия.
Утверждение, что при необратимых процессах энтропия замкнутой сис-
темы возрастает, составляет содержание второго начала термодинамики.
Возрастание энтропии системы при необратимом процессе выражает тот факт, что тепло само по себе не может переходить от менее нагретых к более нагретым телам. Последнее утверждение можно рассматривать также как фор-
мулировку второго начала термодинамики.
Из изложенного следует важный вывод. Поскольку КПД реальной тепловой машины всегда меньше, чем КПД идеальной машины (работающей по циклу Карно), а обязательным условием работы последней является необходимость отдавать тепло более холодному телу, становится очевидной невозможность создания так называемого вечного двигателя второго рода — устройства, осу-
