- •Различают 4 вида субстратной специфичности ферментов:
- •Применение ферментов в качестве лекарственных препаратов
- •Окислительное декарбоксилирование пировиноградной кислоты: суммарное уравнение, строение и регуляция пируватдегидрогеназного комплексeа, связь с цпэ, биологическое значение.
- •Цикл трикарбоновых кислот (цитратный цикл): последовательность реакций, связь с цпэ, регуляция, биологическая роль.
- •Энергетическая
- •Теория Митчелла. Условия синтеза атф. Коэффициент фосфорилирования р/о.
- •Анаэробный гликолиз: схема процесса, энергетический эффект, и биологическое значение.
- •Лактатный цикл. Биологическое значение.
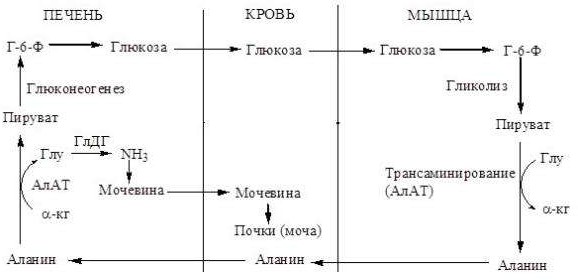
- •Глюконеогенез из аминокислот и глицерина. (схема процесса). Глюкозо- аланиновый цикл. Биологическое значение.
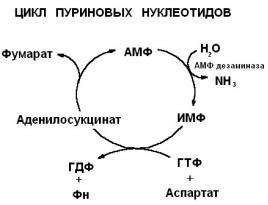
- •Синтез пуриновых нуклеотидов: схема, ферменты, регуляция, запасные пути синтеза.
- •Нарушения обмена пуриновых нуклеотидов: гиперурикемия, синтдром Леша-Нихана. Биохимические основы лечения подагры.
- •Биосинтез пиримидиновых нуклеодитов: схема, ферменты, регуляция, нарушения.
- •Нарушение обмена пиримидиновых нуклеотидов
- •Наследственная форма
- •Приобретенная форма
- •Распад пиримидиновых нуклеотидов: схема, ферменты.
- •Аденилатциклазная система передачи сигналов в клетки, роль g-белков в механизме трансдукции сигнала, вторичные посредники.
- •Либерины, статины, тропные гормоны гипофиза.
- •Адреналин: строение, синтез, регуляция секреции, ткани-мишени, механизм передачи сигнала, влияние на метаболизм в тканях-мишенях.
- •Мишени и эффекты
- •Ну или проще
- •80. Обмен железа: всасывание, транспорт, депонирование, регуляция, Роль железа в организме. Нарушения обмена железа в организме человека.
- •Существуют три способа перемещения железа из просвета кишечника в энтероциты:
- •Регуляция
- •Роль железа в организме:
- •Избыток железа
- •Железодефицит
- •Противосвертывающие системы крови: антитромбиновая и фибринолитическая.
- •Функции протеина s (ps):
- •Механизмы обезвреживания токсических веществ в печени: микросомальное окисление, реакции конъюгации
- •Nadph-зависимая монооксигеназная система
- •Nadh-зависимая монооксигеназная система
- •Распад гема, образование и обезвреживание билирубина. «Прямой» и
- •Биохимические изменения при нарушении обмена билирубина
- •Референтные величины концентрации общего билирубина в
- •Гемолитическая (надпеченочная) желтуха
- •Паренхиматозная (печёночная) желтуха.
- •Лабораторная диагностика
- •Механическая или обтурационная (подпеченочная) желтух.
- •Диагностическое значение определения билирубина и других желчных пигментов в крови и моче.
- •Эластин.
- •Свойства:
- •Возвращается в первоначальное состояние после снятия нагрузки.
- •Структурные и регуляторные белки мышц и их роль в мышечном сокращении
- •Функции субъединиц тропонина
- •Толстые нити образованы белком миозином
- •– Й этап.
- •На этой стадии атф не расщепляется, т.Е. Служит не источником энергии, а аллостерически изменяет конформацию миозиновой головки и тем самым ослабляет связь миозина с актином
- •Мышечное расслабление
- •Сокращение гладких мышц
- •Стадия – стадия начальных изменений
- •Стадия – стадия поздних изменений
- •Усилением:
- •Ослаблением:
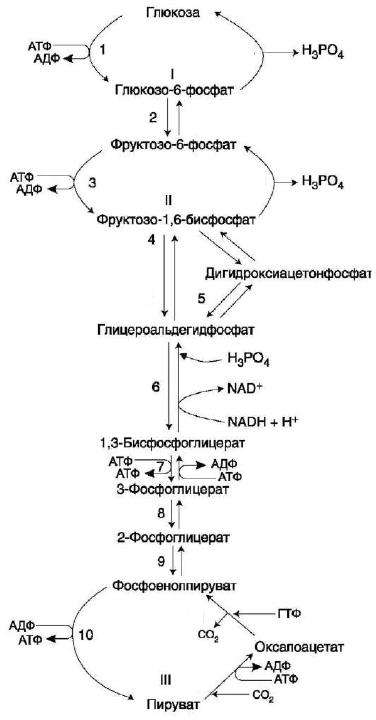
Анаэробный гликолиз: схема процесса, энергетический эффект, и биологическое значение.
Анаэробный гликолиз: позволяет синтезировать АТФ при недостатке кислорода в тканях, особенно:
в мышцах в первые минуты мышечного сокращения;
в эритроцитах, не имеющих митохондрии;
в клетках злокачественных опухолей.
Для большинства тканей – это аварийный путь, т.к. обеспечивает энергией в условиях гипоксии, при тяжелом физическом труде, болезнях органов дыхания и сердечно-сосудистой системы.
При анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу.
В результате 11-ой реакции происходит восстановление ПВК и образуется молочная кислота. Реакция протекает при участии фермента лактатдегидрогеназы 5 и кофермента НАДН, образовавшегося в шестой реакции.
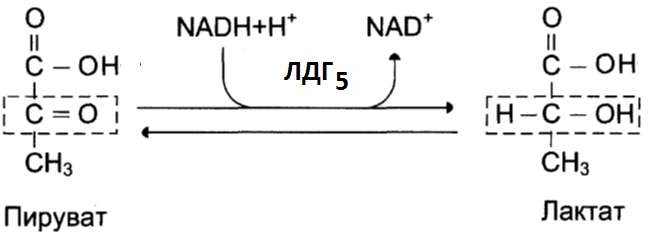
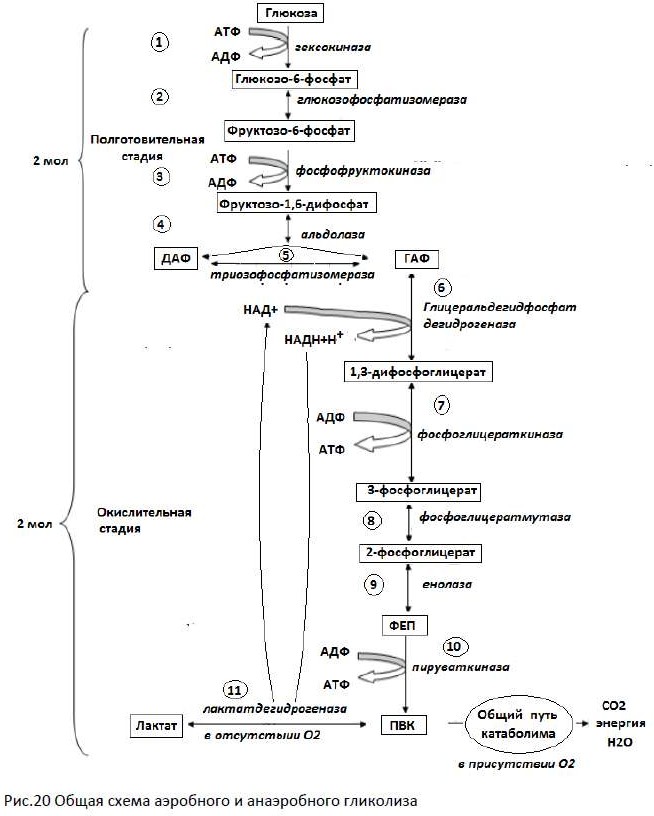
Анаэробный гликолиз протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. Образование двух моль лактата из глюкозы сопровождается синтезом всего двух моль АТФ в реакциях субстратного фосфорилирования, потому что NAДH, полученный при окислении глицероальдегидфосфата, не используется дыхательной цепью, а акцептируется пируватом.
19.
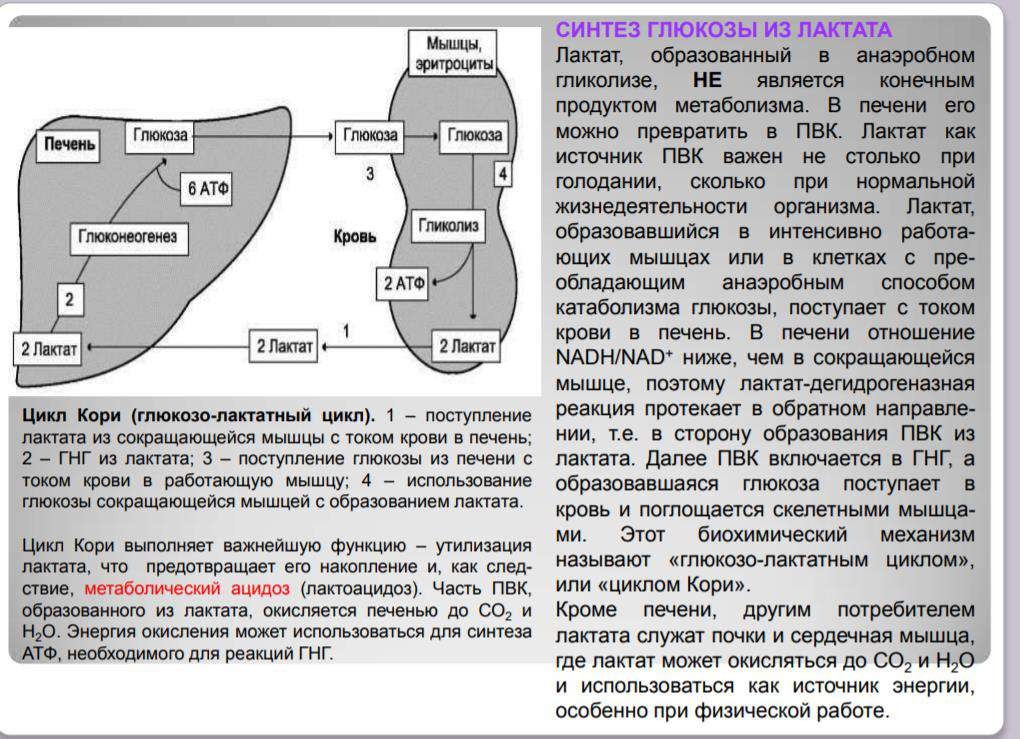
Глюконеогенез из молочной кислоты (схема процесса). Глюкозо-
Лактатный цикл. Биологическое значение.
20.
Глюконеогенез из аминокислот и глицерина. (схема процесса). Глюкозо- аланиновый цикл. Биологическое значение.


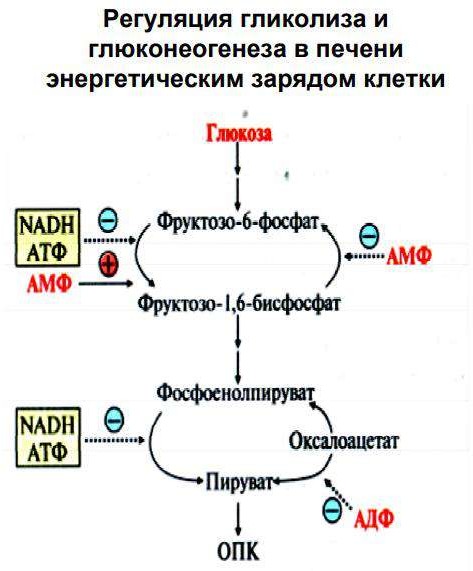
Регуляция гликолиза и глюконеогенеза в печени.
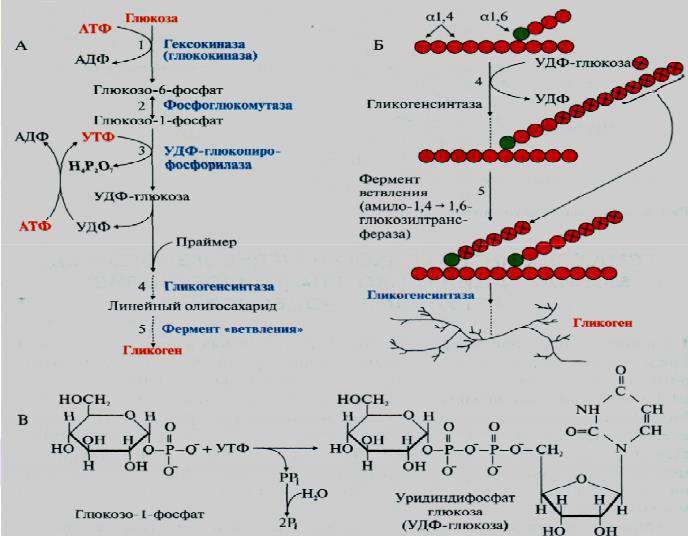
Строение, свойства и биологическая роль гликогена. Биосинтез и мобилизация гликогена.

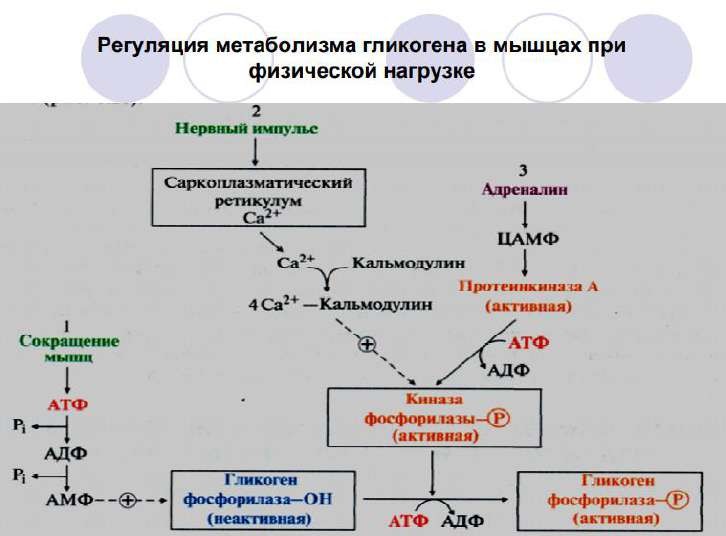
Особенности гормональной регуляции обмена гликогена в печени и мышцах в зависимости от ритма питания и физической активности.
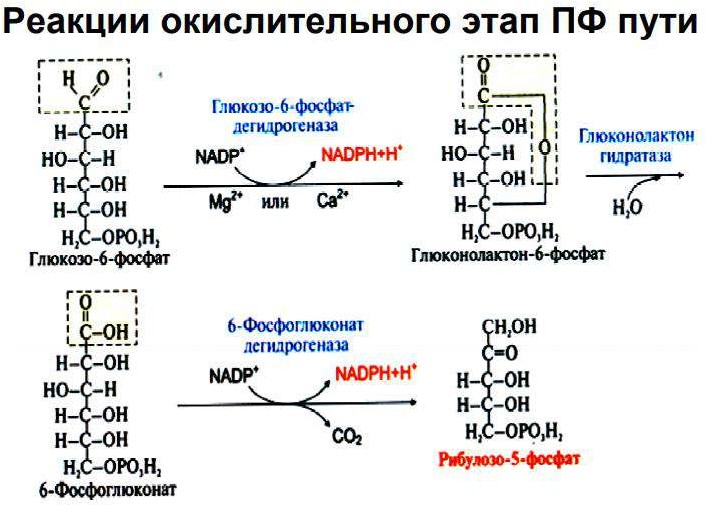
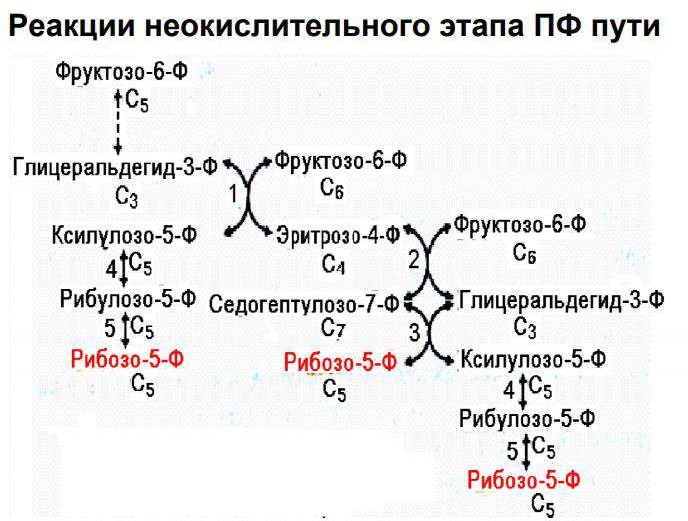
Пентозофосфатный путь превращения глюкозы: схема окислительной и неокислительной ветви, физиологическое значение.
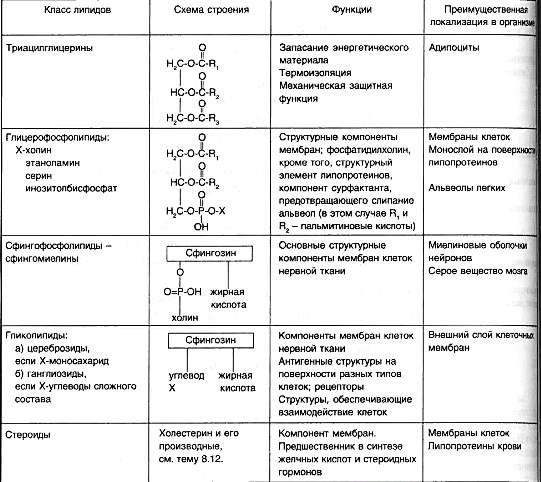
Основные липиды в организме человека: строение, функции.
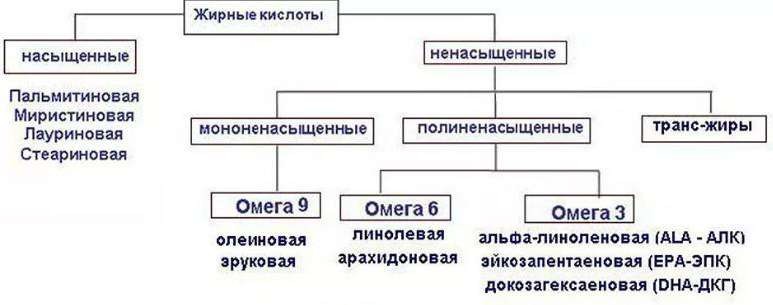
Основные жирные кислоты в организме человека: строение,
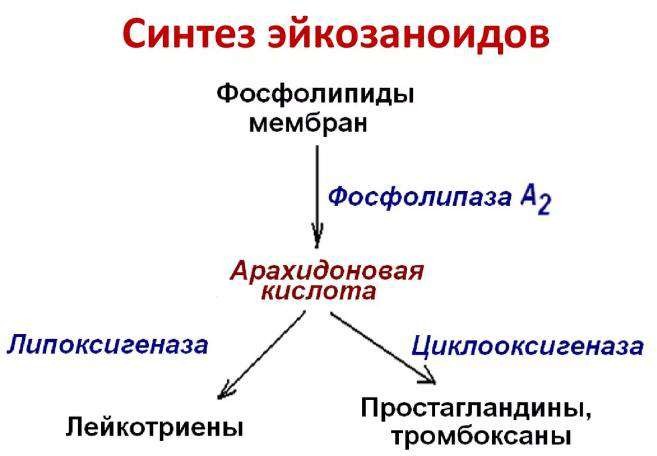
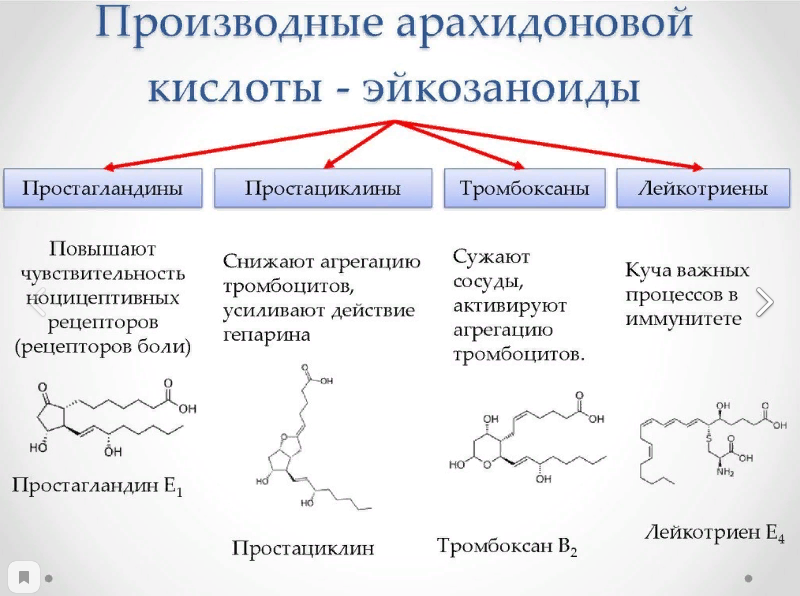
функции. Эйкозаноиды, синтез, классификация, биологические эффекты: роль в развитии воспалительного процесса и в свертываемости крови.
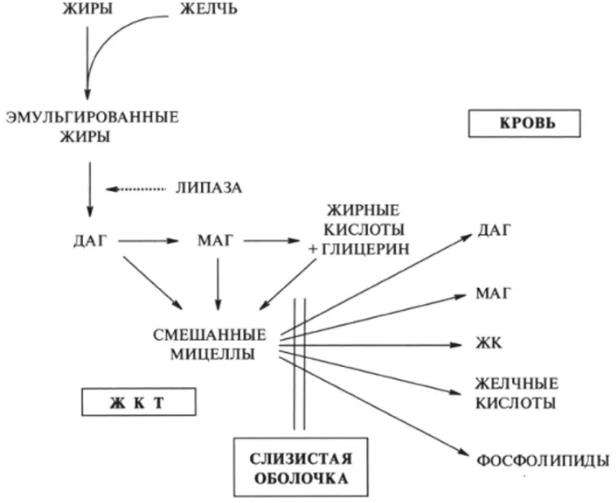
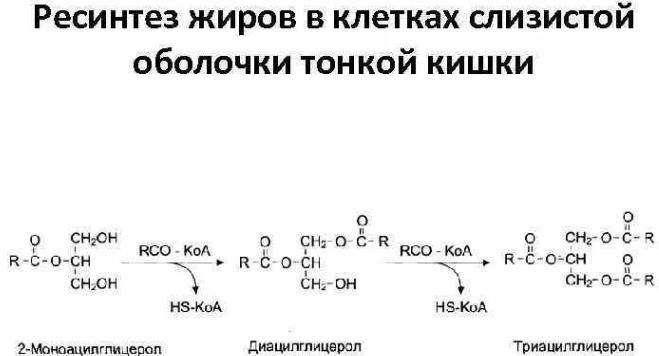
Переваривание и всасывание пищевых жиров. Ресинтез жиров в клетках кишечника, транспорт кровью, усвоение тканями. Роль желчи при переваривании и всасывании липидов.
β-окисление жирных кислот: схема процесса,значение, регуляция, связь с ЦТК и ЦПЭ.
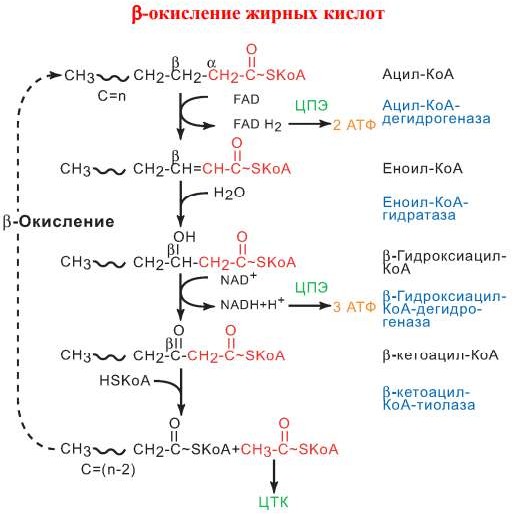
Биосинтез жирных кислот: схема процесса, регуляция, зависимость от ритма питания, биологическая роль.
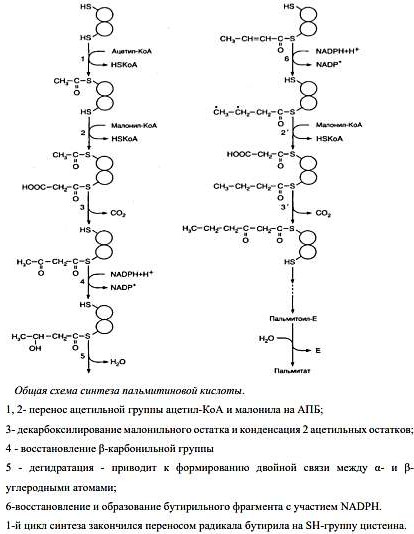
Синтез жиров из углеводов в печени и жировой ткани, биологическая роль, гормональная регуляция.
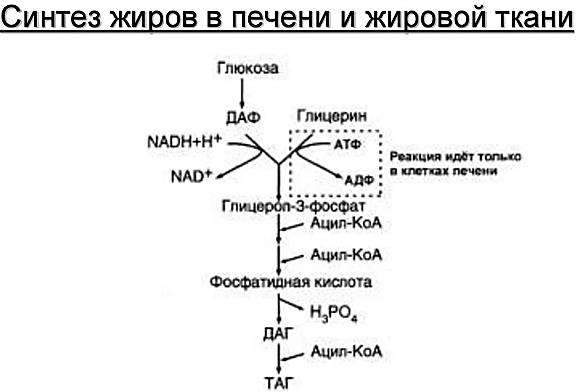
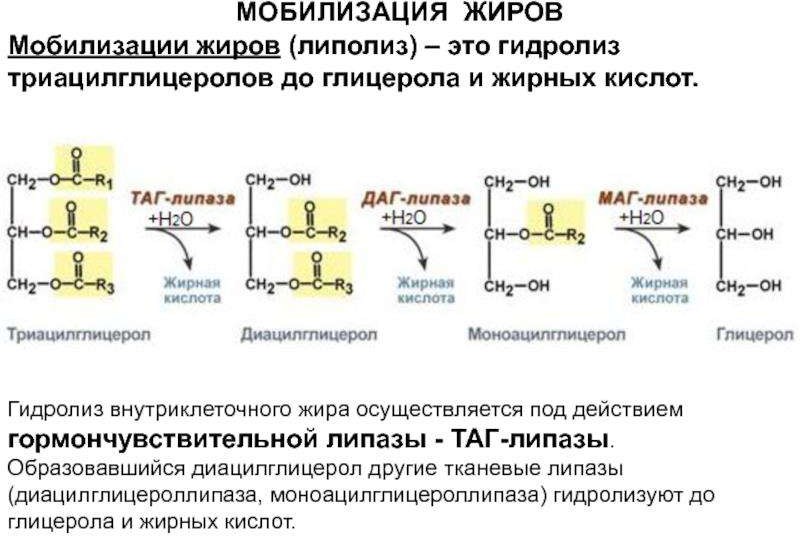
Мобилизация жиров из жировой ткани, биологическая роль, гормональная регуляция.
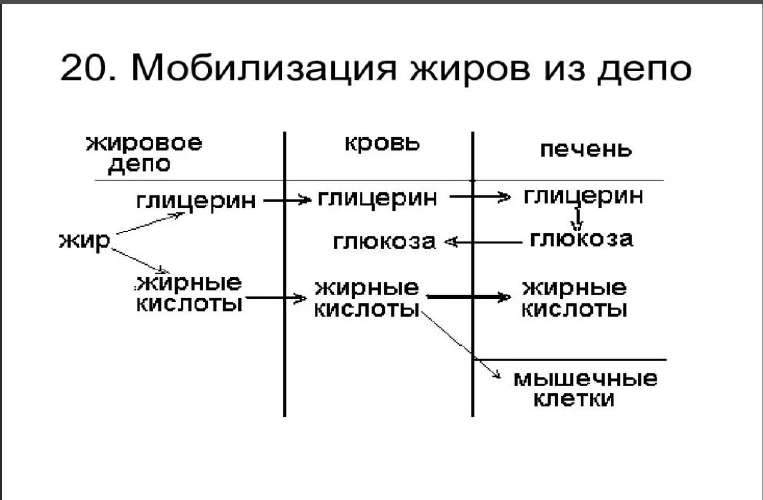

Синтез и использование кетоновых тел: последовательность реакций, биологическое значение. Причины и последствия кетонемии.

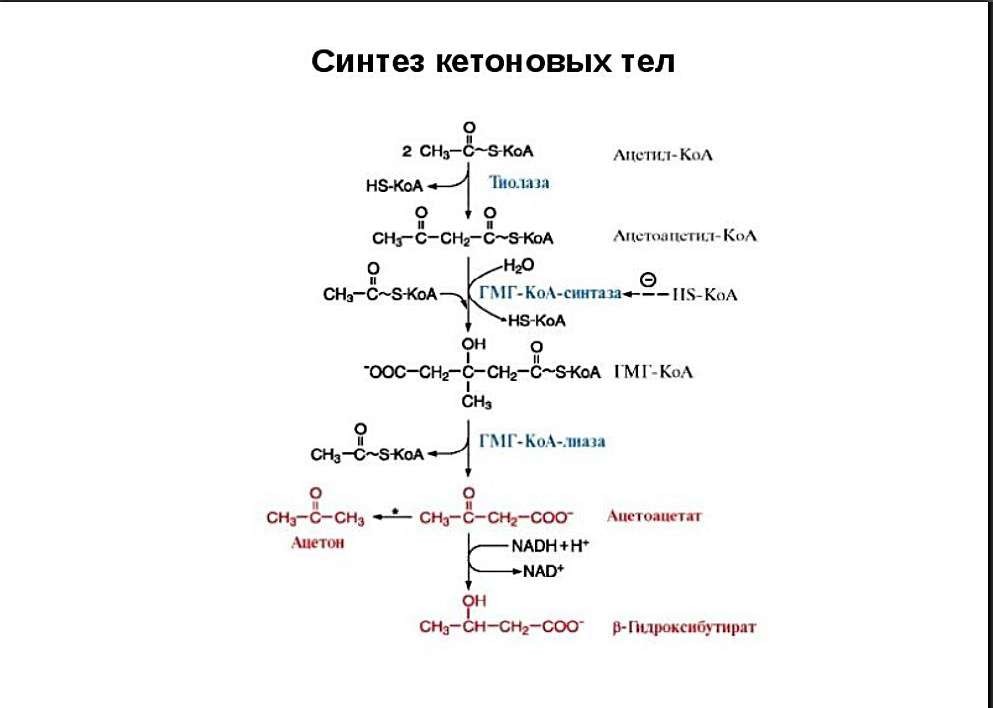




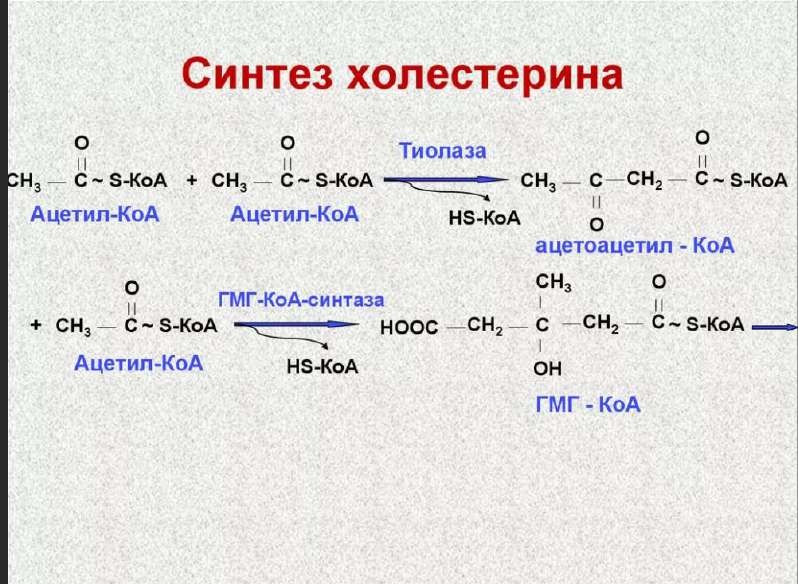
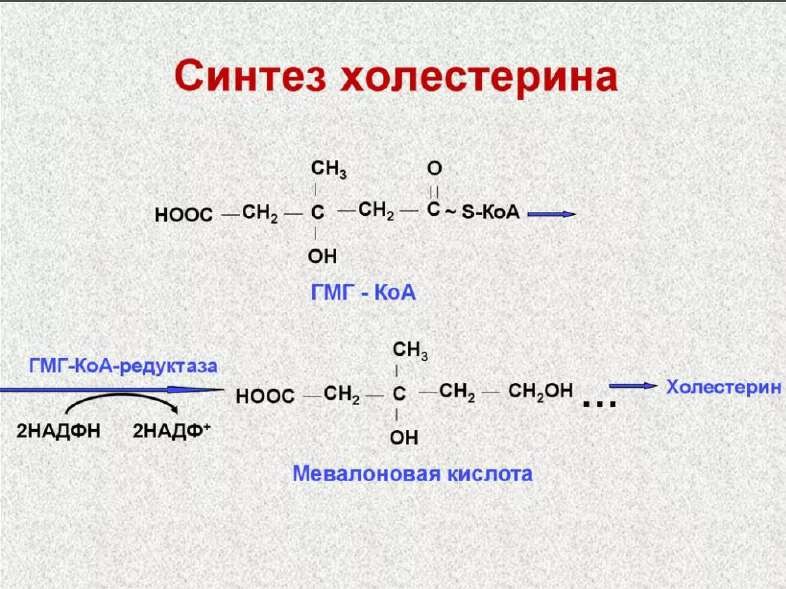
Холестерол: строение, функции, синтез (последовательность реакций до мевалоновой кислоты), регуляция синтеза. Баланс холестерола в организме.Роль АхАТ.
Основные функции холестерола:
компонент мембран, отвечает за вязкость гидрофобного слоя;
компонент монослоя липидов на поверхности липопротеинов;
предшественник желчных к-т, стероидных гормонов, витамина D3.
Регуляция синтеза ХС в печени:
Регуляторный фермент синтеза ХС в печени – ГМГ-КоA-редуктаза.
2 способа регуляции действия ГМГ-КоА-редуктазы:
регуляция активности фермента:
Фосфорилирование и дефосфорилирование.
ГМГ-КоA-редуктаза – активна в дефосфорилированной форме и активируется в абсорбтивный период при участии инсулина. Ингибируется – путем фосфорилирования под действием глюкагона (в постабсорбтивный период и при голодании).
регуляция количества фермента:
а) регуляция на уровне транскрипции:
Стероиды – холестерол и желчные кислоты – подавляют транскрипцию гена ГМГ-КоА-редуктазы и синтез этого фермента.
Эстрогены – индукторы синтеза ГМГ-КоАредуктазы – повышают синтез этого фермента.
б) регуляция протеолиза ГМГ-КоА-редуктазы: ХС, желчные кислоты, оксипроизводные ХС и кортикостероиды стимулируют протеолиз молекул ГМГ-КоА-редуктазы, т.е. деградацию функционально активного фермента.

АхАТ (ацилхолестеролацилтранфераза) способствует внутриклеточному накоплению холестерина в виде эфиров.
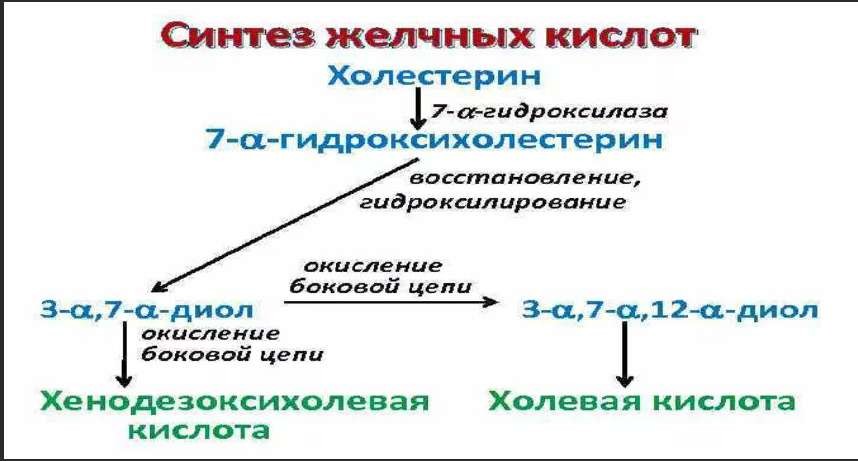
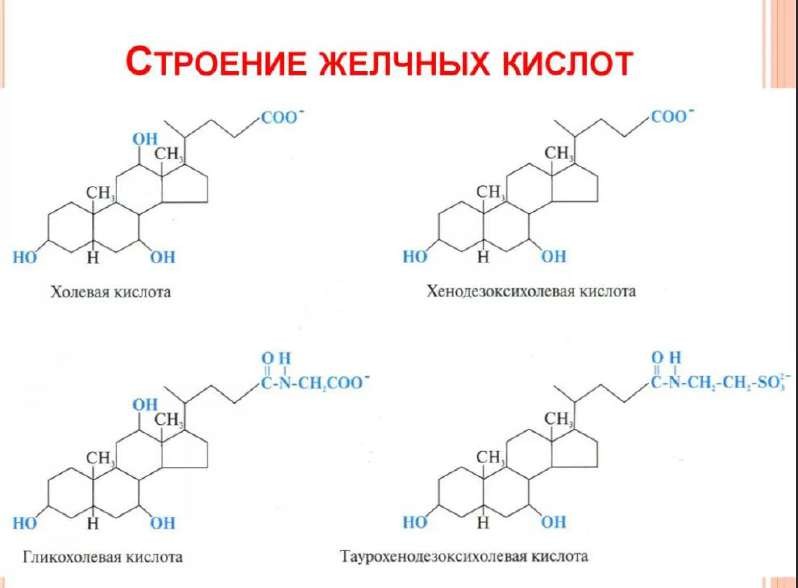
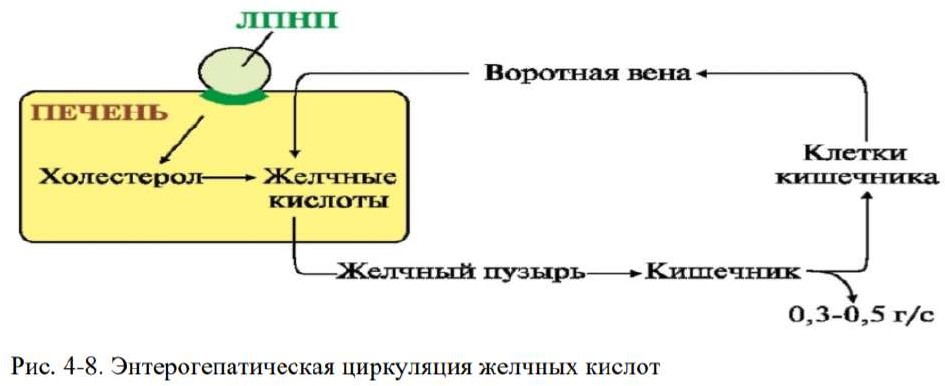
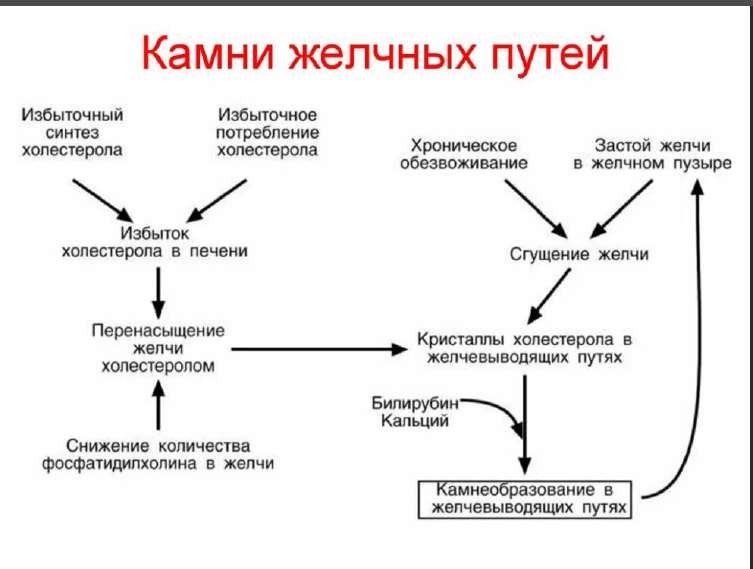
Желчные кислоты: особенности строения, функции, синтез, энтерогепатическая циркуляция. Молекулярные механизмы развития желчно- каменной болезни.

Общая характеристика липопротеинов плазмы крови: типы, состав, место синтеза, функции. Гиперлипопротеинемии.
Липопротеины – специальные комплексы липидов и белков.
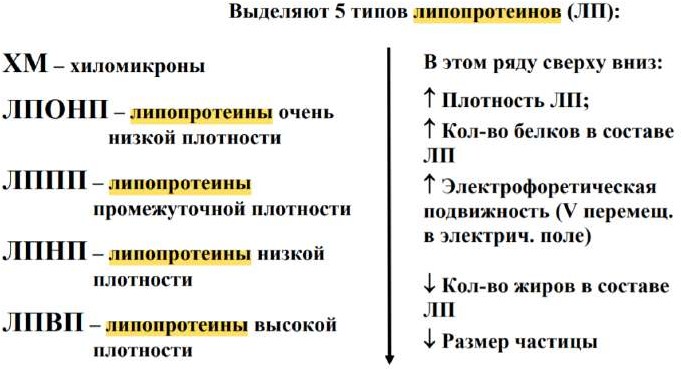
Состав липопротеинов: Белки, Триацилглицериды, Холестерин, фосфолипиды
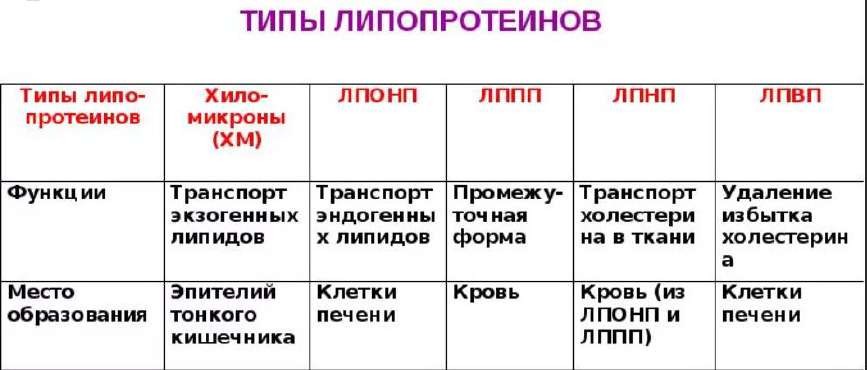
Гиперлипопротеинемии – это повышение содержания липопротеинов в плазме крови выше нормы.
Причины гиперхолестеролемии:
Гиперкалорийное питание – распространенный фактор, т.к. для синтеза ХС необходимы только Ацетил-KoA, АТФ и NADPH. Все эти субстраты образуются из ГЛК => ↑ синтез ХС и ЛПОНП в печени => ↑ [ЛПНП] в крови
=> развивается гиперхолестеролемия.
↓ с возрастом эффективности регуляции подавления синтеза ХС в печени, поступающим с пищей ХС => ↑ кол-во ХС в печени и ↑ синтез ЛПОНП => ↑ [ЛПНП] в крови => развивается гиперхолестеролемия.
При недостатке фосфатидилхолина может замедляться формирование в печени ЛПВП, что приведет к ↑ содержания в крови ЛПНП, перегруженных холестеролом, и гиперхолестеролемии. 4)Наследственный дефект ЛХАТ => нарушается способность ЛПВП забирать ХС из тканей и ЛП => ↑ риск развития гиперхолестеролемии.
Семейная гиперхолестеролемия – наследственный дефект ЛПНП- рецепторов или мутация в гене апо B-100. При этом заболевании наблюдается атеросклероз уже в детском возрасте.
Вторичные гиперхолестеролемии – химические модификации липидов и белков ЛПНП и ЛПНПрецепторов.
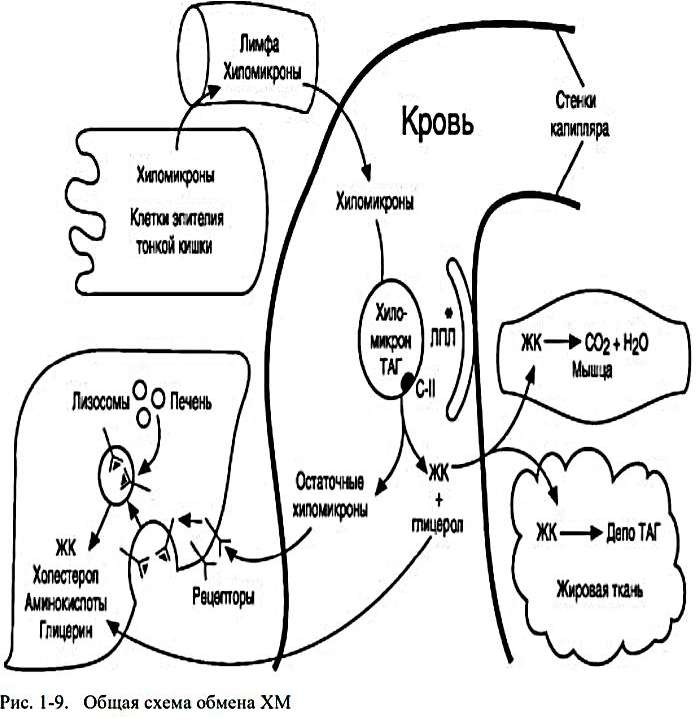
Хиломикроны (ХМ): образование, состав, функции, схема обмена.



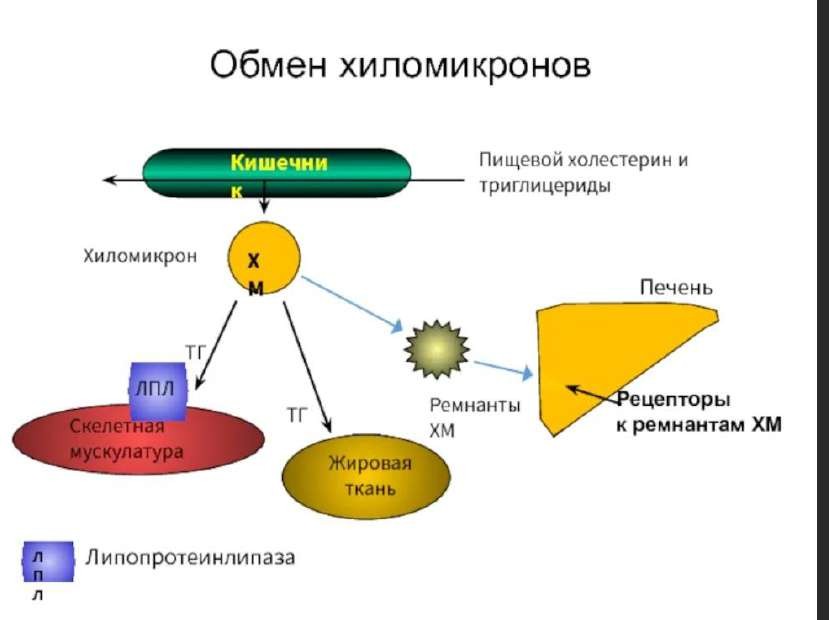 \
\
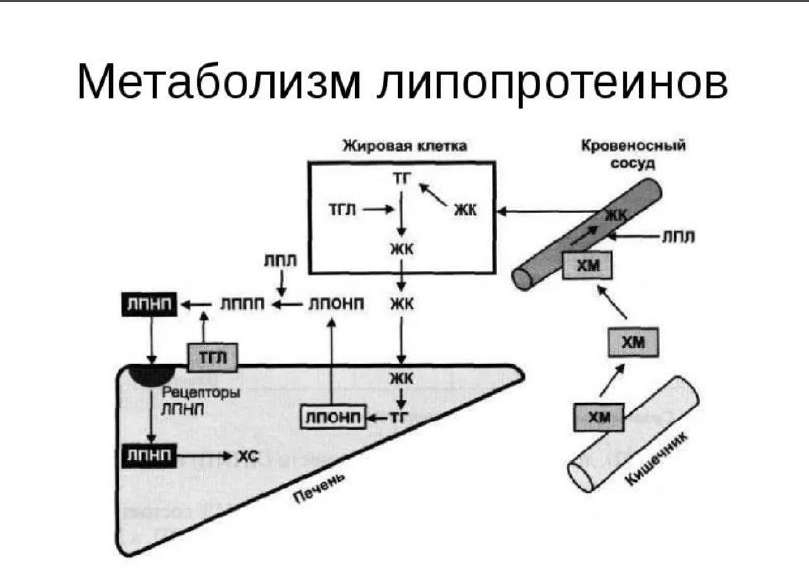
Липопротеины очень низкой плотности (ЛПОНП): образование, состав, функции, схема обмена.


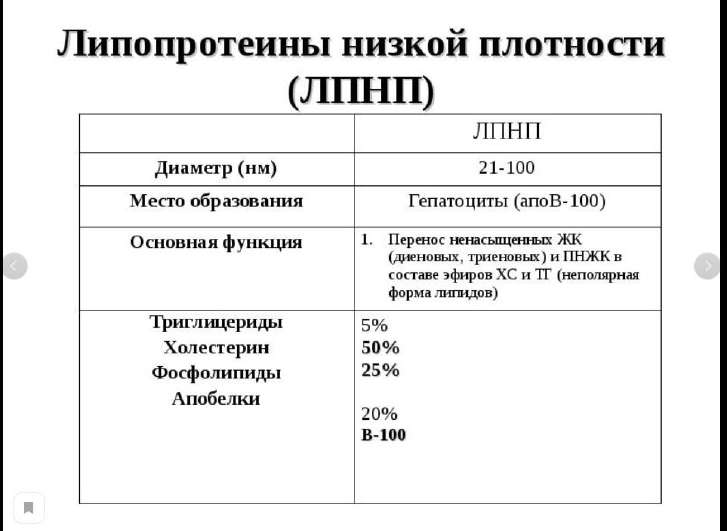
Липопротеины низкой плотности (ЛПНП): образование, состав, функции, схема обмена.
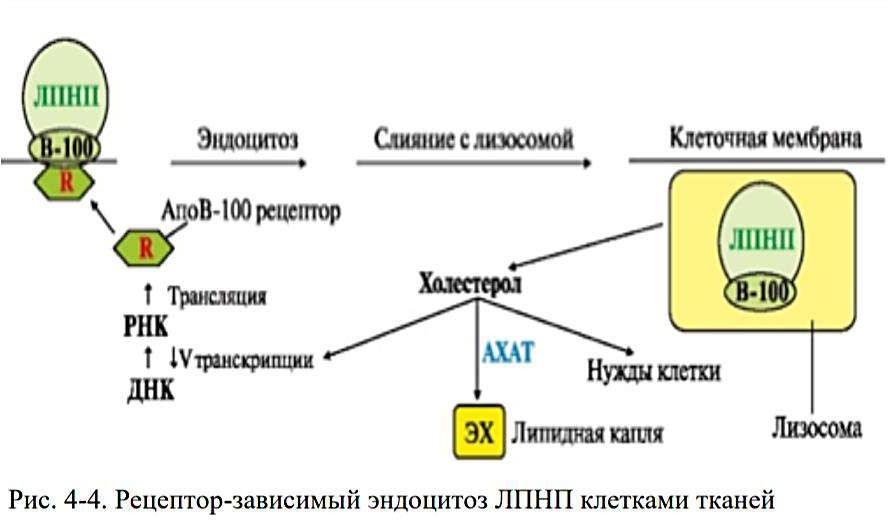
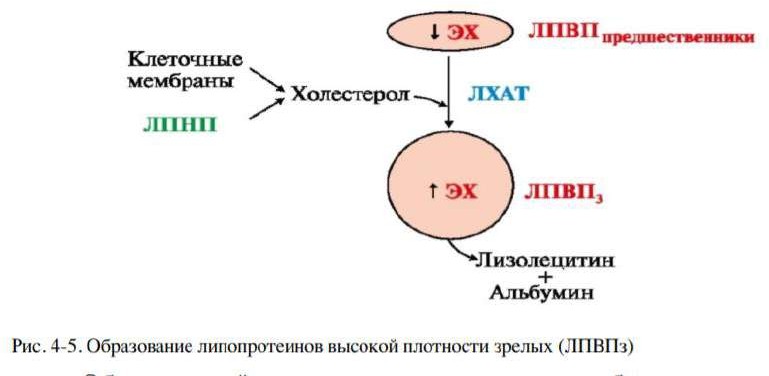
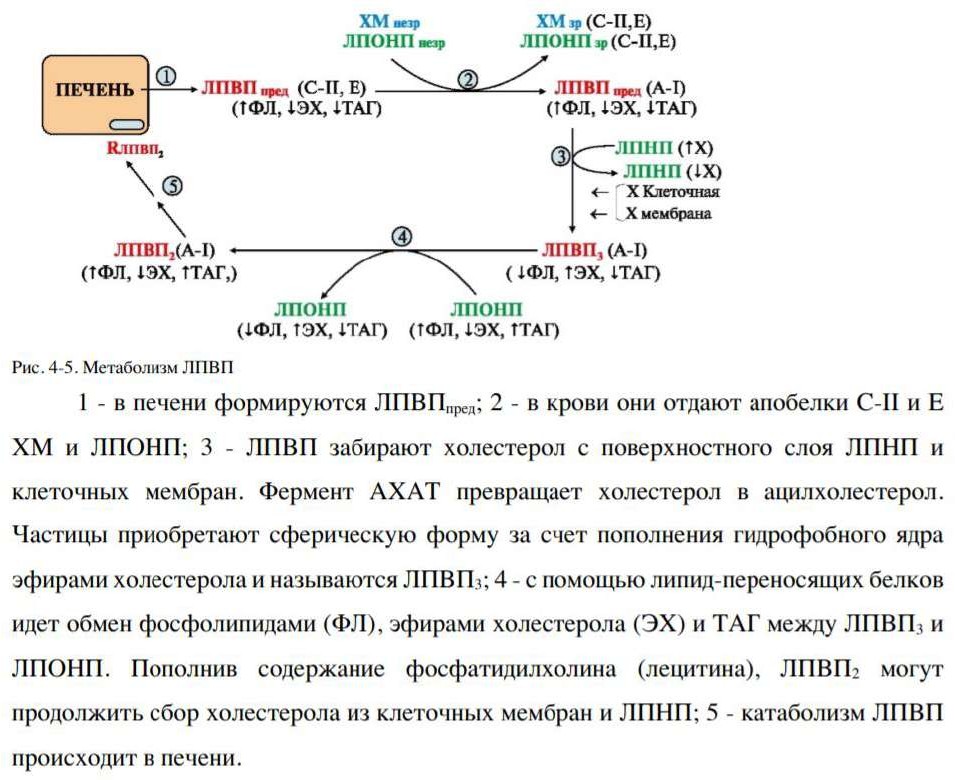
Липопротеины высокой плотности (ЛПВП): образование, состав, функции, схема обмена. Роль ЛХАТ.

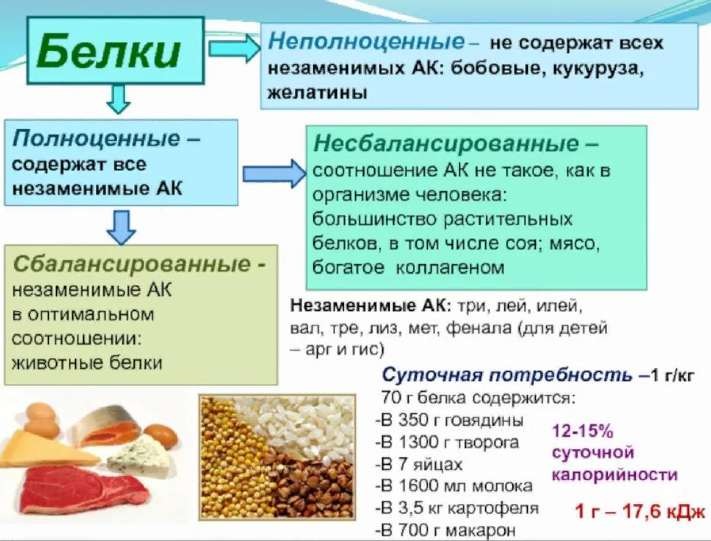
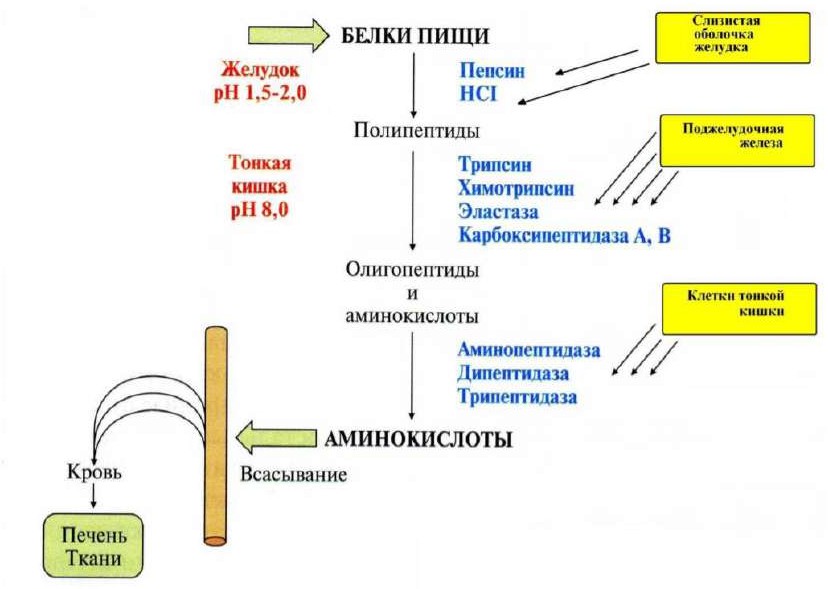
Полноценные и неполноценные белки. Значение полноценного белкового питания для человека. Переваривание белков в желудочно-кишечном тракте: ферменты, механизм активации, биологическое значение.
Трансаминирование аминокислот: ферменты, роль витамина B6 в реакциях трансаминирования, биологическое значение процесса. Диагностическое значение определения активности трансаминаз.
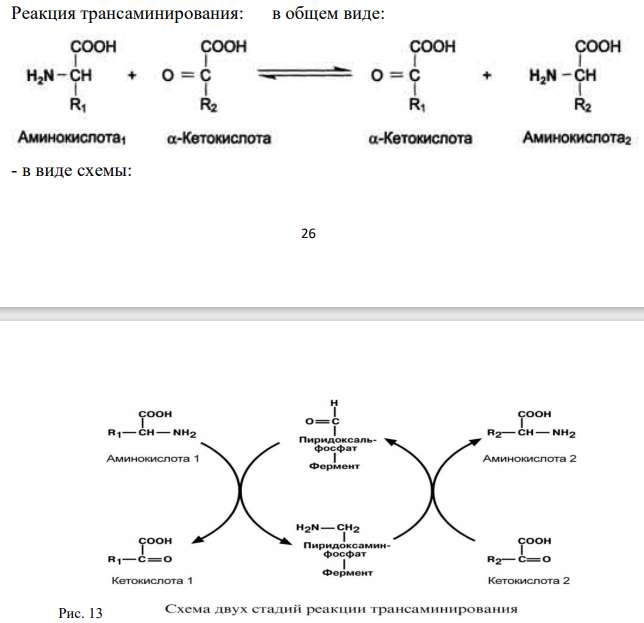
Значение – образование заменимых АК
B6 – перидоксальфосфат, участвует в реакциях трансаминирования в роли кофермента. Является промежуточным этапом переноса аминогруппы.
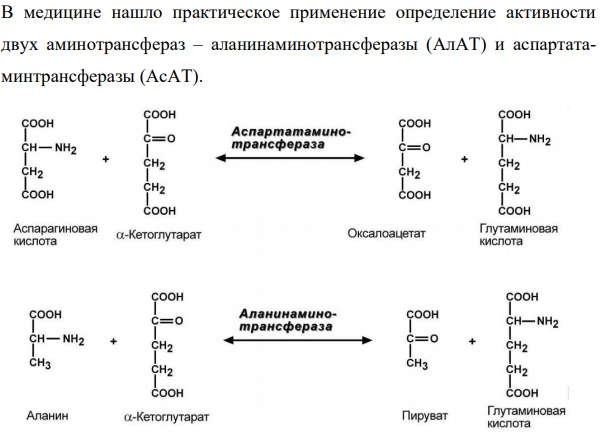
АлАТ – поражение печени, АсАТ - сердце
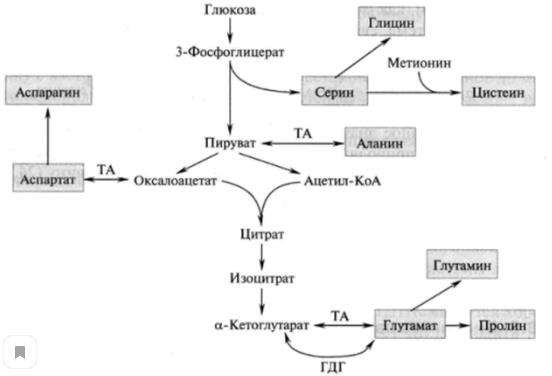
Заменимые и незаменимые аминокислоты. Биосинтез заменимых аминокислот из глюкозы.
Синтез заменимых аминокислот зависит от образования соответствующих кетокислот, которые являются их предшественниками. (трансаминирование)

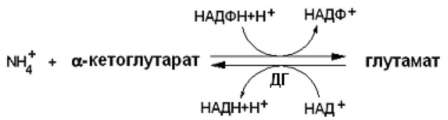
Дезаминирование аминокислот: типы, роль глутаматдегидрогеназы в реакциях дезаминирования. Биологическое значение.
Существует несколько видов дезаминирования:
Окислительное (прямое – характерно только для глутаминовой кислоты и непрямое – характерно для остальных аминокислот)
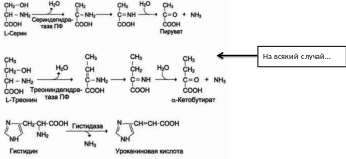
Неокислительное – характерно для серина, треонина, цистеина и гистидина;
Прямое окислительное дезаминирование. В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному
дезаминированию с образованием аммиака и α--кетоглутаровой кислоты:
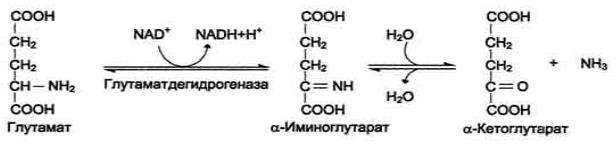
Непрямое окислительное дезаминирование (для всех остальных): первый этап - прямое окислительное дезаминирование, остальное по схеме:
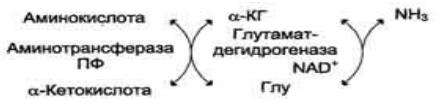
Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных) и катализирует реакцию дезаминирования.
Значение – удаление аминогруппы.
Пути обмена безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Глюконеогенез из аминокислот, значение процесса.
Аминокислоты, при распаде которых образуются пируват и метаболиты ЦТК, называются
гликогенными аминокислотами.
Аминокислоты, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел называют кетогенными.
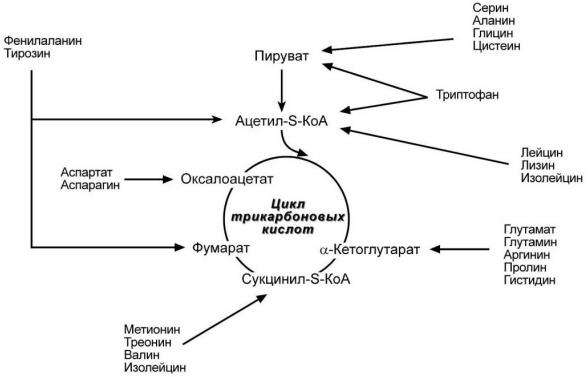
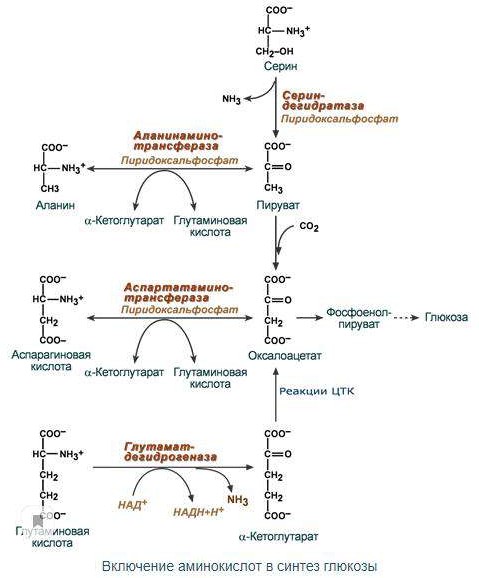
Значение: синтез глюкозы из белков в период голодания.
Декарбоксилирование аминокислот в тканях. Обезвреживание биогенных аминов в печени с участием ферментов МАО и ДАО.
Отщепление α-карбоксильной группы аминокислот в виде СО2 катализиpуется декаpбоксилазами, кофактоpом которых является пиpидоксальфосфат. В результате декарбоксилирования образуются биогенные амины:
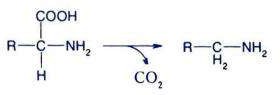
Глутаматдекарбоксилаза
Гистидиндекарбоксилаза ПФ
 Гистидин
Триптофан
L-глутамат
Гистидин
Триптофан
L-глутамат
гистамин Серотонин ГАМК
На всякий случай…
Дезаминирование протекает под действием ферментов моно- и диаминооксидаз (МАО и ДАО) с образованием свободного аммиака и альдегидов, которые окисляются до соответствующих карбоновых кислот и выводятся из организма.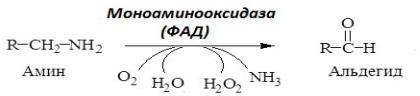
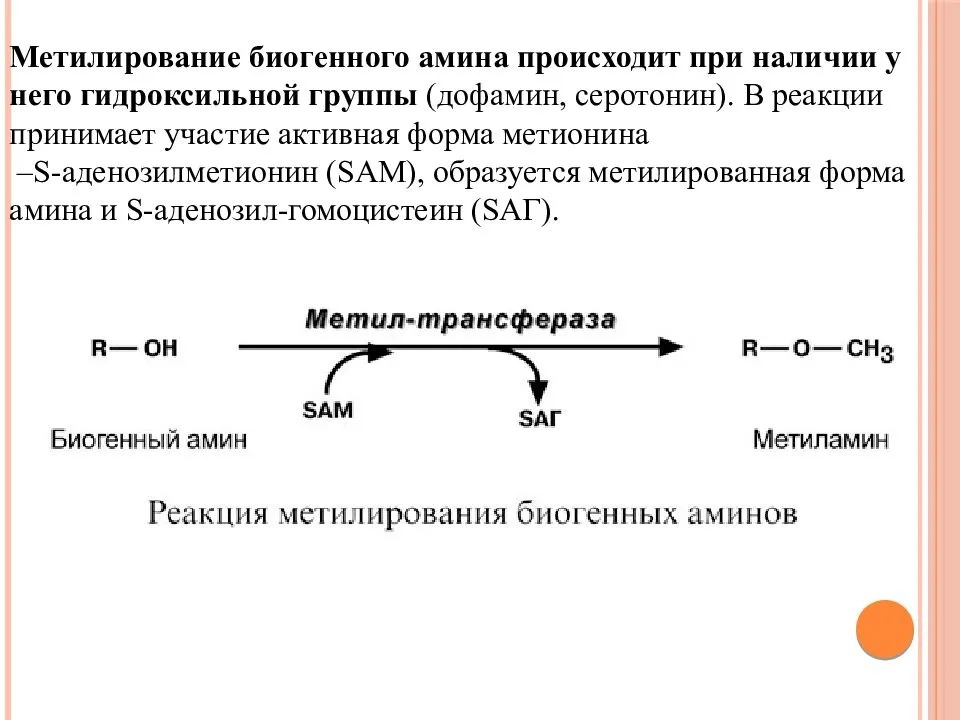
А также метилирование!
 Пути
образования
и
обезвреживания
аммиака
в
тканях.
Токсичность
аммиака.
Гипераммониемии:
причины
и
следствия.
Пути
образования
и
обезвреживания
аммиака
в
тканях.
Токсичность
аммиака.
Гипераммониемии:
причины
и
следствия.
В организме человека аммиак образуется в ходе следующих процессов:
дезаминирование аминокислот в тканях - основной путь
окислительное дезаминирование биогенных аминов
распад пуриновых и пиримидиновых оснований.
гниение белков в толстом кишечнике в результате жизнедеятельность бактерий
Аммиак диффундирует через мембрану и в клетке гидратируется с образованием гидроксида аммония(NH3 + H2O = NH4OH), что вызывает внутриклеточный метаболический алкалоз. pH вне- и внутриклеточной среды повышается.
Обезвреживание:
В
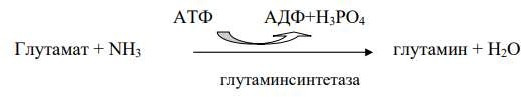
Местное обезвpеживание аммиака происходит за счет: образование амидов аминокислот; восстановительного аминирования α-кетоглутарата; глюкозо-аланинового цикла. Общее
(конечное) обезвреживание аммиака – за счет: синтеза мочевины в печени; образования солей
аммония в почках.
пири
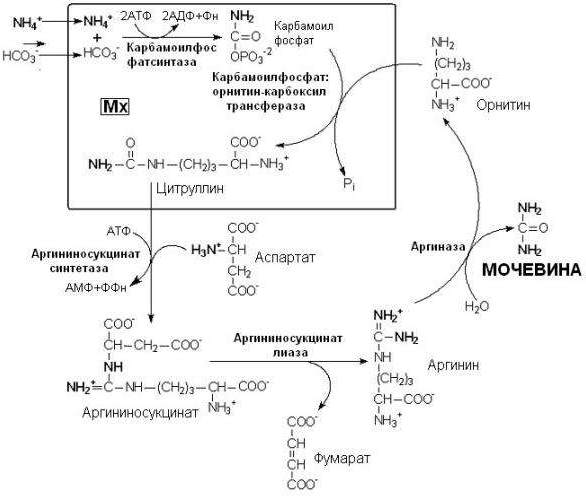
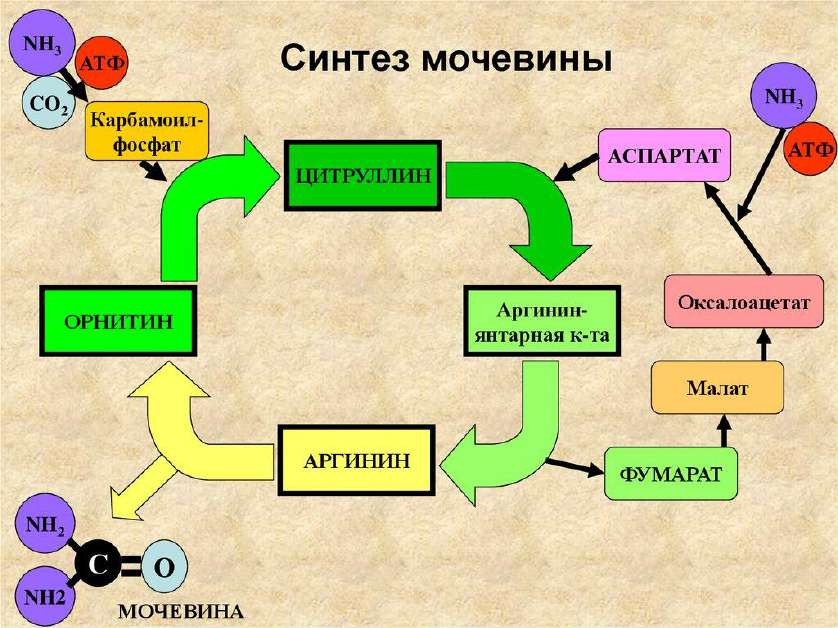
Биосинтез мочевины: транспортные формы аммиака в крови, схема процесса, биологическое значение.
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в
 меньшей
степени
аспарагин
и
глутамат,
некоторое
количество
аммиака
находится
в
крови
в
свободном
виде.
меньшей
степени
аспарагин
и
глутамат,
некоторое
количество
аммиака
находится
в
крови
в
свободном
виде.
Значение: Образование безвредной формы аммиака для его выведения из организма.
 Аминокислоты
- предшественники биогенных аминов.
Образование
биогенных
аминов
(ГАМК,
гистамина,
серотониа
и
др.),
их
биологическая
роль,
пути
инактивации.
Аминокислоты
- предшественники биогенных аминов.
Образование
биогенных
аминов
(ГАМК,
гистамина,
серотониа
и
др.),
их
биологическая
роль,
пути
инактивации.
Физиологические эффекты гистамина:
стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона);
повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывая головную боль);
сокращает гладкую мускулатуру лёгких, вызывает удушье;
участвует в формировании воспалительной реакции
вызывает аллергическую реакцию;
выполняет роль нейромедиатора;
является медиатором боли.
Серотонин:
Стимулирует сокращение гладких мышц желудочно-кишечного тракта и, как следствие, повышение перистальтики ЖКТ;
Выражено стимулирует сокращение гладких мышц сосудов, кроме сосудов миокарда и скелетных мышц и, как следствие, повышение артериального давления
Слабо увеличивает тонус гладких мышц бронхов;
В центральной нервной системе является тормозным медиатором
В периферических нервных окончаниях обуславливает возникновение боли и зуда (например, при укусе насекомых).
Физиологические эффекты ГАМК. В центральной нервной системе ГАМК является тормозным медиатором.
Гниение белков в толстом кишечнике и обезвреживание продуктов гниения в печени с участием УДФГК и ФАФС.
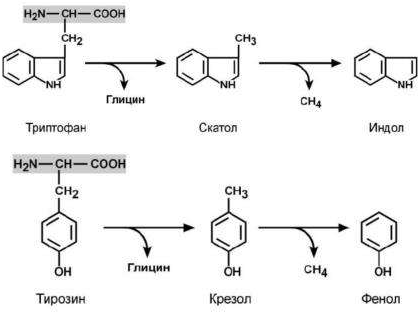
В печени происходит обезвреживание токсических веществ, поступающих из толстого кишечника, с помощью двух систем:
микросомального окисления,
системы конъюгации.
Вещества окисляются, а затем связываются с ФАФС и УДФГК. В клетках они часто находятся в связанном состоянии, например:
серная кислота связана с 3'-фосфоаденозин-5'- фосфатом и образует фосфоаденозин- фосфосульфат (ФАФС)
глюкуроновая кислота связана с уридилдифосфорной кислотой и образует уридил- дифосфоглюкуроновую кислоту (УДФГК).
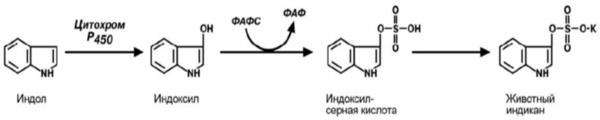
Короче: сначала токсические продукты гниения окисляются в результате микросомального окисления, а затем конъюгируют с ФАФС и УДФГК.
ФАФС и УДФГК являются переносчиками функциональных групп, необходимых для обезвреживания токсичных продуктов.
Обмен фенилаланина и тирозина в разных тканях: схема процессов. Фенилкетонурия, альбинизм, алкаптонурия.

Значительное накопление в тканях и жидкостях больного фенилаланина и его производных (фенилпировиноградная, фенилмолочная (миндальная), и вызванный ими ацидоз, прямое токсическое действие указанных веществ на ЦНС, нарушение синтеза простых и сложных белков в тканях, что вызывает тяжелые повреждения мозга и нарушение функции печени у большинства больных.
Основы лечения. Единственным методом лечения является диетотерапия – исключение из
питания больного высокобелковых продуктов питания с высоким количеством фенилаланина (мясо, рыба, яйцо, молоко, крупы).
Альбинизм
При полном отсутствии фермента – тотальная депигментация кожи, волос, глаз, причем окраска одинакова для всех расовых групп и не меняется с возрастом. Кожа не загорает, совершенно отсутствуют невусы, какие-либо пигментные пятна, развиваются фотодерматиты.
Основы лечения. Рекомендуется использовать различные средства защиты от ультрафиолетовых лучей.

Алкаптонурия
В основе заболевания лежит снижение активности печеночного фермента диоксигеназы
гомогентизиновой кислоты. в результате в организме накапливается гомогентизиновая кислота.
Одновременно гомогентизиновая кислота ингибирует лизилгидроксилазу, препятствуя синтезу коллагена, что делает хрупкими хрящевые образования. К пожилому возрасту наступает
дегенеративный артрит позвоночника и крупных суставов, межпозвонковые пространства сужены.
Лечение: ограничить потребление фенилаланина и тирозина. Назначают большие дозы аскорбиновой кислоты для защиты активности лизилоксидазы.
 Синтез
катехоламинов;
роль
витамина
В6
и
метионина.
Катаболизм
катехоламинов.
Роль
S-аденозилметионина
в
реакциях
метилирования.
Синтез
катехоламинов;
роль
витамина
В6
и
метионина.
Катаболизм
катехоламинов.
Роль
S-аденозилметионина
в
реакциях
метилирования.
В6
Вторая функция метионина основана на наличии в его структуре
реакционноспособной метильной группы. Для того, чтобы ее активировать, к метионину присоединяется остаток аденозина и образуется S-аденозилметионин (SAM).

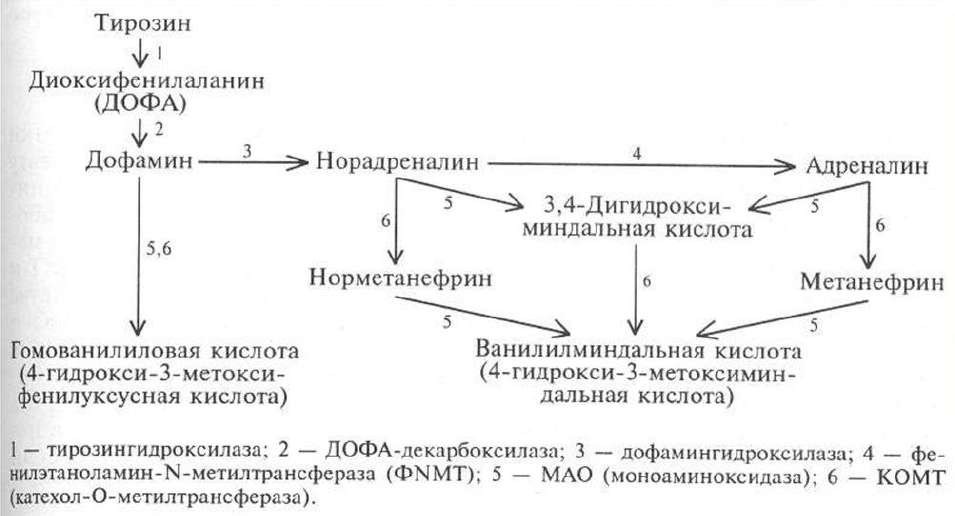
Инактивация адреналина происходит так же, как и обезвреживание других биогенных аминов:
при участии моноаминоксидазы,(см 45)
при действии катехол-О-метил-трансферазы (КОМТ), которая метилирует адреналин по 3- ОН-группе в присутствии S-аденозилметионина,
конъюгация производных адреналина с глюкуроновой кислотой. (см 49)