
Рожков Ю. И. Популяции, виды, эволюция
.pdf
Рис. 71. Упрощённая схема прибора для электрофореза белков в гелях. В зависимости от конструкции прибора гелевая пластина может располагаться вертикально или горизонтально. При щелочной реакции буфера большинство белков заряжены отрицательно и движутся от минуса к плюсу, разделяясь (по величине заряда и размеру молекулы) на фракции (фрагмент слева). После электрофореза, инкубируя гель с субстратом определённого фермента и с веществами, дающими цветную окраску, на продукты разложения субстрата, визуализируют соответствующие фракции (фрагмент справа).
Условные образцы фореграмм «с полиморфизмом» для мономерных и мультимерных белков изображены на рисунке 72. здесь на второй и третьей фореграммах дополнительные фракции для генотипа A/B появляются за счёт случайной комбинации различных субъединиц (A, B) в мультимерной молекуле. Например, для димера это три типа молекул – AA, AB и BB, в то время как для мономера – A и B (это показано на схематических изображениях молекул справа от условно изображённых гелевых блоков – фореграммах). Аллельные варианты белков в гомозиготах (A/A, B/B) могут быть представлены не одной, как показано на рисунке, а несколькими фракциями. В этом случае, естественно возрастает и число фракций у гетерозигот (A/В).
Картина значительно усложняется, когда мультимер собран из мономеров, кодируемых не одним, а двумя и более локусами (несколько примеров даны на рисунке 73).
Тем не менее, по подвижности фракций белка на такой фореграмме всегда возможно определить, какой набор аллельных генов, контролирующих данный белок, несёт особь, так как аллельные варианты белков (аллозимов, или аллелозимов – аллельных вариантов ферментов) чаще всего достаточно чётко (подобно изображённым на модельных фореграммах – рисунки 72 и 73) различаются между собой по зарядам, а в некоторых, очень редких случаях – и по молекулярной массе.
170
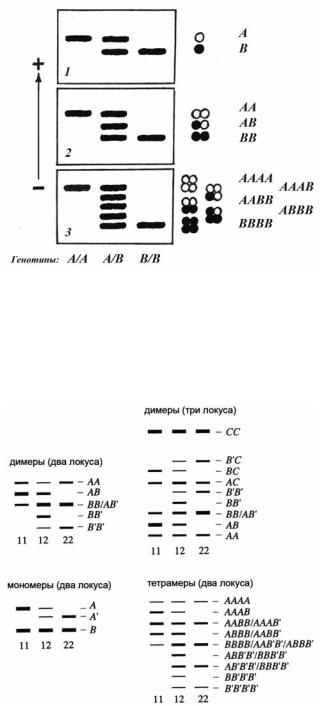
Рис. 72. Примеры молекулярных фенов (показаны условные фореграммы-схемы, аналогичные которым могут быть получены после разделения белков в гелях). Представлены три различных генотипа по анализируемому белку – A/A , A/B и B/B. Стрелкой обозначено направление электрофореза (в данном случае от – к + ). 1 – мономерный белок, 2 – димерный, 3 – тетрамерный. Справа от фореграмм – условные изображения белковых молекул разной «мерности» и буквенные эквиваленты для мономерных и мультимерных белков (Рожков, Проняев, 1994).
Рис. 73. Схема электрофоретических картин полиморфизма ферментов. А, В и С – субъединицы, кодируемые тремя локусами – А, В и С; А’, B’– субъединицы, кодируемые вариантами локусов А и В. Генотипы 11 и 22 – гомозиготы, 12 – гетерозиготы (Алтухов и др., 2004 с изменениями).
171

Как правило, если белок представляет собой мономер, то даже сверхвысокая множественность фракций не мешает различать генотипы.8
Показательный пример – α-амилаза1 парнокопытных. Особенно большим разнообразием множественных форм этого фермента отличаются все представители рода Bos и ближайшего к ним рода Bison.
На рисунке 74.1–3 (верхняя фореграмма) изображены только основные фракции без минорных, которых, в общем-то, не меньшее число.
Рис. 74. Энзимограммы (фореграммы) электрофоретического разделения α-амилаз и мальтазы различных видов животных в полиакриламидном геле (ПААГ). А – ПААГ-электрофорез. Б – аффинный ПААГ-электрофорез (при малом содержании субстрата в геле). В – аффинный ПА- АГ-электрофорез (при высоком содержании субстрата в геле). 1–3 – крупный рогатый скот; 4–7
– свинья; 8 – северный олень; 9, 10 – овца; 11 – коза; 12–14 – сайгак; 15 – лошадь; 16 – морская свинка; 17 – кролик; 18 – норка; 19 – соболь; 20 – человек (Рожков, Рожкова, 1987, с изменениями).
8 Обычные причины множественности фракций: модификации белков различными соединениями (например, сиаловыми кислотами); их протеолиз; наличие нескольких конформаций белковых молекул при одной и той же их аминокислотной последовательности. В редких случаях, возможно, это следствие альтернативного сплайсинга, когда из экзонов какого-либо белкового гена собирается несколько различающихся по первичной структуре информационных (матричных) РНК и образуются затем белковые молекулы с различиями в молекулярной массе и аминокислотных последовательностях. Известны и другие «редкостные» причины.
172
Верхний пакет фракций состоит из молекул массой9 около 85000 Да. Средние и нижние фракции содержат молекулы приблизительно от 105000 до 150000 Да, между которыми встречаются и фракции с молекулами менее 40000 Да (Рожков, Рожкова, 1987). «Стандартная» же масса α-амилазы, только что сошедшей с «конвейера» и готовая приступить к работе – где-то около 55000 Да.
Пострансляционное наращивание массы в случае амилаз обычно пытаются объяснить модификацией фермента поли- и олигосахаридами (Karn, Malacinski, 1978; Хьюз, 1985). Убыль – протеолизом.10
Такое сверхвысокое фракционное разнообразие, связанное с различиями и по зарядам, и по массе, тем не менее, нисколько не мешает чётко различать генотипы (рис. 74.1–3, средняя фореграмма) однако лишь при применении специального метода, позволяющего подальше «расставить» в геле аллозимы друг от друга (см. ниже).
Все рассмотренные выше примеры касаются кодоминантного наследования, то есть когда гетерозиготы отличаются от гомозигот. Но встречаются и редкие случаи доминантного наследования, когда одна из гомозигот неотличима от гетерозиготы (два простейших примера приведены на рис. 75). Связаны они могут быть с тремя основными причинами: с изменчивостью тесно сцепленных генов в малых мультигенных семействах, изменчивостью по генам – модификаторам белков и наличию – отсутствию анализируемого белка (фермента), то есть по сути дела с теми же причинами, которые определяют изменчивость по антигенам групп крови (см. выше).
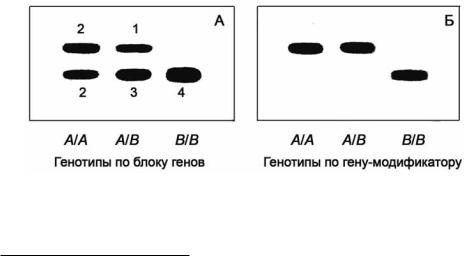
Рис. 75. Два случая доминантного наследования. А – блок (суперген) из двух тесно сцепленных генов (цифры – дозы генов). Б – действие полиморфного гена-модификатора, контролирующего модификацию мономерного белка.
9Масса молекул, принадлежащих любой фракции, определяется элементарным способом. Применяют «клиновидные» гели. Мысленно разделите изображённую на рисунке 71 пластину по диагонали и уберите карманы для проб. Нижний «клин» заполняется менее плотным гелем. Верхний – более плотным. Далее на свободную от карманов поверхность наносится единственная проба, проводится электрофорез и окраска. Выявленные при этом фракции расположатся в виде линий, идущих под углом. Этот угол и определит массу. Естественно первоначально гель должен быть откалиброван набором белков с известной массой (Рожков, Рожкова, 1987).
10Многие ферменты после протеолиза (потеряв около половины и более массы) остаются частично активными. Среди фракций амилаз как парнокопытных, так и видов, относящихся к другим отрядам млекопитающих (у всех у них «стандартная» масса α-амилазы также близка к 55000 Да), удаётся отыскать (в сыворотке крови) «осколки» фермента массой до 10000 Да, сохраняющие в какой-то мере α-амилазную активность.
173

Если, к примеру, имеется два тесно сцепленных и практически идентичных гена11, один из которых мономорфен, а другой имеет ещё и аллельный вариант, отличающийся по подвижности. Тогда блок из двух генов, наследующийся, как единое целое (как суперген), также будет иметь два варианта гомозигот: с двумя (рис. 75.А; А/А-генотип) и с одной (рис. 75.А; В/В-генотип) полосой. «Блоковая» гетерозигота (рис. 75.А; А/В- генотип) будет идентична А/А-гомозиготе.
Казалось бы в силу того, что концентрации белка во фракциях должны меняться в зависимости от генотипа (на рис. 75.А цифрами обозначены дозы генов), можно всё же как-то различить гетерозиготы. К сожалению, в большинстве случаев это не осуществимо. значительное варьирование активности генов и многие другие причины не позволяют этого сделать.
Если в блоке сцеплено не два, а большее число генов, один из которых двухаллельный, та же картина разделения будет сохраняться (рис. 75.А). Только верхняя фракция будет светлеть и утончаться по мере увеличения числа генов в блоке (и, следовательно, в результате относительного уменьшения числа молекул белка во фракции). Другой случай доминантного наследования связан с действием гена-модификатора, контролирующего присоединение к поверхности модифицируемого белка какой-либо химической группы. При полиморфизме по такому гену, выражающемуся в наличииотсутствии присоединяющихся продуктов или их способности-неспособности присоединять, возникает картина разделения, подобная приведённой на рисунке 75.Б.
В действительности такая картина будет наблюдаться далеко не всегда. Присоединение – неприсоединение, скорее всего, не осуществляется со 100% эффективностью, так что всегда должны оставаться молекулы, не «обработанные должным образом». В итоге появляются «двухфракционные» генотипы (точнее фенотипы), и общая картина разделения модифицируемого белка становится неотличимой от той, что изображена на рисунке 75.А. Видимо, поэтому в прошлом, когда о малых мультигенных семействах почти ничего не знали, предпочитали все случаи подобного рода интерпретировать, как действие генов-модификаторов.
Возможно, что подобных полиморфных генов-модификаторов не меньше, чем «обычных» генов, кодирующих полиморфные белки. Возможно даже и то, что многие гены этих двух групп тождественны друг другу, то есть «обычные» гены «по совместительству» действуют и как гены-модификаторы. Во всяком случае, это не исключено, так как аллозимы могут иметь различающиеся субстратные специфичности (что наблюдается иногда для эстераз) и «находить» необходимые им субстраты не только в растворах, но и на поверхностях белковых глобул.
Кроме того, конечно значительное число генов (вернее, кодируемых ими ферментов), по-видимому, специализировано только на модификации белков. Описанные нами антигены групп крови – вероятно, во многих случаях результат действия продуктов подобных генов – гликозилтрансферраз (Хьюз, 1985). Другой пример этого рода
– полиморфизм по генам, контролирующим модификацию трансферринов сиаловой кислотой (Spooner et al., 1977).
Имеется, по-видимому, и еще один источник, порождающий модификационную изменчивость белков.
Если сравнить скорости истинных ферментативных реакций и реакций, возможно приводящих к модификации, то окажется, что последние могут быть на несколько порядков меньше первых, так как «контакт» соединений и белков, участвующих в процессе модификации, в ряде случаев может продолжаться в течение нескольких
11 Вообще-то гены могут быть и не очень идентичны. Главное, чтобы их продукты, повергаемые электрофорезу, имели одинаковый заряд.
174

часов, суток и более (процесс лимитируется продолжительностью «жизни» модифицируемой молекулы белка). Такие реакции могут катализироваться уже не специальными ферментами, а белками вообще, которым потенциально присуща своего рода «псевдоферментативная» активность. Некоторые из подобных реакций можно наблюдать непосредственно, используя в качестве «псевдофермента», например, альбумин, иммуноглобулин или синтетические белковоподобные соединения (Титаев, 1974; Фокс, Дозе, 1975). «Старение» белков in vitro может во многом определяться реакциями этого типа. Следовательно, модификации белков в принципе могут возникать в результате «фоновой» каталитической активности самих же белков (даже тех, которые ферментами не являются). В том случае, если такие белки кодируются полиморфными генами, различия по структуре между их аллельными вариантами могут затрагивать и участки, придающие белку свойства «псевдофермента»-модификатора, то есть одни аллельные варианты могут иметь, а другие не иметь этих свойств. Отсюда напрашивается чисто гипотетический вывод, что обычная аллельная изменчивость по структурным генам самых обычных белков (неферментов) также способна порождать изменчивость по «наличию-отсутствию» генетически контролируемой модификации. К сожалению, работ с описанием модификационного полиморфизма немного12. Это, в первую очередь, видимо объясняется тем, что наследование здесь не кодоминантно, и, следовательно, требуется семейный анализ, что делает изучение этого типа изменчивости крайне сложным при работе с природными популяциями.
Третья причина доминантного наследования проиллюстрирована фотографиями гелевых пластин на рисунке 76.
У овец наблюдается полиморфизм по наличию-отсутствию α-амилазы 1 слюнной железы в сыворотке крови (76.Б, расшифровка фракционного состава на рис. 74.Б). Другие два вида парнокопытных, взятые для сравнения, мономорфны по этим состояниям: один – по наличию (северный олень Rangifer tarandus, 76.А), другой – по отсутствию (сайгак Saiga tatarica, 76.В). Подобного рода отсутствие фермента может определяться разными причинами: дефектным состоянием гена или его действительным отсутствием у части особей в популяции; изменчивостью, по каким-то другим генам, ответственным за поддержание активности на разных уровнях регуляции (от синтеза матрицы до выхода «готового к употреблению» белкового продукта); переход белка (фермента) из растворимой формы, например, в мебраносвязанную, что затрудняет его экстракцию из ткани и выявление методами электрофореза; изменчивостью по генам, ответственным за инкрецию фермента в кровоток. Последнее в нашем случае более вероятно. То есть и этот тип полиморфизма, как и предыдущий (связанный с модификациями) может быть обусловлен изменчивостью по каким-то посторонним генам, которые проявляют себя через других «действующих лиц».
Какие бы причины «отсутствия» ни были, аллельные гены, контролирующие это состояние, обычно называют нуль-аллелями.
Как правило, частоты абсолютного большинства нуль-аллелей в популяциях ниже полиморфного уровня (менее 0,01), и их существование объясняют давлением мутаций. Тем не менее, в отдельных случаях в популяциях поддерживаются достаточно высокие частоты нуль-аллелей (Полякова, 1991).
Кроме генов-модификаторов, нуль-аллелей и прочего, особый интерес представляют полиморфные гены-регуляторы, способные в широких пределах изменять функциональную активность белковых молекул.
Сведения по изменчивости генов-регуляторов эпизодичны. Известно, например, что полиморфизм активности одной из молекулярных форм лактатдегидрогеназы
12 Если не считать полиморфизма групп крови, выявляемого иммуногенетическими методами.
175
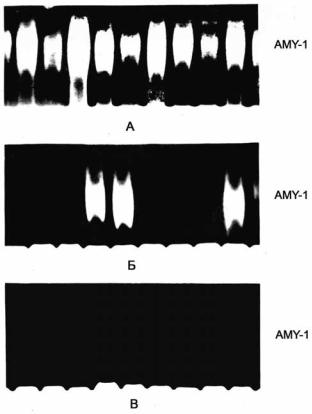
Рис. 76. Аффинное разделение в ПААГ изоферментов α-амилазы 1 (AMY-1) парнокопытных. А – северные олени; Б – овцы; В – сайгаки.
у некоторых млекопитающих может определяться действием регуляторного гена Ldr-1 (Корочкин, 1977). В качестве другого примера можно привести различную временнýю экспрессию продукта эстеразного гена у Drosophila, находящегося, по-видимому, под контролем полиморфного гена-регулятора (Раушенбах и др., 1984).Всвоёвремяопубликованоисследованиепорегуляциигена β-глюкуронидазы у 12 близких видов и подвидов рода Mus. Авторы определяли активность фермента в 6 разных тканях после обработки животных гормонами. Как внутри видов, так и на межвидовом уровне они обнаружили большое разнообразие регуляторных фенотипов, что свидетельствует о наличии полиморфизма по различным регуляторным факторам, оказывающим влияние на индукцию β-глюкуронидазы (Bush, Paigen, 1992).
Можно привести и ряд других работ, которые прямо или косвенно свидетельствуют о наличии в популяциях полиморфизма по генам-регуляторам.
Особая трудность в выявлении изменчивости такого типа заключается в том, что в качестве регуляторных генов могут выступать привычные нам структурные гены, кодирующие соответствующие белки-регуляторы, или гены, в которых регулирующим началом является продукт транскрипции (РНК). Наконец, подобными «генами» могут оказаться и не гены вовсе, а такие регуляторные элементы, как промоторы (специфичные участки ДНК, связывающие РНК-полимеразу, осуществляющую транскрипцию
176

структурного гена), энхансеры (последовательности ДНК, усиливающие транскрипцию гена), сайленсеры (элементы-ослабители транскрипции гена).
Вернемся однако вновь к привычному для популяционистов типу полиморфизма с кодоминантным наследованием аллелей и, соответственно, аллозимами, различающимися по зарядам.
К сожалению только 1/3 замен аминокислотных остатков в белковых молекулах сопряжена со значимыми изменениями зарядов и, следовательно, может быть обнаружена в виде отдельных электроморф (аллозимов). 2/3 аллельных вариантов белков остаются неразличимыми. Это обстоятельство послужило в своё время поводом для поискаметодов,основанныхнаразделенииаллозимовнепозарядам,аподругимпараметрам, позволяющим хотя бы частично выявить эту скрытую часть изменчивости.
Основным методом в данном случае являлось изоэлектрофокусирование белков – электрофоретическое разделение белков в гелях по их изоэлектрическим точкам (Галь и др., 1982). Во многих случаях, но далеко не всегда, используя этот метод, удавалось открыть различные аллельные варианты белков в системах, считавшихся ранее мономорфными (т.е. представленными в популяции одним аллельным вариантом), или обнаружить дополнительные варианты в полиморфных системах.
Другой метод, именуемый аффинным электрофорезом, основан на разделении неразличимых по зарядам аллозимов по их константам Михаэлиса (Кm), характеризующим сродство фермента к субстрату, закреплённому неподвижно в геле. При этом подвижности различных аллозимов относительно друг друга, например, A и B, имеющих константы КmА и КmВ, будут практически равны отношению этих констант КmА/ КmВ, (Рожков, 1983 а, б; Rozhkov, Galimov, 1990). С помощью этого подхода удалось показать, что мономорфные (относительно обычных методов электрофореза) системы в некоторых случаях оказываются на самом деле полиморфными.
На рисунке 77 в качестве примера приведены фотографии гелевых пластин, не содержащих (вверху) и содержащих (внизу) субстрат13, включённый в гель в небольших количествах. В первом случае выявляется обычный «зарядовый» полиморфизм амилазы поджелудочной железы (AMY-2). Во втором Km-полиморфизм амилазы слюнной железы (AMY-1). Графические расшифровки даны на рисунке 74, 4–7 (верхняя и средняя энзимограммы). При высоком содержании субстрата AMY-1 и AMY-2 задерживаются на старте, что позволяет выявить Km-полиморфизм другого фермента – мальтазы (рис. 74, нижняя энзимограмма).
Ещё один подход, использовавшийся для выявления скрытой изменчивости, основан на разной термочувствительности аллозимов. Не различимые по электрофоретической подвижности аллозимы могут быть дифференцированы в результате их прогревания при температурах, приводящих к инактивированию одних аллозимных вариантов (и, следовательно, к отсутствию специфической окраски на фермент в геле или в пробирке) и сохранению этой активности у других, термоустойчивых аллозимов (Trippa et al., 1978; Bonhomme, Selander, 1978).
Известны и другие методические подходы выявления скрытых форм изменчивости. Анализ белков, какие бы хитроумные методы не использовались для выявления «скрытой» в них изменчивости, никогда, тем не менее, не даёт полной информации об
изменчивости на генном уровне.
Как известно, генетический код вырожден, то есть одному и тому же аминокислотному остатку в белковой молекуле могут соответствовать кодоны с разными наборами нуклеотидов. Одно это уже говорит о том, что на уровне генов аллельная изменчивость должна быть выше, чем изменчивость на уровне белков, кодируемых этими генами. В
13 В качестве субстрата использовался разной степени гидролиза крахмал и декстрин.
177

Рис. 77. Результаты электрофоретического разделения изоферментов α-амилазы 1 (AMY-1) и α-амилазы 2 (AMY-2) сыворотки крови домашних и диких свиней (Sus scrofa). Вверху – ПААГэлектрофорез. Внизу – аффинный ПААГ-электрофорез.
данном случае неважно, какой из синонимичных кодонов используется в популяции по определённому гену в конкретной позиции. Важно то, что все эти кодоны кодируют одну и ту же аминокислоту, и, следовательно, структура любого белка будет оставаться абсолютно неизменной при каких угодно вариациях в пределах этих синонимичных кодонов14.
Кроме того, нужно учитывать, что гены состоят из чередующихся между собой экзонов и интронов. Только первые сохраняются впоследствии в матричной РНК и передают заключённую в них информацию белкам (трансляция). Вторые же, хотя и транскрибируются вместе с экзонами, входят лишь в состав проматричной РНК, из которой вскоре исключаются (сплайсинг) по мере её перехода вследствие ряда ферментативных процессов (процессинг) в матричную РНК. Доля интронов в гене (по
14 Как выяснилось недавно, всё это абсолютно соответствует действительности, когда рассматривается лишь первичная структура белков (последовательность аминокислот). Структуры более высокого порядка иногда могут изменяться в зависимости от используемого синонимичного кодона. Происходит это вследствие того, что сходящая с рибосомы полипептидная цепочка при использовании редкого синонимичного кодона, долго «поджидая» соответствующую транспортную РНК и «не дождавшись» её вовремя сворачивается в трёхмерную структуру, удобную для данных обстоятельств, а не в такую, как надо. В результате образуется молекула с иной конформацией (и даже, возможно, с иными электрофоретическими, каталитическими и иными свойствами).
178

числу пар нуклеотидов) часто значительно превышает долю экзонов. Естественно, эту изменчивость можно обнаружить, лишь непосредственно анализируя сами гены. То же относится к различного рода регуляторным и спейсерным (разделительным) последовательностям, обрамляющим гены, и вообще ко всей прочей ДНК, содержащейся в хромосомах эукариот.
Последняя, составляющая значительную часть от всей ДНК скорее всего выполняет главным образом «канатную» функцию, скрепляя гены друг с другом в единые группы сцепления (хромосомы). Так как не очень важно, из какого материала (нуклеотидных последовательностей) состоят канаты, лишь бы они играли свою простую, но важную механическую роль, материал как количественно, так и качественно может варьировать в широких пределах, например, состоять из различного рода повторов, включать в себя мобильные генетические элементы (МГЭ), проретровирусы 15.
Всё это несметное количество «канатной» и «генной»16 ДНК по величине генетического полиморфизма должно намного превышать соответствующую величину, определяемуюпобелкам.Отсюдавозникланеобходимостьперейтиотпопуляционногоанализа белков к анализу ДНК. Стремительное развитие молекулярной генетики в 80-х годах прошлого века позволило получить приемлемый метод для такого рода исследований. Основывался он на использовании только что открытых (Arber, 1979) рестриктаз (ферментов, расщепляющих ДНК в участках со строго определённой короткой последовательностью нуклеотидов, специфичной для каждого типа рестриктаз) с последующим
15Так как ДНК любой хромосомы достигает гигантских размеров (на порядки большие размеров клетки), а активна в данный момент только небольшая ее часть, то другая часть, по крайней мере, в целях «безопасности» и прочего (регуляция) должна быть упакована в более плотные и не «мешающие» структуры. Ещё более плотно и тщательно должна упаковываться вся ДНК перед ее транспортировкой (деление клетки). Пакуют ДНК специальные белки (гистоны и прочие), сродство которых к пакуемым нитям зависит от их нуклеотидного состава (Разин, Быстрицкий, 2009). Участки с функционально нагруженной ДНК могут не отличаться высоким сродством. Рассеивание генов в «канатах» и рассеивание в генах интронов, отличающихся более высоким сродством, по-видимому, повышает качество сборки хромосом (Колчанов, Суслов, 2006), являясь, вероятно, одной из причин существования в их составе «ненужной» ДНК. Другая причина, как предполагают некоторые, та, что ДНК способна выступать в качестве цитоскелета ядра, выполняя (в какой-то мере) эту функцию наряду со специально имеющимися для этих целей белками. Если это так, тогда некоторый ее избыток может быть полезен (Cavalier – Smith, 2002). Ещё одна возможная функция «канатов»– это отвлечение на себя и тем самым защита функционально значимых для организма генов от тех же МГЭ или ретровирусов. Представим себе, что «канаты» вдруг стали ничтожны по размерам, да ещё к тому же непривлекательны для встраивания в них всевозможной мобильной «мусорной» ДНК. Тогда в периоды «транспозиционных взрывов», когда мобильные элементы начинают активно перемещаться по геному и им «некуда деться», кроме как встроиться в какой-нибудь ген, могло бы не появиться ни одной полноценной особи. Вспомним, что, попадая в ген (экзон), мобильный элемент инактивирует его, разделяя на две части. Таких же событий у воображаемых «бесканатных» эукариот должно было бы происходить необыкновенно много. Отсюда вывод: отбор должен поддерживать необходимую длину и привлекательность «канатов» для сбора разнообразного «мусора» и тем самым частичной его инактивации. заметим также, что всё это имеет прямую аналогию из области биохимической кинетики – взаимодействие фермента с конкурентным ингибитором, вытесняющим субстрат из реакции. Нетрудно догадаться, кому здесь что соответствует.
16Судя по результатам расшифровки геномов, характерное число генов для беспозвоночных, по-видимому, лежит в пределах 12000 – 20000, для позвоночных – 30000 – 40000, для прокариот число генов на порядок меньше этих цифр (Carroll, 2001). Оценки числа генов постоянно меняются. Для человека в 60–70-х годах ХХ века их оценивали в 300000. затем планку понизили двух-, трёхкратно. С началом расшифровки генома ещё снизили до 40000–50000. Теперь считается, что их где-то около 30000 плюс-минус несколько тысяч. Самые рьяные уменьшители числа генов и вообще полагают, что их у человека может быть тысяч двадцать или даже существенно меньше. Учитывая разнообразие в понимании, что такое ген, видимо и впредь цифры будут значительно «плясать».
179
